2. 中南民族大学药学院, 湖北 武汉 430074
2. College of Pharmacy, South Central University for Nationalities, Wuhan 430074, China
五叶山小橘Glycosmis pentaphylla (Retz.) Correa是芸香科(Rutaceae)山小橘属Glycosmis Correa植物,为我国传统傣药,为滋补强壮药,分布于云南西双版纳、耿马、双江、孟定,生于海拔500~1 100 m的低山热带丛林。具有补土健胃、强身健体、除风通血止痛等功效[1]。现代药理研究表明,五叶山小橘茎及叶的醇提物具有抗微生物、抗氧化活性[2],以及表现出显著的体外抗肝癌细胞株Hep3 B的活性[3]。前期对该植物化学成分的研究主要是针对脂溶性的生物碱,已报道的有吖啶酮[4]、咔唑[5]、喹诺酮[6]和喹唑啉[7,8]等结构类型,而对其非生物碱成分研究很少,目前仅有异黄酮苷[9]和对苯二酚双糖苷[10]等报道。本课题组在前期已对五叶山小橘醋酸乙酯部位进行了化学成分研究,分离得到10个生物碱和7个非生物碱,其中包括3个新的咔唑生物碱和2个新的黄烷醇,并对生物碱的光活化抗微生物和DNA的结合性进行了研究[11,12,13]。为了进一步从该植物中寻找活性成分,阐明其药效作用的物质基础,为开发新的药用植物资源提供依据。本实验对五叶山小橘茎的95%乙醇提取物的正丁醇部位进行了系统的化学研究,分离得到9个化合物,分别鉴定为2-羟基苯甲酸甲酯2-O-β-D-呋喃芹菜糖基- (1→2)-O-β-D-吡喃葡萄糖苷(methyl 2-hydroxy- benzoate 2-O-β-D-apiofuranosyl-(1→2)-O-β-D-gluco- pyranoside,1)、肌苷(inosine,2)、4-甲氧基-8- (O-β-D-吡喃葡萄糖)-2(1H)-喹啉酮 [4-methoxy-8- (O-β-D-glucopyranosyloxy)-2(1H)-quinolinone,3]、threo-guaiacyl-glycerol-8-O-4′-sinapyl ether 7-O-β-D- glucopyranoside(4)、牡荆素(vitexin,5)、乙基-O- β-D-吡喃葡萄糖苷(ethyl-O-β-D-glucopyranoside,6)、2-异丙基-O-β-D-吡喃葡萄糖苷(2-propyl-O-β- D-glucopyranoside,7)、苏式-愈创木基甘油(threo- guaiacyl glycerol,8)、赤式-愈创木基甘油(erythro- guaiacyl glycerol,9)。其中,化合物1为新化合物,命名为五叶山小橘甲素,化合物2~4、6~9为首次从山小橘属植物中分离得到。
1 材料与仪器Perkin-Elmer 341旋光仪(珀金埃尔默公司);BrukerAM—400或Bruker DRX—500型核磁共振波谱仪(布鲁克公司);Finnigan MAT 95或Finnigan LCQ-Deca型质谱仪(美国菲尼根公司);Ultimate 3000型高效液相色谱仪(美国戴安公司);半制备型色谱柱为5C18-MS-II(250 mm×10 mm,5 μm);200~300目硅胶和硅胶H-TLC薄层预制板(青岛海洋化工厂);50 μm反相材料ODS(日本YMC公司);色谱甲醇和乙腈由美国Tedia试剂公司生产,其余试剂均为分析纯,由天津博迪化工有限公司和国药集团化学试剂有限公司生产。
五叶山小橘茎采于云南西双版纳,经云南西双版纳州民族医药研究所赵应红主任药师鉴定为芸香科山小橘属植物五叶山小橘Glycosmis pentaphylla (Retz.) Correa的茎。
2 提取与分离五叶山小橘茎24.5 kg,粉碎,用95%乙醇室温浸泡3次,每次24 h。浓缩后得乙醇提取物(586 g)。将乙醇提取物用90%甲醇溶解,然后用石油醚萃取3次,合并上层萃取液并蒸干,得到石油醚提取物(56 g)。减压回收下层的甲醇得到浸膏,将其用水溶解,再依次用醋酸乙酯和正丁醇萃取,得到醋酸乙酯提取物(91 g)和正丁醇提取物(101 g)。取正丁醇萃取物(101 g),经硅胶柱色谱分离,氯仿-甲醇(95∶5→0∶1)梯度洗脱,共收集10个组分(Fr. 1~10)。Fr. 4(3.0 g)经过反复正、反相硅胶柱色谱和半制备HPLC得到化合物6(7.7 mg)和7(4.5 mg)。Fr. 5(9.6 g)经过反复正、反相硅胶柱色谱和半制备HPLC得到化合物2(30 mg)、3(5.9 mg)、4(10 mg)、8(5 mg)和9(2 mg)。Fr. 6(11.1 g)经过反复正、反相硅胶柱色谱和半制备HPLC得到化合物1(6 mg)、5(12 mg)。
3 化合物1的酸水解取化合物1(2 mg)溶于4 mL CF3COOH(4 mol/L)溶液中,在95 ℃反应3 h,冷却至室温,用等体积(2 mL)的CH2Cl2萃取反应溶液3次,将萃取后的水层完全浓缩。取D-葡萄糖(中国食品药品检定研究院,批号110833)和D-芹糖(Sigma-Aldrich,批号41239)的标准品各2 mg,以及萃取后的水相分别装在3个25 mL的圆底烧瓶中,分别加入无水吡啶(0.5 mL)和L-半胱氨酸甲酯盐酸盐(1.0 mg),在60 ℃时反应1 h。冷却后,分别加入5 μL邻甲苯异硫氰酸酯,60 ℃下反应1 h。冷却至室温,将以上3组反应液用吡啶稀释1倍,分别取样品(5 μL)经HPLC(乙腈-水25∶75,0.8 mL/min)进行分析,检测波长为250 nm,分析柱为Waters色谱柱(250 mm×4.6 mm)。化合物1的酸水解产物通过HPLC的分析在tR=18.8 min和tR=31.1 min有色谱峰;D-葡萄糖与D-芹糖衍生物在tR=18.8 min和tR=31.1 min有色谱峰。
4 结构鉴定化合物1:无色油状物,[a]23.8 D-141.68 (c 0.099,MeOH),由HR-ESI-MS得到准分子离子峰m/z: 445.135 2 [M-H]- (计算值445.134 6),推断该化合物的分子式为C19H26O12。IR光谱在3 357、1 713 cm-1显示有吸收峰,表明该化合物含有羟基和羰基。由酸水解结果可知,化合物1含有1分子D-葡萄糖和1分子的D-芹糖。在1H-NMR(500 MHz,CD3OD)中,葡萄糖的端基质子δH 5.06 (1H,d,J = 7.6 Hz) 及端基碳δC 100.8和芹糖的端基碳δC 111.5,说明糖的构型均为β-构型[14];除糖的NMR信号外,苷元还显示有4个芳香质子δ 7.01 (1H,t,J = 7.6 Hz),7.19 (1H,d,J = 8.0 Hz),7.44 (1H,td,J = 8.8,1.6 Hz),7.64 (1H,dd,J = 8.0,1.6 Hz),表明有1,2-双取代苯环;13C-NMR和DEPT数据证实了上述推断。NMR数据显示该化合物还含有1个甲氧基 [δH 3.84 (3H,s);δC52.9] 以及1个与苯环共轭的羰基碳信号 (δC 169.1)。比较化合物1与已知化合物canthoside A[15]的波谱数据,发现两者的苷元一致,其波谱数据主要差异在于化合物1中葡萄糖C-2和C-6分别在δ 80.3和δ 62.6;而canthoside A中C-2向高场位移至δ 74.9和C-6向低场位移至δ 68.8,表明化合物1与canthoside A结构差别在于芹糖同葡萄糖连接位置不一样。由HMBC谱(图 1)可得,芹糖的端基质子5.36 (1H,d,J = 2.0 Hz,H-1″) 与葡萄糖C-2相关,说明芹糖连接在葡萄糖C-2位。因此,确定了化合物1的结构为2-羟基苯甲酸甲酯2- O-β-D-呋喃芹菜糖基-(1→2)-O-β-D-吡喃葡萄糖苷,命名为五叶山小橘甲素,具体核磁数据见表 1。
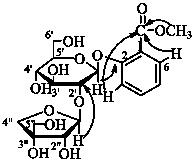 | 图 1 化合物1的主要HMBC相关 Fig. 1 Key HMBC correlations of compound 1 |
|
|
表 1 化合物1的1H-NMR (400MHz,CD3OD)和13C-NMR (100MHz,CD3OD)数据 Table 1 1H-NMR (400 MHz,CD3OD) and 13C-NMR (100 MHz,CD3OD) data of compound 1 |
化合物2:白色粉末。1H-NMR (500 MHz,C5D5N) δ: 8.63 (1H,s,H-2),8.76 (1H,s,H-8),6.75(1H,d,J = 5.9 Hz,H-1′),5.52 (1H,dd,J = 4.2,3.6 Hz,H-2′),5.08 (1H,t,J = 5.3 Hz,H-3′),4.78 (1H,dd,J = 5.1,2.4 Hz,H-4′),4.16 (1H,dd,J = 12.0,2.4 Hz,H-5′a),4.33 (1H,dd,J = 12.3,2.4 Hz,H-5′b);13C-NMR (100 MHz,C5D5N) δ: 153.3 (C-2),149.6 (C-4),121.5 (C-5),157.7 (C-6),140.6 (C-8),90.8 (C-1′),75.6 (C-2′),72.4 (C-3′),87.8 (C-4′),63.0 (C-5′)。以上数据与文献报道基本一致[16],故鉴定化合物2为肌苷。
化合物3:白色粉末。1H-NMR (500 MHz,DMSO-d6) δ: 5.92 (1H,s,H-3),7.44 (1H,d,J = 8.0 Hz,H-5),7.08 (1H,t,J = 8.0 Hz,H-6),7.32 (1H,d,J = 8.0 Hz,H-7),3.92 (3H,s,-OCH3),4.83 (1H,d,J = 7.6 Hz,H-1′),3.72~3.12 (5H,m,H-2′~6′),10.60 (1H,s,-NH-);13C-NMR (125 MHz,DMSO-d6) δ: 162.9 (C-2),97.0 (C-3),163.3 (C-4),115.3 (C-5),121.4 (C-6),115.9 (C-7),143.5 (C-8),128.9 (C-9),115.4 (C-10),56.2 (-OCH3),101.8 (C-1′),73.1 (C-2′),75.4 (C-3′),69.8 (C-4′),77.3 (C-5′),60.7 (C-6′)。以上数据与文献报道基本一致[17],故鉴定化合物3为4-甲氧基-8-(O-β-D-吡喃葡萄糖)-2(1H)-喹啉酮。
化合物4:无色油状物。1H-NMR (500 MHz,C5D5N) δ: 6.81 (2H,s,H-3′,5′),6.89 (1H,d,J = 16.0 Hz,H-7′),6.61 (1H,dt,J = 16.0,5.0 Hz,H-8′),4.60~4.61 (2H,m,H-9),7.91 (1H,d,J = 1.5 Hz,H-2),7.29 (1H,d,J = 8.0 Hz,H-5),7.48 (1H,dd,J = 8.0,1.5 Hz,H-6),6.11 (1H,d,J = 3.5 Hz,H-7),4.96~4.97 (1H,m,H-8),4.64 (1H,dd,J = 11.5,6.0 Hz,H-9a),4.07 (1H,dd,J = 12.0,5.5 Hz,H-9b),5.06 (1H,overlapped,H-1″),4.20 (2H,m,H-2″,4″),3.92 (1H,m,H-3″),4.21 (1H,m,H-5″),4.57 (1H,m,H-6″a),4.32~4.34 (1H,m,H-6″b);13C-NMR (125 MHz,C5D5N) δ: 135.5 (C-1′),154.4 (C-2′,6′),104.7 (C-3′,5′),134.0 (C-4′),129.9 (C-7′),131.4 (C-8′),63.2 (C-9′),131.0 (C-1),113.2 (C-2),149.8 (C-3),148.7 (C-4),116.7 (C-5),121.8 (C-6),78.5 (C-7),87.3 (C-8),61.9 (C-9),103.1 (C-1″),75.5 (C-2″),78.7 (C-3″),72.6 (C-4″),78.8 (C-5″),63.5 (C-6″)。以上数据与文献报道基本一致[18],故鉴定化合物4为threo-guaiacyl-glycerol-8-O-4′-sinapyl ether 7-O-β-D glucopyranoside。
化合物5:黄色粉末(甲醇)。1H-NMR (500 MHz,DMSO-d6) δ: 8.02 (2H,d,J = 8.6 Hz,H-2′,6′),6.90 (2H,d,J = 8.6 Hz,H-3′,5′),6.27 (1H,s,H-3),6.79 (1H,s,H-6),13.18 (1H,s,5-OH),10.91 (1H,s,7-OH),10.41 (1H,s,4′-OH),5.06~4.67 (4H,m,Glc-OH),4.64 (1H,d,J = 7.1 Hz,H-1″),3.24~3.85 (6H,m,H-2″~6″);13C-NMR (125 MHz,DMSO-d6) δ: 164.0 (C-2),102.5 (C-3),182.1 (C-4),160.4 (C-5),98.1 (C-6),162.6 (C-7),104.6 (C-8),156.0 (C-9),104.1 (C-10),121.6 (C-1′),129.0 (C-2′,6′),115.8 (C-3′,5′),161.2 (C-4′),78.7 (C-1″),73.4 (C-2″),70.8 (C-3″),70.6 (C-4″),81.9 (C-5″),61.3 (C-6″)。以上数据与文献报道基本一致[19],故鉴定化合物5为牡荆素。
化合物6:白色粉末。1H-NMR (400 MHz,CD3OD) δ: 1.13 (3H,m,H-2),3.47 (1H,overlapped,H-1a),3.81 (1H,m,H-1b),4.11 (1H,d,J = 7.8 Hz,H-1′),3.02~3.85 (6H,m,H-2′~6′);13C-NMR (100 MHz,CD3OD) δ: 15.2 (-CH3),63.9 (-CH2),102.6 (C-1′),73.5 (C-2′),76.8 (C-3′),70.1 (C-4′),76.8 (C-5′),61.1 (C-6′)。以上数据与文献报道基本一致[20],故鉴定化合物6为乙基-O-β-D-吡喃葡萄糖苷。尽管有文献报道从荔枝[20]和细叶鸢尾[21]中分离得到该化合物,但该化合物可能是提取分离过程中产生的人工产物。
化合物7:白色粉末。1H-NMR (400 MHz,CD3OD) δ: 1.18 (3H,d,J = 6.1 Hz,H-2),1.23 (3H,d,J = 6.2 Hz,H-3),4.03 (1H,m,H-1),4.32 (1H,d,J = 7.8 Hz,H-1′),3.13 (1H,dd,J = 9.0,7.9 Hz,H-2′),3.34~3.25 (m,H-3′~5′),3.67 (1H,dd,J = 12.0,5.2 Hz,H-6′a),3.83 (1H,dd,J = 12.0,2.0 Hz,H-6′b);13C-NMR (100 MHz,CD3OD) δ: 22.0 (CH3),23.8 (CH3),72.5 (CH),102.5 (C-1′),75.1 (C-2′),78.1 (C-3′),71.7 (C-4′),77.8 (C-5′),62.7 (C-6′)。以上数据与文献报道基本一致[22],故鉴定化合物7为2-异丙基-O-β-D-吡喃葡萄糖苷。尽管也有文献报道从青花椒[23]中分离得到该化合物,但该化合物可能是提取分离过程中产生的人工产物。
化合物8:褐色油状物。1H-NMR (500 MHz,CD3OD) δ: 6.97 (1H,d,J = 1.2 Hz,H-2),6.74 (1H,d,J = 8.1 Hz,H-5),6.77 (1H,dd,J = 8.0,1.4 Hz,H-6),4.50 (1H,d,J = 6.0 Hz,H-7),3.64 (1H,m,H-8),3.46 (1H,dd,J = 11.3,3.9 Hz,H-9a),3.33 (1H,dd,J = 11.2,6.4 Hz,H-9b),3.84 (3H,s,3-OCH3);13C-NMR (125 MHz,CD3OD) δ: 134.8 (C-1),111.6 (C-2),148.9 (C-3),147.1 (C-4),115.9 (C-5),120.7 (C-6),75.5 (C-7),77.6 (C-8),64.3 (C-9),56.4 (-OCH3)。以上数据与文献报道基本一致[24],故鉴定化合物8为苏式-愈创木基甘油。
化合物9:褐色油状物。1H-NMR (500 MHz,CD3OD) δ: 6.98 (1H,d,J = 1.0 Hz,H-2),6.74 (1H,d,J = 8.0 Hz,H-5),6.80 (1H,dd,J = 8.0,1.5 Hz,H-6),4.50 (1H,d,J = 6.0 Hz,H-7),3.70 (1H,m,H-8),3.63 (1H,m,H-9a),3.50 (1H,dd,J = 11.0,6.0 Hz,H-9b),3.84 (3H,s,3-OCH3);13C-NMR (125 MHz,CD3OD) δ: 135.1 (C-1),112.1 (C-2),148.9 (C-3),147.2 (C-4),115.9 (C-5),121.2 (C-6),76.3 (C-7),76.8 (C-8),64.7 (C-9),56.4 (-OCH3)。以上数据与文献报道基本一致[24],故鉴定化合物9为赤式-愈创木基甘油。
| [1] | 林艳芳, 衣 专, 赵应红. 中国傣医药彩色图谱 [M]. 昆明: 云南民族出版社, 2003. |
| [2] | Howlader M A, Rizwan F, Sultana S, et al. Antimicrobial, antioxidant and cytotoxic effects of methanolic extracts of leaves and stems of Glycosmis pentaphylla (Retz.) Correa [J]. J Appl Pharm Sci, 2011, 1(8): 137-140. |
| [3] | Sreejith P S, Mascarenhasb R R, Praseeja R J, et al. The apoptosis inducing effect of Glycosmis pentaphylla (Retz.) Correa and its influence on gene expression in hepatocellular carcinoma cell line, Hep3 B [J]. J Ethnopharmacol, 2011, 139(2): 359-365. |
| [4] | Quader M A, Nutan M T H, Rashid M A, et al. Antitumor alkaloid from Glycosmis pentaphylla [J]. Fitoterapia, 1999, 70(3): 305-307. |
| [5] | Chakraborty A, Chowdhury B K, Jash S S, et al. Carbazole alkaloids from Glycosmis pentaphylla [J]. Phytochemistry, 1992, 31(7): 2503-2505. |
| [6] | Bhattacharyya P, Chowdhury B K. Glycolone, a quinolone alkaloid from Glycosmis pentaphylla [J]. Phytochemistry, 1985, 24(3): 634-635. |
| [7] | Muthukrishnan J, Seifert K, Hoffmann K H, et al. Inhibition of juvenile hormone biosynthesis in Gryllus bimaculatus by Glycosmis pentaphylla leaf compounds [J]. Phytochemistry, 1999, 50(2): 249-254. |
| [8] | Sarkar M, Chakraborty D P. Glycophymoline, a new minor quinazoline alkaloid from Glycosmis pentaphylla [J]. Phytochemistry, 1979, 18(4): 694-695. |
| [9] | Wang J S, Yang X W, Di Y T, et al. Isoflavone diglycosides from Glycosmis pentaphylla [J]. J Nat Prod, 2006, 69(7): 778-782. |
| [10] | Wang J S, Di Y T, Yang X W, et al. Hydroquinone diglycoside acyl esters from the stems of Glycosmis pentaphylla [J]. Phytochemistry, 2006, 67(5): 486-491. |
| [11] | Yang G Z, Wu Y, Chen Y. Alkaloids from the Stems of Glycosmis pentaphylla [J]. Helv Chim Acta, 2012, 95(8): 1449-1454. |
| [12] | Chen Y, Yang B, Yang G Z, et al. Photo-activated DNA binding and antimicrobial activities of alkaloids from Glycosmis pentaphylla [J]. Acta Pharm Sin, 2012, 47(12): 1646-1652. |
| [13] | Wu Y, Hu X, Yang G Z, et al. Two new flavanols from Glycosmis pentaphylla [J]. J Asian Nat Prod Res, 2012, 14(8): 738-742. |
| [14] | Ramesh P, Yuvarajan C R. Coromandelin, a new isoflavone apioglucoside from the leaves of Dalbergia coromandeliana [J]. J Nat Prod, 1995, 58(8): 1240-1241. |
| [15] | Zhou Y H, Jiang Y, Wen J, et al. Chemical constituents from the roots of Polygala sibirica L [J]. J Chin Pharm Sci, 2008, 17(2): 148-152. |
| [16] | 曹新伟. 川贝母的化学成分研究与贝母属药用植物质量评价 [D]. 北京: 中国协和医科大学, 2008. |
| [17] | Su Y F, Luo Y, Guo C Y, et al. Two new quinoline glycoalkaloids from Echinops gmelinii [J]. J Asian Nat Prod Res, 2004, 6(3): 223-227. |
| [18] | Machida K, Sakamoto S, Kikuchi M. Two new neolignan glycosides from leaves of Osmanthus heterophyllus [J]. J Nat Med, 2009, 63(2): 227-231. |
| [19] | 郑建宇, 纳 智, 胡华斌. 海南山小橘枝叶的化学成分研究 [J]. 中草药, 2013, 44(6): 651-654. |
| [20] | 徐新亚, 谢海辉, 魏孝义. 荔枝核的五个苷类成分 [J]. 热带亚热带植物学报, 2012, 20(2): 206-208. |
| [21] | Choudharya M I, Hareem S, Siddiqui H, et al. A benzil and isoflavone from Iris tenuifolia [J]. Phytochemistry, 2008, 69(9): 1880-1885. |
| [22] | Li W, Koike K, Asada Y, et al. Biotransformation of low-molecular-weight alcohols by Coleus forskohlii hairy root cultures [J]. Carbohydr Res, 2003, 338(8): 729-731. |
| [23] | Fang Z, Do Y J, Kim Y H, et al. Cytotoxic Constituents from the Leaves of Zanthoxylum schinifolium [J]. Bull Korean Chem Soc, 2010, 31(4): 1081-1084. |
| [24] | 甘茂罗. 花藤和瑶山润楠的化学成分研究 [D]. 北京: 中国协和医科大学, 2008. |
 2014, Vol. 45
2014, Vol. 45


