脓毒症(Sepsis)是由细菌感染所致的全身炎症反应综合征(Systemic Inflammatory Response Syndrome,SIRS),是诱发多脏器功能障碍综合症(Multiple Organ Disfunction Syndrome,MODS)的重要原因。急性肺损伤(acute lung injury,ALI)是各种原因造成弥漫性肺间质及肺泡水肿,而导致的急性低氧性呼吸功能不全。引起ALI的原因多样,其中脓毒症被认为是造成ALI进展的最主要高风险因素[1]。肺组织髓过氧化物酶(myeloperoxidase,MPO)是主要存在于中性粒细胞和单核细胞中的一种代谢酶[2],其水平及活性变化可反映中性粒细胞的功能与活性状态,反应肺组织的损伤程度[3]。丙二醛(malondialdehyde,MDA)作为脂质过氧化标记物,可用于评价机体的应激水平[4],在脓毒症时其水平可显著增加[5],并与脓毒症预后相关[6]。脓毒症ALI一直作为重症医学科中医药治疗的重点研究方向,在长期临床观察的基础上,认为其发病初期以实证为主,温热邪毒侵犯肺及大肠为重要病机,据此提出运用通腑活血、凉营解毒法进行治疗,并创立炎调方。前期临床及动物实验表明,炎调方具有凉血解毒、通腑活血之功效,对脓毒症血清炎症因子的释放具有调控作用[7-9]。本研究制备脓毒症ALI大鼠模型,观察炎调方对脓毒症ALI大鼠肺组织MPO、MDA水平的影响。
1 材料 1.1 动物50只清洁级健康雄性SD大鼠,体质量(200~220)g,由上海中医药大学实验动物中心提供,合格证号SCXK(沪)2008-0016,饲养于清洁级动物房内,温度23 ℃,湿度50%,12 h照明,动物自由进食饮水。
1.2 药物及主要试剂炎调方由桃仁、生大黄、芒硝、玄参、赤芍、当归等药物组成,所有药物均为符合《中国药典》2015年版规定并加工炮制合格的饮片,由上海中医药大学附属上海市中医医院中药房提供。煎煮方法:以10倍体积的蒸馏水浸泡饮片30 min,先用武火煮桃仁、玄参、赤芍、当归,沸腾后改用文火煎煮20 min,再加入大黄继续煎煮10 min后熄火取药液;第二煎加入相当于饮片6倍体积的蒸馏水,用武火煎煮至沸腾后改文火煎煮20 min,熄火取药液,两次药液混合,用四层无菌纱布过滤,最后纳入芒硝并充分溶解,将药液浓缩成含生药1.0 g/mL的棕色透明液体,置4 ℃冰箱保存备用[8]。
注射用地塞米松磷酸钠(马鞍山丰原制药有限公司,批号140612-1,每支5 mg);MPO和MDA检测试剂盒(上海富勒生物科技有限公司)。
1.3 主要仪器DENLEY DRAGON Wellscan MK 2全自动多功能酶标仪(芬兰Thermo公司);TGL-168离心机(上海安亭科学仪器厂);LEICA HI1220烘片机、LEICA RM2035旋转切片机、LEICA ASP300自动脱水机、LEICA EG1160石蜡包埋机(德国徕卡仪器公司)。
2 方法 2.1 脓毒症ALI模型的制备采用盲肠结扎穿孔术(CLP)制备脓毒症ALI大鼠模型[10]:大鼠经10%水合氯醛(0.5 mL/kg)麻醉后,以腹正中作一1.5 cm长的切口,找到盲肠,在其根部结扎,用5 mL注射器针头穿通3次,轻挤出少量肠内容物,留置2 mm皮瓣防止针孔闭合,还纳盲肠于腹腔,逐层缝合腹壁切口,术毕sc生理盐水(30 mL/kg)抗休克[7-8]。假手术组经麻醉后开腹,轻轻翻动肠道后关腹。
2.2 动物分组及给药大鼠按随机数字表分为5组:对照组、假手术组、模型组、炎调方组、地塞米松组,每组10只,适应性饲养1周。炎调方组ig炎调方(生药量为9.9 g/kg,按原方临床剂量换算为动物等效剂量[7-8, 14]),地塞米松组ig地塞米松(0.45 mg/kg),给药体积为10 mL/kg,每天给药1次,连续给药3 d。对照组、假手术组、模型组ig等体积生理盐水。末次ig 2 h后,进行CLP手术,术后24 h取材。
2.3 生物样本的采集与指标检测 2.3.1 生物样本的采集ip 10%水合氯醛麻醉处死大鼠后,沿大鼠左右肋软骨迅速打开胸腔,快速取出左右肺,冰上切取左、右肺组织。
2.3.2 肺湿/干重比(W/D)的测定取左肺测定肺湿/干重比(W/D)。用滤纸吸去组织多余水分后称重(湿重),后置于60 ℃烤箱内干烤72 h,再次称重(干重),计算肺湿/干重比(W/D)。
2.3.3 肺组织HE染色右肺用冰生理盐水冲洗表面,取1/3组织标本,经甲醛固定后,常规石蜡包埋、切片、二甲苯脱蜡,再经各级乙醇至水洗,苏木素、伊红染色后常规脱水,透明,封片。
2.3.4 MPO及MDA水平检测剩余肺组织以生理盐水制备成10%匀浆,按照MPO和MDA检测试剂盒说明书操作,分别在460和532 nm处测吸光度(A)值,根据标准品计算肺组织中MPO和MDA水平。
2.4 统计学处理计量资料以x±s表示,应用SPSS 18.0统计软件,组间均数比较采用单因素方差分析。
3 结果 3.1 一般情况观察对照组和假手术组大鼠形态、饮食、呼吸、活动量无明显异常,大便正常;模型组大鼠术后精神萎软,体毛竖立、凌乱,活动少,呈蜷缩状,眼鼻处分泌物多,不欲饮食,呼吸频率增快,腹部膨隆,无大便;炎调方与地塞米松组大鼠术后精神状况、活动量及眼鼻分泌物好于模型组。
3.2 肺组织损伤情况 3.2.1 肺组织病理染色对照组及假手术组肺组织形态、结构正常,肺泡量多,其腔内清晰,肺泡间隔无明显水肿、炎症等病理改变;模型组可见肺间质水肿明显,炎症细胞大量浸润,肺泡明显减少,肺组织实变明显;炎调方及地塞米松组与模型组比较,损伤范围较小,肺泡量较多,肺间质水肿及炎性细胞浸润减轻,肺实变减轻。结果见图 1。
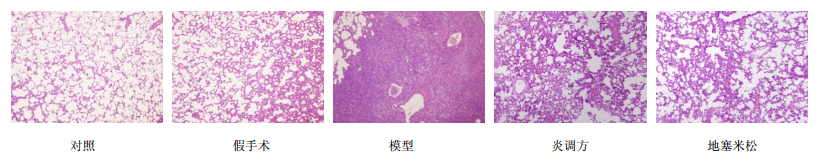
|
图 1 各组大鼠肺组织HE染色 Fig. 1 HE staining of lung tissue of rats in each group |
3.2.2 肺组织W/D值的测定
模型组肺组织W/D值较对照组及假手术组明显升高,差异显著(P<0.01);炎调方组及地塞米松组肺组织W/D值较模型组明显降低(P<0.01);地塞米松组肺组织W/D值较炎调方组降低(P<0.05)。结果见表 1。
| 表 1 各组大鼠肺组织W/D值比较(x±s, n = 10) Table 1 Comparsion of W/D value in lung tissue of rats in each group(x±s,n = 10) |
3.3 肺组织中MDA、MPO水平测定
模型组MPO水平明显高于对照组及假手术组(P<0.01);炎调方及地塞米松组MDA、MPO水平较模型组均有不同程度的下降(P<0.05),而炎调方与地塞米松组MDA、MPO水平差异不显著。结果见表 2。
| 表 2 各组大鼠肺组织MDA和MPO水平比较(x±s±s, n = 10) Table 2 Comparison of MDA and MPO levels in lung tissue of rats in each group(x±s±s, n = 10) |
4 讨论
研究表明,氧化应激在ALI的发生发展过程中起着重要的作用。MPO是一种亚铁血红素酶,其为髓细胞的特异性标志,主要存在于中性粒细胞中,可催化氯离子生成次氯酸和具有氧化能力的自由基,从而启动脂质过氧化反应[11]。MDA是自由基与生物膜多聚不饱和脂肪酸发生脂质过氧化的产物,可反应组织的过氧化程度[12]。当机体处于炎症及氧化应激状态时,体内产生的氧化物超过机体的抗氧化能力,即会产生组织损伤。
脓毒症ALI发生率及病死率高,对人类健康造成重大威胁。近年来随着抗生素的不断面世及治疗方法日趋多样化,仍未能明显改善其预后。既往脓毒症的研究多集中在炎症反应方面,近年来,氧化应激在脓毒症发展过程中所起的作用越来越受到人们的重视。脓毒症在中医学理论体系中并无相应的病名,根据症状体征和疾病演变过程,脓毒症当属中医学“温病”“热病”范畴。脓毒症ALI则属于中医“喘证”、“暴喘”、“喘脱”范畴。诸多临床研究证明中药联合西医治疗脓毒症ALI比单纯西医治疗效果显著,且已有研究表明中药可改善机体氧化应激状态,减轻机体损伤的严重程度[13]。
炎调方由大黄、芒硝、桃仁、赤芍、玄参、当归等组成,方中大黄、芒硝、桃仁清热、通腑、活血为君药;赤芍、玄参清营、凉血、滋阴,为臣药;当归活血补血为佐药。全方配伍共奏通腑清营活血之功。本研究显示,炎调方能减轻脓毒症肺组织病理变化,降低肺组织W/D,降低脓毒症大鼠肺组织中MPO及MDA水平,减轻脓毒症ALI大鼠的炎症及氧化应激反应,与地塞米松作用相似。由此揭示炎调方除了前期研究证实的可通过减少炎症因子的释放,减轻组织损伤以外[14],其减轻氧化应激反应可能也作为另一个途径改善脓毒症肺组织损伤,其作用机制可作进一步深入研究。
| [1] | Bersten A D, Edibam C, Hunt T, et al. Incidence and mortality of acute lung injury and the acute respiratory distress syndrome in three Australian states[J]. Am J Respir Crit Care Med, 2002, 165 (4) :443–448. |
| [2] | Gu J D, Hua F, Mei C R, et al. HapMap-based study on the association between MPO and GSTP1 gene polymorphisms and lung cancer susceptibility in Chinese Han population[J]. Acta phamacol Sin, 2014, 35 (5) :636–644. |
| [3] | 张丹, 胡质毅, 黄萍, 等. 安宫牛黄丸对脓毒症大鼠肺组织高迁移率族蛋白B1基因表达及髓过氧化物活性的影响[J]. 广州中医药大学学报,2010,27 (1) :27–30. |
| [4] | 樊涛, 张宇, 蒋洪丽, 等. 慢性阻塞性肺疾病患者肺组织丙二醛、白细胞介素8、肿瘤坏死因子α水平及吸烟的影响[J]. 中国呼吸与危重监护杂志,2012,11 (3) :218–222. |
| [5] | Welss S L, Deutschman C S. Elevated malondialdehyde levels in sepsis-something to ‘stress’ about[J]. Crit Care, 2014, 18 (2) :125. |
| [6] | 罗成, 沈娜. 黄芪多糖对CLP诱导的脓毒症小鼠急性肝损伤MDA、caspase-3和ICAM-1的影响研究[J]. 重庆医科大学学报,2014,39 (11) :1641–1646. |
| [7] | 沈晓红, 何淼, 熊旭东, 等. 炎调方对脓毒症大鼠肺热休克蛋白70和核因子-κB的调控作用[J]. 上海中医药大学学报,2013,27 (3) :69–72. |
| [8] | 施荣, 熊旭东, 李淑芳, 等. 炎调方对脓毒症大鼠血清炎症因子的调控作用[J]. 中国中医急症,2012,21 (3) :397–398. |
| [9] | 何淼, 熊旭东, 沈晓红, 等. 炎调方对脓毒症急性呼吸窘迫综合征(热炽营血证)患者血细胞因子的影响[J]. 中国中医急症,2013,22 (7) :1097–1099. |
| [10] | Chaudry I H, Wichterman K A, Baue A E. Effect of sepsis on tissue adenine nucleotide levelas[J]. Surgery, 1979, 85 (2) :205–211. |
| [11] | 张婷, 单可人. 髓过氧化物酶多态性与疾病氧化应激的研究进展[J]. 山东医药,2009,49 (33) :108–109. |
| [12] | 杨翠萍, 杨晓金, 田真真. 槐定碱对ALI小鼠肺组织SOD, MDA及TLR4表达的影响[J]. 中国实验方剂学杂志,2012,18 (14) :180–183. |
| [13] | 郭璠. 丹红注射剂对急性冠脉综合征患者的血浆NO, MPO及MDA浓度的影响[J]. 心血管康复医学杂志,2014,23 (1) :89–91. |
| [14] | 沈晓红, 熊旭东, 彭文波. 加味炎调方对脓毒症大鼠血清TNF-α、IL-1β、IL-10的调控作用[J]. 辽宁中医杂志,2013,40 (6) :1241–1243. |
 2016, Vol. 39
2016, Vol. 39


