2. 天津大学 药物科学与技术学院, 天津 300072
2. School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China
附子、白及反药组合是中药“十八反”中“半蒌贝蔹及攻乌”的药对之一,历来被视为中药配伍用药禁忌。人们对中药配伍禁忌的临床表现形式、成因、影响因素等做了大量研究,在此基础上笔者提出病症条件是中药配伍禁忌的关键影响因素[1]。根据附子、白及传统功效和临床应用,附子和白及可能在胃溃疡的治疗过程中联合应用。在该病症条件下附子、白及反药组合可能取得较好的疗效。吴凤海等[2]对于证见喜温喜按、虚寒胃脘痛,并由西医诊断为溃疡病之患者,采用加味黄芪建中汤(含反药黑附子、白及)治疗,取得良好效果。徐及敏等[3]研究发现附子可通过兴奋迷走神经而起到强心作用,加强血液循环;白及常用于消化道止血,对胃黏膜具有保护作用。使用此对反药组合并没有不良反应,且有协调作用,将制附子、白及用于消化道溃疡的治疗有良好效果。然而在某些特定病症条件下可能出现了严重不良反应。
胃溃疡发病机制一方面由于中枢神经系统和自主神经系统功能紊乱,导致胃肠运动、分泌功能失调产生继发性黏膜血管运动障碍,导致溃疡形成[4]。另一方面由于胃黏膜血管被化学物质灼伤后,浆膜血管受损,造成相应部位的缺血,明显降低局部黏膜上皮细胞抵抗力,从而被胃蛋白酶消化损伤,形成溃疡。针对胃溃疡的不同病症条件,附子白及反药组合可能存在不同甚至相反效应。研究报道β2受体激动会导致伤口愈合延迟,并加重炎症反应[5-6]。在胃溃疡的治疗过程中,附子、白及反药组合能否通过协同激动β2产生影响胃溃疡,目前尚无明确报道。本实验选用乙酸诱导胃溃疡模型,通过考察附子、白及反药组合对大鼠溃疡创面愈合,白介素6、髓过氧化物酶等的影响,探讨了附子、白及反药组合“相反”的主要表现,并基于β2肾上腺素能受体协同激动作用考察了其可能机制。
1 材料 1.1 动物和细胞SPF级Wistar大鼠,健康适龄,体质量(230±10)g,雄性,购于中国人民解放军军事医学科学院卫生学环境医学研究所实验动物中心,使用合格证号SCXK(军)2014-0001。β2 AR-HEK293细胞系为稳定表达人β2肾上腺素能受体的HEK293细胞株,由南开大学白钢教授实验室赠送。
1.2 药物附子采用黑顺片,购于四川省江油市,白及购于贵州省遵义市,均经本校中药鉴定教研室鉴定,符合饮片标准。沙丁胺醇片(山东仁和堂药业有限公司生产,规格2 mg/片,批号131102);普萘洛尔片(山西省临汾健民制药厂生产,规格10 mg/片,批号141102)。
1.3 仪器和试剂Multiskan Ascent酶标仪(Thermo Lab Systems公司);YXJ-Ⅱ型高速离心机(常州金城教学仪器厂)。冰乙酸(天津市化学试剂供销公司);白细胞介素6(IL-6)、髓过氧化物酶(MPO)、环磷酸腺苷(cAMP)Elisa试剂盒(上海宝曼生物科技有限公司);异丙肾上腺素(中国食品药品检定研究院,批号100166-200503);FBS(以色列Biological industries);青霉素-链霉素(P/S)、DMEM高糖培养基(HyClone);Zeocin选择性抗生素、PEI(美国Invitrogen公司);Dual-GloTM reporter assay system、PGL4.29(荧光素酶质粒)、Renilla(内参质粒,美国Promega公司)。
2 实验方法 2.1 药物的制备附子、白及反药组合以附子、白及质量比1:1比例组合。附子、白及和反药组合均第1次先以10倍量蒸馏水浸泡1 h,微沸后煎煮1 h;第2次用8倍量蒸馏水微沸后煎煮1 h;合并2次滤液,减压浓缩至浸膏,使质量浓度为含生药1 g/mL,于4 ℃冰箱保存备用。临用前用无菌蒸馏水配制。
2.2 动物分组和给药大鼠随机分为对照组、模型组、沙丁胺醇组、普萘洛尔组、白及组、附子组和反药组合组,每组各16只。对照组、模型组均ig蒸馏水5 g/kg,沙丁胺醇组ig沙丁胺醇片0.8 mg/kg,普萘洛尔组ig普萘洛尔片18 mg/kg,白及组ig白及提取物以生药计5 g/kg,附子组ig附子提取物以生药计5 g/kg,反药组合组ig白及、附子提取物以生药计各5 g/kg。造模前3 d开始给药,1次/d,第3天给药后禁食不禁水24 h,第4天造模(造模当天不给药),从第5天起以10%葡萄糖溶液喂养,同时继续给药5 d。
沙丁胺醇、普萘洛尔的剂量为临床最大剂量的等效剂量,附子剂量为临床最大剂量等效剂量的3倍(预实验所得),白及剂量取齐附子。
2.3 造模依据Okabe等[7]的方法并改进。实验前大鼠禁食不禁水24 h,用10%水合氯醛(3 mL/kg)ip麻醉。仰卧位固定于鼠板,腹部备皮(约5 cm×4 cm)。铺手术洞巾,碘伏消毒。在胸骨剑突下0.5 cm沿腹中线纵向切开腹壁约1.5 cm,打开腹腔,将胃暴露于切口,轻移出腹腔。用直径为5 mm圆滤纸片浸30 μL冰乙酸,在胃前壁浆膜面、胃窦胃体交界近幽门处,同一部分(避开血管)贴敷30 s×2次(取下再重复1次);用适量生理盐水擦洗。以上操作完毕,将胃轻轻送回腹腔,覆盖网膜,缝合腹膜、腹壁各层组织。切口外碘伏消毒。大鼠ip庆大霉素1 mL/kg,连续3 d。
2.4 胃溃疡面积计算大鼠末次给药1 h后,用10%水合氯醛(3 mL/kg)ip麻醉。沿剑突下打开腹腔,结扎幽门部,ig 4%中性福尔马林溶液8 mL,结扎贲门部,游离胃,固定30 min后沿胃大弯剪开,生理盐水冲去内容物,展平,观察溃疡灶个数。分别用游标卡尺测量溃疡的长径(d1)和宽径(d2),计算溃疡面积。
溃疡面积s=π×d1×d2/4(π为圆周率,取3.14)
2.5 组织病理学检查部分胃组织于4%中性福尔马林固定48 h,石蜡切片,HE染色,考察药物对胃组织病理学变化。
2.6 炎症相关指标检测末次给药后1 h,大鼠用10%水合氯醛(3 mL/kg)ip麻醉,沿剑突下打开腹腔。腹主动脉取血,4 ℃、3 000×g离心15 min,取上清留存。剥离胃体,用生理盐水冲洗胃内容物,展平。胃壁组织剪碎,加5倍生理盐水,在冰浴中匀浆至组织充分裂解,4 ℃、2 000×g离心15 min,得上清液,利用Elisa试剂盒检测胃组织匀浆炎症相关指标MPO、IL-6、cAMP水平。
2.7 体外协同激动β2肾上腺素能受体 2.7.1 细胞系培养和处理细胞用含10% FBS、100 μg/mLZeocin选择性抗生素、100 U/mL青霉素-链霉素的DMEM高糖培养基,种于75 cm2细胞培养瓶中,在5% CO2-95%空气、37 ℃细胞培养箱中培养。培养瓶中细胞生长至90%,消化传代种于96孔板中(200 μL/孔),待细胞融合至30%~40%,转染质粒。
2.7.2 A/B混合转染试剂的配制A液为无血清培养基+PEI(转染试剂),体积比100:8;B液为无血清培养基+PGL4.29(荧光素酶质粒)+Renilla(内参质粒),体积比100:1.25:0.5。A/B液静置5~10 min后按照1:1混合,再静置15~20 min,按照20 μL/孔将A/B混合转染试剂加入96孔板中,过夜培养。
2.7.3 附子对β2肾上腺素能受体的激动作用以1 μmol/L异丙肾上腺素为对照,对20、60、180、500、1 000、3 000 μg/mL附子提取物进行活性评价,然后选取中间活性剂量进行配伍活性评价。将附子提取物以DMEM培养基按需要等比稀释,吸弃细胞培养液,以配好的提取物溶液换液。加药完毕,将培养板置于37 ℃、5% CO2培养箱继续培养5 h后,采用双荧光素酶报告基因法检测活性,计算前后两荧光值的比值即β2肾上腺素能受体活性。
2.7.4 附子、白及联合使用对β2肾上腺素能受体协同激动作用同2.7.3中方法,将附子、白及提取物加药培养后,弃去药液,PBS清洗2次,每孔加入细胞裂解液20 μL,振荡30 min至细胞裂解。每孔吸出15 μL细胞裂解液,加入20 μL Dual-Glo Luciferase反应液,混匀后于化学发光检测仪上双荧光素酶报告基因法检测活性,记录荧光数值。再加入20 μL Dual-Glo Stop & Glo试剂,混匀后检测,记录荧光数值。计算前后两荧光值的比值即β2肾上腺素能受体活性。
2.8 统计学处理实验数据利用统计软件SPSS 16.0进行统计分析,计量资料用x±s表示,采用两个独立样本t检验,计数资料采用χ2检验。
3 结果 3.1 反药组合对乙酸诱导大鼠胃溃疡的溃疡面积影响与模型组比较,附子组、反药组合组溃疡严重、自愈不佳,差异有统计学意义(P < 0.05);白及组溃疡较轻,愈合明显,差异有极显著意义(P < 0.01)。与白及组比较,反药组合组溃疡严重,差异有极显著意义(P < 0.01),但反药组合组与附子组比较,无显著差异。结果提示附子、白及联合使用会加重大鼠胃溃疡,见表 1。
| 表 1 附子、白及反药组合对乙酸诱导大鼠胃溃疡的溃疡面积影响(x±s, n=10) Table 1 Effect of Aconiti Lateralis Radix Preparata and Bletillae Rizoma anti drug combination on area of gastric ulcer of acetic acid induced gastric ulcer in rats (x±s, n=10) |
3.2 组织病理学检查
对照组:黏膜层光滑完整、厚薄均匀,组织结构层次清楚,腺细胞排列均匀,黏膜下层、肌层、浆膜层完好。模型组:黏膜缺损,部分腺体被破坏;固有层、黏膜下层内毛细血管血流瘀滞,部分毛细血管破裂出血及渗出;黏膜下层及浆膜层有明显炎性细胞浸润。沙丁胺醇组:黏膜缺损大,腺体完全被破坏,浅层胃底腺破裂,腺腔内较多脱落的上皮细胞碎片;黏膜下层毛细血管内除有血流瘀滞,部分毛细血管破裂、出血,黏膜下层、浆膜层有大量炎性细胞浸润。部分溃疡深及肌层,可见平滑肌细胞排列紊乱或出现断裂。普萘洛尔组:缺损较小,表面见新生上皮细胞及腺细胞,排列致密不整齐;黏膜下层有炎细胞浸润,肌层有瘢痕纤维形成,溃疡边缘可见再生的黏膜。附子组:黏膜缺损较大,大多数腺体破坏,黏膜下层有炎性细胞浸润,毛细血管可见血栓。白及组:黏膜基本完整,上皮细胞形态、分布良好,腺体细胞增生数量较多,排列较整齐;黏膜下层仅见少量炎性细胞浸润,浆膜层较完整。溃疡边缘可见再生的黏膜和囊样扩张的腺体,向溃疡部位迁移,在溃疡创面有肉芽组织形成,含有增生的毛细血管。反药组合组:黏膜缺损大,腺体破坏严重,浅层胃底腺破裂,腺腔内可见脱落的上皮细胞碎片;黏膜下层有大量的炎性细胞浸润,毛细血管可见明显血栓存在。溃疡可深及肌层,平滑肌细胞排列紊乱。见图 1。
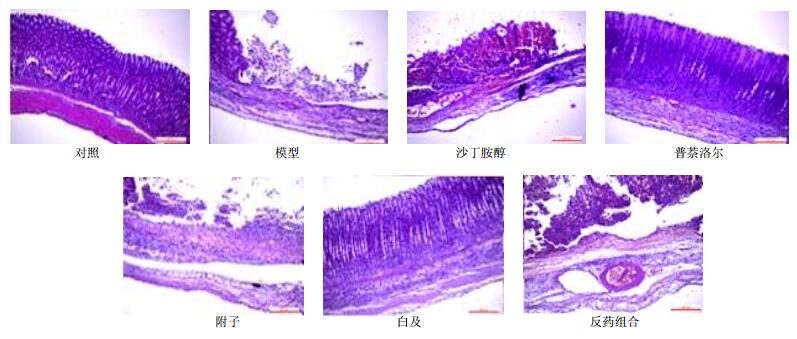
|
图 1 组织病理学检查 Fig. 1 Histopathological examination |
3.3 反药组合对乙酸诱导大鼠胃溃疡的炎症相关指标影响
与模型组比较,反药组合组IL-6、MPO、cAMP水平显著升高(P < 0.05、0.01),附子组MPO水平显著升高(P < 0.01);与白及组比较,反药组合组IL-6、MPO、cAMP水平显著升高(P < 0.05、0.01)。结果提示附子、白及联用加重炎症反应,升高cAMP,可能与激动β2肾上腺素能受体有关,见表 2。
| 表 2 附子白及反药组合反药组合对乙酸诱导大鼠胃溃疡溃生化指标的影响(x±s, n=6) Table 2 Effect of Aconiti Lateralis Radix Preparata and Bletillae Rizoma anti drug combination on biochemical criterion of acetic acid induced gastric ulcer in rats (x±s, n=6) |
3.4 附子对β2肾上腺素能受体的激动作用
与对照组比较,异丙肾上腺素对β2肾上腺素能受体激动作用非常明显(P < 0.01);附子各剂量组均有一定程度β2肾上腺素能受体激动作用(P < 0.01),在20~1 000 μg/mL呈现良好的量效关系,见表 3。实验选取500 μg/mL为中间活性剂量,作为配伍选择剂量。
| 表 3 附子对β2肾上腺素能受体的激动作用(x±s, n=6) Table 3 Activating effects of Aconiti Lateralis Radix on β2 AR (x±s, n=6) |
3.5 附子、白及联合使用对β2肾上腺素能受体协同激动作用
与对照组比较,附子组具有良好的β2肾上腺素能受体激动作用(P < 0.01),白及组无明显β2肾上腺素能受体激动作用;与附子组比较,反药组合β2肾上腺素能受体激动作用显著增强(P < 0.01),见表 4。结果提示,附子、白及反药组合具有明显的协同激动β2肾上腺素能受体的作用。
| 表 4 附子、白及协同激动β2肾上腺素能受体(x±s, n=6) Table 4 Activating effect on β2 AR of Aconiti Lateralis Radix Preparata and Bletillae Rizoma(x±s, n=6) |
4 讨论
实验发现,附子具有一定β2肾上腺素能受体激动作用,当其与白及反药联合使用时,对β2肾上腺素能受体的激动作用增加,同时可加重大鼠胃溃疡和创面炎症反应。由于β2肾上腺素能受体激动作用,改变中性白细胞向创伤面转运的动力学,而IL-6是介导这一过程、并作为其结果的关键性促炎细胞因子。这一过程中,促炎巨噬细胞激活,IL-6合成释放增多,通过增加中性白细胞数量、延长中性白细胞寿命而使炎症恶化,最终不利于伤口再上皮化[5]。MPO由中性粒细胞、单核细胞和部分组织的巨噬细胞分泌[6],是中性粒细胞的功能标志和激活标志,其水平及活性变化代表着PMN的功能和活性状态[7],可作为中性粒细胞的特异性标记。炎症发生后,PMN被激活,通过脱颗粒作用释放MPO到胞外或吞噬小体内,在炎症部位催化过氧化氢生成一系列具有广泛生物学效应的活性氧分子[8]。由此推测附子、白及反药组合加重胃溃疡的作用机制可能是通过协同激动β2肾上腺素能受体,进而加重创面炎症反应而实现的。
结果显示,附子、白及联合使用后有加重大鼠胃溃疡和炎症反应的作用。β受体信号转导机制中的经典通路即蛋白激酶A(PKA)通路:当其与Gs蛋白结合,激活腺苷酸环化酶(AC),使三磷酸腺苷(ATP)转化为cAMP,导致细胞内cAMP水平升高。体外和体内实验早已发现,β受体兴奋后通过Gs-AC-cAMP信号通道影响IL-6的分泌,持续β受体兴奋,增加IL-6的表达[9]。
β2肾上腺素能受体激动作用有加重溃疡的影响。本实验以乙酸滤纸片贴敷法复制大鼠胃溃疡模型,用药干预,观察到附子、白及反药组合可加重溃疡和创面炎症反应,故不宜同时使用。同时采用双荧光素酶报告基因技术证实附子、白及反药组合对β2肾上腺素能受体有明显激动作用。
| [1] |
庄朋伟, 卢志强, 孙凤姣, 等.
基于病症条件的中药配伍禁忌毒效表征研究思路与方法[J]. 中草药 , 2016, 47 (5) : 701–706.
( 0) 0)
|
| [2] |
吴凤海, 李建萍.
白及附子相反相成[J]. 蒙古中医药 , 1990 (3) : 3.
( 0) 0)
|
| [3] |
徐及敏, 李紫霞, 任玉文.
浅析中药十八反现代研究及临床应用[J]. 当代医学 , 2009, 15 (16) : 148.
( 0) 0)
|
| [4] |
裴仁九, 江川, 陈国成, 等.
硫糖铝和盐酸雷尼替丁合用对四种大鼠胃溃疡模型的影响[J]. 解放军药学学报 , 2000, 16 (5) : 239–242.
( 0) 0)
|
| [5] |
Kim M H, Gorouhi F, Ramirez S, et al.
Catecholamine stress alters neutrophil trafficking and impairs wound healing by β2-adrenergic receptor-mediated upregulation of IL-6[J]. J Invest Dematol , 2014, 134 (3) : 809–817.
DOI:10.1038/jid.2013.415 ( 0) 0)
|
| [6] |
Amimian A, Boudjeltia K Z, Babar S, et al.
Coronary stenting is associated with an aute myocardial in plasma myeloperoxidase in stable angina patients but not in patients with acute myoeardial infarction[J]. Eur J Intern Med , 2009, 20 (5) : 527–532.
DOI:10.1016/j.ejim.2009.05.008 ( 0) 0)
|
| [7] |
Okabe S, Roth J L, Pfeiffer C J.
A method for experimental, penetrating gastric and duodenal ulcers in rats. Observations on normal healing[J]. Am J Dig Dis , 1971, 16 (3) : 277–284.
DOI:10.1007/BF02235252 ( 0) 0)
|
| [8] |
Mori T, Town T, Tan J, et al.
Modulation of astrocytic activation by arundic acid (ONO-2506) mitigates detrimental effeets of the apolipoprotein E4 isoform after permanent focal isehemia in apolipoprotein E knoekinmice[J]. J Cereb Blood Flow Metab , 2005, 25 (6) : 748–762.
DOI:10.1038/sj.jcbfm.9600063 ( 0) 0)
|
| [9] |
Wikto-Sarsat V, Rieu P, Descamps-Latscha B, et al.
Neutrophils:molecules, functions and pathophysiological aspects[J]. Lab Invest , 2000, 80 (50) : 617–653.
( 0) 0)
|
| [10] |
汪熠, 李浪.
β-肾上腺素能受体信号通路介导的炎症因子在心肌损伤中的作用[J]. 国际心血管病杂志 , 2008, 35 (2) : 69–72.
( 0) 0)
|
 2016, Vol. 31
2016, Vol. 31


