2. 山东中医药大学附属医院, 山东 济南 250012
2. Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250012, China
党参为桔梗科植物党参Cdonopisis pilosula (Farnch.) Nannf.、素花党参Codonopsis pilousla Nannf. var. modesta (Nannf.) L. T. Shen或川党参Codonopsis tangshen Oliv.的干燥根,是我国常用的补益药材,具有补中益气、健脾益肺的功效[1]。研究表明,党参含有多糖类、植物甾醇类、萜类、生物碱类、苯丙素苷类等多种化学成分,其中多糖类所占比例最大[2-3]。目前,党参多糖(Codonopsis pilosula polysaccharide,CPP)的生物活性研究大多局限于其对免疫系统功能的调节方面,这在某种程度上阻碍了药材党参的相关新药资源开发,致使药材党参的附加值不高,制约了党参种植及相关产业的发展[4-5]。本课题组曾对CPP提取纯化工艺进行优化,并对其单糖组成和相对分子质量(MW)分布进行了研究[6],本研究采用热回流浸提方法对党参中的多糖成分进行提取,并采用单因素和响应面法对其工艺进行优化。在此基础上采用中空纤维超滤[7]实验装置对提取的党参粗糖多进行分级,并考察不同MW CPP中的单糖组成及体内外抗氧化活性,为进一步探索CPP的构效关系及作用机制奠定基础。
1 仪器与材料 1.1 试药与试剂党参,采购于山西潞城,经山东省中医药大学附属医院张学顺教授鉴定为桔梗科植物党参Cdoonopisis pilosula (Farnch.) Nannf.的干燥根;血清白蛋白,北京恒业中远化工有限公司;葡聚糖,截留MW 500 000,上海谷研科技有限公司;考马斯亮蓝,上海迈坤化工有限公司;维生素C(VC)、D-半乳糖均购自Sigma公司;实验测定试剂盒均购自碧云天生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;Tensor Ⅱ傅里叶变换红外光谱仪,德国Bruker公司;中空纤维超滤装置,北京旭邦膜设备有限责任公司;LGJ-10冷冻干燥机,北京四环科学仪器四厂;ML503电子天平,Mettler Toledo仪器(上海)有限公司;德国Heidolph旋转蒸发器,艾拓思实验设备(上海)有限公司;Milli QA纯水处理器,Millipore公司。Bradford蛋白浓度测定试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒均购自碧云天生物技术有限公司。
1.3 实验动物1月龄清洁型雌性ICR小鼠,共60只,体质量(20±2)g,购于山东省实验动物中心,许可证号SCXK(鲁)20140007。饲养环境安静,室温25 ℃,各组小鼠自由进食、饮水。
2 方法 2.1 党参粗多糖的制备取60 ℃干燥后粉碎的党参药材,加入3倍体积的石油醚(30~60 ℃),加热回流2次,每次2 h,弃去提取液,滤渣挥干溶剂。取500 g脱脂处理的党参药材粉末,以水为提取溶剂,在提取温度为85 ℃,料液比为1:12,提取时间为1.5 h的情况下回流提取2次,合并提取液,经5 000 r/min离心10 min,60 ℃减压浓缩至2 000 mL,加入4倍体积的无水乙醇过夜,沉淀多糖,干燥至恒定质量即得粗多糖样品[8]。
2.2 CPP的分离与精制 2.2.1 CPP的精制与分离操作流程及考察指标将党参粗多糖加水溶解,置分液漏斗中,采用Sevage法沉淀蛋白。将去除蛋白的多糖溶液加于DEAE-纤维素柱,经1 mol/L NaCl溶液洗脱,洗脱液浓缩后灌入透析袋中,循环透析24 h,除去残留NaCl及其他的小分子物质[9-11]。
将透析后的多糖旋蒸浓缩,选用合适的超滤膜,在适当的压力和膜通量下,以一定的体积流量进行超滤,工作流程图见图 1。
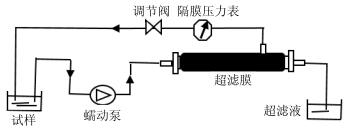
|
图 1 超滤装置工作流程图 Fig.1 Ultrafiltration device flowcharts |
采用恒流泵提供动力和控制体积流量,调节调压阀控制压力,将试样放入恒温水浴中,透过液采用量筒收集,计算膜通量和截留率。
膜通量=V/(St)
截留率=V2C2/(V1C1)
V为超滤时间内透过的超滤液的体积(mL),t为超滤时间(min),S为有效膜面积(cm2),V2和C2分别是截留后超滤液的体积和质量浓度,V1和C1分别是储存液的体积和质量浓度
2.2.2 超滤膜的选择不同规格的超滤膜对截留率和膜通量的影响,截留MW越大,截留率越低,膜通量越大,MW 30 000与MW 10 000相比截留率相差不明显,而膜通量显著增加;MW 5 000与MW 3 000相比截留率相差不明显,而MW 5 000的膜通量显著增加,因此,选择MW 300 000的超滤膜进行初滤,MW 30 000和MW 5 000分别对多糖进行截留,结果见表 1。
|
|
表 1 不同规格的超滤膜对截留率和膜通量的影响 Table 1 Effects of different sizes of ultrafiltration membrane on rejection rate and membrane flux |
2.2.3 超滤压力的选择
适当增加超滤压力,膜通量在一定范围内可以提高,但随着超滤压力的增大,膜表面的质量浓度也会增加,因此导致截留率会相应的降低,由表 2可以看出,当超滤压力为0.2 MPa时,膜通量相对较大,而截留率也不至于太低,因此选择超滤压力为0.2 MPa较合适。
|
|
表 2 超滤压力对截留率和膜通量的影响 Table 2 Effect of ultrafiltration pressure on retention rate and membrane flux |
2.2.4 超滤温度的选择
多糖的生物活性会随着温度的升高而改变,因此一般情况下超滤的温度不宜超过50 ℃。因此,本实验考察温度为25、35、45 ℃时,对截留率和膜通量的影响,结果见表 3。结果显示,膜通量会随着温度的升高而增加,但是随着温度的升高,溶液的黏度也会增加,相应的膜的截留率也会下降,因此在保证有一定的膜通量的情况下,选择25 ℃作为超滤温度,以便于操作。
|
|
表 3 超滤温度对截留率和膜通量的影响 Table 3 Effect of ultrafiltration temperature on retention rate and membrane flux |
2.2.5 超滤法分离CPP的流程
将预处理的CPP粗提液采用中空纤维超滤实验装置,设定超滤压力为0.20 MPa,超滤温度为25 ℃,超滤膜选用CLN-300KD(MW 300 000)、CLN-30KD(MW 30 000)、CLN-5KD(MW 5 000)3种滤膜,其中CLN-300KD的超滤膜起初滤的作用,CLN-30KD和CLN-5KD分别截留30 000以上,30 000~5 000和5 000以下MW的多糖共3个组分,即CPP1、CPP2、CPP3,具体流程见图 2。

|
图 2 超滤法分离流程图 Fig.2 Separation flow chart by ultrafiltration |
2.3 红外光谱分析
取党参多糖各级冻干粉3.0 mg与KBr混合研磨均匀后压片,使用红外光谱扫描仪在4 000~400 cm-1内进行扫描,记录扫描图谱。由图 3可知,党参多糖组分在3 418 cm-1处有一吸收强度较大的峰,是多糖特征的O-H的伸缩振动峰,由糖分子内或分子间氢键O-H伸缩振动引起的吸收;2 930 cm-1附近的吸收峰为次甲基(-CH2)中-C-H的伸缩振动的吸收峰;1 633 cm-1附近的吸收峰为C=O伸缩振动峰;1 056 cm-1附近的吸收峰,此为醇羟基的变角振动;923 cm-1的吸收,此吸收为吡喃糖环醚键(-C-O-C-)的非对称伸缩振动,为甘露糖的特征吸收。由红外图谱可知CPP1、CPP2、CPP3具有明显的糖类化合物的特征。

|
图 3 党参多糖红外光谱图 Fig.3 Infrared spectrogram of CPP |
2.4 体外抗氧化活性研究[12-14] 2.4.1 CPP对DPPH自由基清除能力的测定
取1.0 mg/mL的多糖溶液2.0 mL,加入2.0 mL现配的0.2 mmol/L DPPH-乙醇溶液,混匀后静置30 min,以50%的乙醇作参比,在517 nm测定样品的吸光度(A)值。以2.0 mL蒸馏水代替多糖溶液,其余操作同上作为空白,VC作阳性对照。样品对DPPH的清除率即为自由基清除率。
DPPH自由基清除率=(ADPPH-A样品)/ADPPH
CPP1、CPP2、CPP3对DPPH的清除作用结果如表 4所示。由表 4可知,VC对DPPH的清除作用强于CPP。CPP各级分随着质量浓度增加清除率增大,CPP3清除作用强于CPP1和CPP2。
|
|
表 4 CPP对DPPH自由基的清除能力 Table 4 DPPH free radical scavenging ability of CPP |
2.4.2 CPP对羟自由基清除能力测定
取10 mL的试管,每支加入2 mL的FeSO4溶液(6 mmol/L)以及2 mL不同浓度的多糖溶液,然后加入2 mL的H2O2(6 mmol/L)溶液,摇匀后静置10 min,再加入2 mL的水杨酸(6 mmol/L)溶液,摇匀后静置30 min,测定其在510 nm处A值,以蒸馏水按同样方法做空白,以VC作阳性对照。每个样品重复试验3次,取其平均值,计算羟自由基的清除率。
清除率=A0-(Ai-Aj)/A0
A0为不加样品溶液的A值,Ai为加入样品溶液反应后的A值,Aj为不加水杨酸时溶液的A值
各级多糖对羟自由基的清除作用结果如表 5所示。由表 5可知,当VC质量浓度达0.5 mg/mL时其对羟基自由基清除率达95.33%。在一定的范围内多糖清除羟自由基的能力随着浓度的增大而增强,相同浓度下,CPP3清除作用强于CPP1和CPP2。
|
|
表 5 CPP对羟自由基的清除能力 Table 5 Hydroxyl rdical scavenging ability of CPP |
2.4.3 CPP对超氧阴离子自由基清除能力测定
取6.0 mL 50 mmol/L、pH 8.12 Tris-HCl缓冲液,分别加入不同质量浓度多糖溶液0.5 mL,混匀后37 ℃水浴保温10 min,加入37 ℃预热过的7 mmol/L邻苯三酚盐酸溶液1 mL,混匀,测定其在325 nm处的A值。依照以上方法,用蒸馏水代替样品,所测得A0为邻苯三酚的吸光度,以VC作为阳性对照,每个样品重复3次,取其平均值,计算清除率。
清除率=(A0-A)/A0
A0为空白邻苯三酚的吸光度,A为加入样品溶液后邻苯三酚的吸光度
CPP1、CPP2、CPP3对超氧阴离子的清除作用结果如表 6所示。由表 6可知,党参多糖对超氧阴离子的清除作用弱于阳性对照VC,当样品质量浓度为5 mg/mL时VC的清除率达99.01%,CPP1为71.02%,CPP2为75.52%,CPP3为90.33%。在质量浓度为0.125~5.0 mg/mL时,CPP3清除作用强于CPP1和CPP2。
|
|
表 6 CPP对超氧阴离子的清除能力 Table 6 Superoxide anion scavenging capacity of CPP |
2.5 CPP3对D-半乳糖所致衰老小鼠模型的保护作用[14-17] 2.5.1 溶液的配制
D-半乳糖溶液的配制:取D-半乳糖适量,溶于生理盐水中配制成4 mg/mL的溶液,储存于4 ℃冰箱中备用。CPP溶液的配制:称取一定量的党参多糖CPP3,溶于生理盐水中配制成20 mg/mL的溶液,储存于4 ℃冰箱中备用。
2.5.2 实验动物分组将健康清洁级ICR雌性小鼠,经1周环境适应性饲养,随机分为6组:对照组,模型组,VE阳性对照组,党参多糖CPP3低、中、高剂量组。每组10只,分笼饲养。
2.5.3 给药除对照组每天颈背部sc生理盐水外,其他5组均按80 mg/(kg∙d) 的剂量颈背部sc D-半乳糖。与此同时,党参多糖CPP3低、中、高剂量组分别以100、200、400 mg/(kg∙d) ig给药,VE阳性对照组以25 mg/(kg∙d) ig给药,对照组和衰老模型组小鼠则ig相应体积的生理盐水。
2.5.4 组织样品的处理实验第48天(造模与给药均为48 d),停止药物干预,小鼠禁食12 h,以眼眶后静脉丛取血,取血后颈椎脱臼处死小鼠,取出肝脏用0.9%预冷的生理盐水制备10%的组织匀浆,备用。分别测定血清及肝组织中SOD、GSH-Px、GSH及MDA水平。
2.5.5 数据处理采用SPSS 16.0软件进行ANOVA单因素方差分析,数据以x±s表示,组间比较采用t检验,P<0.05为显著性差异,P<0.01为极显著性差异。
2.5.6 小鼠血清指标的变化由表 7可知,与对照组相比,模型组小鼠血清中SOD、GSH-Px和GSH的活性均明显降低(P<0.05),而MDA水平显著增加(P<0.05),证明D-半乳糖致正常小鼠衰老模型造模成功。CPP3高剂量组能显著升高SOD、GSH-Px和GSH的活性(P<0.05),且显著降低MDA水平(P<0.05),与VE阳性对照组无显著性差异(P>0.05),证明CPP组分CPP3高剂量组对小鼠的抗氧化作用显著;而中、低剂量组对小鼠的抗氧化作用不明显。
|
|
表 7 CPP3对小鼠血清SOD、GSH-Px、GSH及MDA的影响 Table 7 Effects of CPP3 on serum SOD, GSH-Px, GSH, and MDA in mice |
2.5.7 小鼠肝脏指标的变化
由表 8可知,与对照组比较,模型组小鼠肝脏组织匀浆中SOD、GSH-Px和GSH的活性均明显降低(P<0.05),而MDA水平显著增加(P<0.05),证明D-半乳糖致正常小鼠衰老模型造模成功。CPP3高剂量组能显著提高小鼠肝脏组织中SOD、GSH-Px和GSH酶的活性(P<0.05),并能显著降低MDA水平(P<0.05),与VE阳性对照组相比,无显著性变化(P>0.05);而中、低剂量组对小鼠肝脏中SOD、GSH-Px和GSH的活性及MDA水平的影响较小(P>0.05)。
|
|
表 8 CPP3对小鼠肝脏组织匀浆SOD、GSH-Px、GSH及MDA的影响 Table 8 Effects of CPP3 on SOD, GSH-Px, GSH, and MDA in liver homogenate of mice |
3 讨论
本研究采用采用中空纤维超滤实验装置,以膜通量为指标,对CPP粗提液进行分级、冷冻干燥,最终筛选出3个组分CPP1、CPP2、CPP3。单糖组成分析和红外光谱数据表明,CPP1可能是以葡萄糖醛酸为主链组成的杂多糖,而CPP2和CPP3可能是以氨基半乳糖为主链组成的杂多糖[18-19]。体外抗氧化实验结果表明,CPP对DPPH、羟自由基和超氧阴离子自由基的清除能力弱于VC,但在一定浓度范围内,CPP3的清除作用强于CPP1和CPP2,表明低MW的CPP3抗氧化作用最强。根据体外抗氧化实验结果,选择考察体外抗氧化力最强的CPP3对D-半乳糖致衰老小鼠的保护作用,结果CPP3高剂量组能显著提高小鼠血清和肝脏组织中SOD、GSH-Px和GSH酶的活性,表明CPP3对D-半乳糖所致衰老小鼠具有明显的保护作用。
| [1] | 张雪梅. 党参多糖研究概况[J]. 辽宁中医药大学学报, 2015, 17(12):127–131. |
| [2] | 郭琼琼.党参挥发性成分分析及特殊香气研究[D].太原:山西医科大学, 2016. |
| [3] | 孙政华, 邵晶, 郭玫. 党参化学成分及药理作用研究进展[J]. 安徽农业科学, 2015, 43(33):174–176. |
| [4] | Xu C, Liu Y, Yuan G X, et al. The contribution of side chains to antitumor activity of a polysaccharide from Codonopsis pilosula[J]. Int J Biol Macromol, 2012, 50(4): 891–901. DOI:10.1016/j.ijbiomac.2012.01.013 |
| [5] | Liu C, Chen J, Li E T, et al. The comparison of antioxidative and hepatoprotective activities of Codonopsis pilosula polysaccharide (CP) and sulfated CP[J]. Int Immunopharmacol, 2015, 24(2): 299–307. DOI:10.1016/j.intimp.2014.12.023 |
| [6] | 李启艳, 胡德福, 张雪梅, 等. 党参多糖提取纯化工艺优化及其组成研究[J]. 中草药, 2016, 47(15):2663–2667. |
| [7] | 武婧, 唐志书, 宋忠兴, 等. 山茱萸水提液超滤工艺优化研究[J]. 中草药, 2015, 46(22):3338–3343. |
| [8] | Zou Y F, Chen X F, Malterud K E, et al. Structural features and complement fixing activity of polysaccharides from Codonopsis pilosula Nannf. var. modesta L. T. Shen roots[J]. Carbohyd Polym, 2014, 113(26): 420–428. |
| [9] | 王丽波, 程龙, 徐雅琴, 等. 南瓜籽多糖热水提取工艺优化及其抗氧化活性[J]. 农业工程学报, 2016, 32(9):284–287. |
| [10] | 邵晶, 孙政华, 郭玫, 等. Box-Behnken设计-响应面法优化参芪复方总多糖醇沉工艺[J]. 中国医药工业杂志, 2016, 47(8):1012–1016. |
| [11] | 潘悠优, 花佩, 王允祥, 等. 无花果多糖提取、分离纯化及生物活性的研究进展[J]. 食品科学, 2016, 37(17):289–295. |
| [12] | Yang C X, Gou Y Q, Chen J Y, et al. Structural characterization and antitumor activity of a pectic polysaccharide from Codonopsis pilosula[J]. Carbohyd Polym, 2013, 98(15): 886–895. |
| [13] | Chen Y X, Liu X Y, Xiao Z, et al. Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J]. Int J Biol Macromol, 2016, 430(22): 29–38. |
| [14] | Hammi K M, Hammami M, Rihouey C, et al. Optimization extraction of polysaccharide from Tunisian zizyphus lotus fruit by response surface methodology:Composition and antioxidant activity[J]. Food Chem, 2016, 212(1): 476–484. |
| [15] | 伍春.党参多糖对D-半乳糖致衰老小鼠皮肤抗氧化作用及基因表达谱的影响[D].兰州:甘肃中医学院, 2014. |
| [16] | Huang H D, Wu M M, Yang H P, et al. Structural and physical properties of sanxan polysaccharide from Sphingomonas sanxanigenens[J]. Carbohyd Polym, 2016, 144(25): 410–417. |
| [17] | Xin T, Zhang F B, Jiang Q Y, et al. The inhibitory effect of a polysaccharide from Codonopsis pilosula on tumor growth and metastasis in vitro[J]. Int J Biol Macromol, 2012, 51(5): 788–796. DOI:10.1016/j.ijbiomac.2012.07.019 |
| [18] | Cescutti P, De Benedetto G, Rizzo R. Structural determination of the polysaccharide isolated from biofilms produced by a clinical strain of Klebsiella pneumoniae[J]. Carbohyd Res, 2016, 91(8): 505–513. |
| [19] | 何钢, 刘嵬, 李会萍. 银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究[J]. 食品工业科技, 2015, 36(22):81–85. |
 2017, Vol. 48
2017, Vol. 48


