2. 延边大学 测试中心, 吉林 延吉 133002;
3. 延边大学 长白山生物资源与功能分子教育部重点实验室, 吉林 延吉 133002
2. Analysis and Test Center, Yanbian University, Yanji 133002, China;
3. Key Laboratory of Organism Functional Factors of the Changbai Mountains of Ministry of Education, Yanbian University, Yanji 133002, China
瓦松属植物为多年生肉质草本植物,作为药用资源的瓦松属植物有7种,包括瓦松Orostachys fimbriata (Turcz.) Berger、钝叶瓦松O. malacophyllus (Pall.) Fisch.、黄花瓦松O. spinosus (L.) C. A. Mey.、狼爪瓦松O. cartilaginea A. Bor.、塔花瓦松O. chanetii (Lévl.) Berger、晚红瓦松O. erubescens (Maxim.) Ohwi、小苞瓦松O. thyrsiflora Fisch.[1]。
随着人们对肉质植物的研究兴趣越发浓厚,景天科瓦松属植物也正在受到研究者们的关注。瓦松属植物含有的化学成分有黄酮、甾醇、酚酸、三萜以及强心苷等[2-3]。国内外对该属植物化学成分和药理方面已经有研究[4-10],但都缺少深度挖掘瓦松的潜在药用价值的研究。钝叶瓦松具有清热解毒、止血消肿、利湿敛疮等传统功效[11-13]。目前对该属植物化学成分和生物活性的研究相对较少,且多集中在粗提取物上。因此,本实验对长白山地区钝叶瓦松的化学成分及生物活性进行研究,从其茎的甲醇提取物中分离鉴定5个成分,分别为苹果酸-1-乙酯(1-ethyl-2-hydroxysuccinate,1)、2-(3, 4-二羟基苯酰基氧代)-苹果酸单乙酯(1-ethyl-2-O-[(3, 4-dihydroxy-benzoyl) oxy]-succinate,2)、2-(3, 4-二羟基苯酰基氧代)-苹果酸二甲酯(1, 4-dimethy-2-O-[(3, 4-dihydroxy-benzoyl) oxy]-succinate,3)、2-对羟基苯酰基氧代-苹果酸二甲酯(1, 4-dimethy-2-O-[(4-dihydroxybenzoyl) oxy]-succinate,4)、邻苯二甲酸二异丁酯(diisobutyl phthalate,5)。其中,化合物1~5为从该属植物中首次分离得到;2为新化合物,命名为瓦松酚酸,其对HeLa细胞的细胞毒活性IC50值为111.5 μmol/L。
1 仪器与材料Agilent 1100高效液相色谱-质谱联用仪(美国安捷伦);AV-300型核磁共振仪(瑞士布鲁克);手提式紫外检测器(254 nm,上海顾村电光仪器厂);柱色谱用硅胶(100~200目,青岛海浪硅胶干燥剂厂);甲醇、三氯甲烷、石油醚、醋酸乙酯、二氯甲烷均为分析纯。
实验所用的药材钝叶瓦松茎采集于吉林省长白山地区,经延边大学药学院生药学教研部吕惠子副教授鉴定为钝叶瓦松Orostachys malacophyllus (Pall.) Fisch.,其标本(YB-DW-0001)保存于延边大学药学院植物标本室。
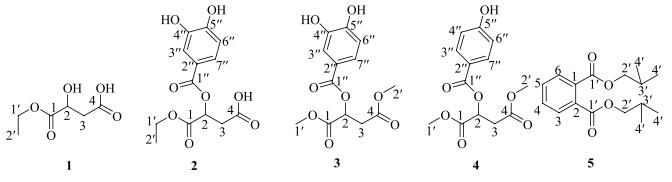
2 方法 2.1 提取与分离称取干燥的钝叶瓦松茎约2 kg,粉碎,室温条件下甲醇浸泡,超声提取3次,每次30 min。滤过,收集提取液,合并3次提取液,浓缩干燥得提取物56.2 g。然后将提取物悬于水中,用醋酸乙酯进行萃取,经浓缩得到醋酸乙酯萃取物22.3 g。将醋酸乙酯萃取物经硅胶柱色谱分离,石油醚-醋酸乙酯-甲醇混合溶剂梯度洗脱(100%石油醚、石油醚-醋酸乙酯1:10~1:3、石油醚-醋酸乙酯-甲醇10:3:1),经TLC检测并合并得到组分,经反复硅胶柱色谱进行分离纯化,得到化合物1(4.2 mg)、2(3.6 mg)、3(4.5 mg)、4(5.1 mg)、5(4.0 mg)。结构见图 1。
|
图 1 化合物1~5的结构 Fig.1 Structures of compounds 1-5 |
2.2 细胞存活率测定
在37 ℃、5% CO2的条件下,将人宫颈癌HeLa细胞培养于含10%胎牛血清、100 g/L青霉素、100 g/L链霉素的DMEM培养基中,每2~3天消化传代1次,取其中处于对数生长期的细胞进行实验。实验组分别加入不同浓度梯度药物的培养液(2.5、5、10 μmol/mL),同时设置对照组,每组设置3个复孔,加药后继续在培养箱中孵育24 h,倒置显微镜下观察。培养结束后,避光条件下每孔加入CCK-8溶液10 μL,然后将96孔板继续在培养箱内孵育1~4 h,用酶标仪于450 nm波长处测定各孔吸光度(A)值,计算细胞存活率。
细胞存活率=A给药/A对照
3 结构鉴定化合物1:亮黄色油状物,1H-NMR (300 MHz, CD3OD) δ: 4.47 (1H, t, J=6.0 Hz, H-2), 4.20 (2H, q, J=6.0 Hz, H-1'), 2.71 (2H, dd, J=6.0, 12.0 Hz, H-3), 1.27 (3H, t, J=6.0 Hz, H-2');13C-NMR (75 MHz, CDCl3) δ: 173.4 (C-1), 170.5 (C-4), 67.3 (C-2), 60.9 (C-1′), 38.7 (C-3), 14.1 (C-2′);TOF-MS m/z 162.05 [M]+,上述数据与文献报道一致[14-15],确定化合物1及其乙酯位置,鉴定其结构为苹果酸-1-乙酯。
化合物2:无色胶状物,分子式为C13H14O8;[α]D20 +5.4 (c 0.11,MeOH);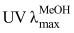
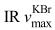
化合物3:无色胶状物,1H-NMR (300 MHz, CD3OD) δ: 7.53 (1H, s, H-3″), 7.49 (1H, d, J=9.0 Hz, H-6″), 6.83 (1H, d, J=9.0 Hz, H-7″), 4.69 (1H, t, J=6.0 Hz, H-2), 3.77 (3H, s, H-1′), 3.75 (3H, s, H-2′), 3.05 (2H, d, J=6.0 Hz, H-3);13C-NMR (75 MHz, CD3OD) δ: 170.2 (C-1), 170.1 (C-4), 165.6 (C-1″), 149.5 (C-4″), 143.4 (C-5″), 124.1 (C-3″), 120.9 (C-2″), 116.7 (C-6″), 114.8 (C-7″), 68.6 (C-2), 53.0 (C-1′), 52.5 (C-2'), 36.2 (C-3);TOF-MS m/z: 298.07 [M]+,综合分析化合物3的1H-和13C-NMR数据发现与文献报道一致[16],鉴定化合物3为2-(3, 4-二羟基苯酰基氧代)-苹果酸二甲酯。
化合物4:无色胶状物,[α]20D +5.5 (c 0.11,MeOH); 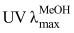
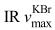
化合物5:黄色油状物,ESI-MS m/z: 301 [M+Na]+, 279 [M+H]+。1H-NMR (300 MHz, CDCl3) δ: 7.74 (2H, q, J=3.0 Hz, H-3, 6), 7.56 (2H, q, J=3.0 Hz, H-4, 5), 4.11 (4H, d, J=4.0 Hz, H-2′, 2′), 2.06 (2H, sept, J=4.0 Hz, H-3′, 3′), 1.01 (12H, d, J=4.0 Hz, H-4′, 4′, 4′, 4′);13C-NMR (75 MHz, CDCl3) δ: 167.7 (C-1′, 1′), 132.2 (C-1, 2), 130.9 (C-3, 6), 128.8 (C-4, 5), 71.8 (C-2′, 2′), 27.7 (C-3′, 3′), 19.2 (C-4′, 4′, 4′, 4′),上述数据与文献报道一致[18-22],由此可鉴定化合物5为邻苯二甲酸二异丁酯。
4 肿瘤细胞增殖抑制活性采用CCK-8方法对5个化合物进行了肿瘤细胞增殖抑制活性筛选,其中化合物1~5对HeLa细胞的细胞毒性的IC50值分别为136.6、111.5、150.0、163.3、200.4 μmol/L。其中,化合物1~4含有相同苹果酸骨架,构效关系有待进一步探讨。
| [1] | 尹秀梅, 王思宏. 长白山景天科植物品种、植物成分及酶抑制活性的研究进展[J]. 延边大学学报:自然科学版, 2015, 41(1):89–94. |
| [2] | 肖杰, 柴军红, 杨春文, 等. 不同产地瓦松活性成分初步研究[J]. 中国林副特产, 2015, 134(1):26–28. |
| [3] | 郑万金, 仲英, 孙敬勇, 等. 瓦松的化学成分研究[J]. 中草药, 2009, 40(6):859–862. |
| [4] | 李承范, 王思宏, 李东浩. 狼爪瓦松提取物的抗氧化活性的研究[J]. 食品科技, 2015, 40(4):285–288. |
| [5] | Choi S Y, Chung M J, Seo W D, et al. Inhibitory effects of Orostachys japonicus extracts on the formation of N-nitrosodimethylamine[J]. J Agric Food Chem, 2006, 54(16): 6075–6078. DOI:10.1021/jf060845f |
| [6] | Kim H J, Lee J Y, Kim S M, et al. A new epicatechin gallate and calpain inhibitory activity from Orostachys japonicus[J]. Fitoterapia, 2009, 80(1): 73–76. DOI:10.1016/j.fitote.2008.10.003 |
| [7] | Kim J H, Lee S H, Jang H D, et al. (-)-Epicatechin derivate from Orostachys japonicus as potential inhibitor of the human butyrylcholinesterase[J]. Int J Biol Macromol, 2016, 91: 1033–1039. DOI:10.1016/j.ijbiomac.2016.06.069 |
| [8] | Lee J H, Lee S J, Park S, et al. Characterisation of flavonoids in Orostachys japonicus A. Berger using HPLC-MS/MS:Contribution to the overall antioxidant effect[J]. Food Chem, 2010, 124(4): 1627–1633. |
| [9] | Yoon N Y, Min B S, Lee H K, et al. A potent anti-complementary acylated sterol glucoside from Orostachys japonicus[J]. Arch Pharm Res, 2005, 28(8): 892–896. DOI:10.1007/BF02973873 |
| [10] | Zhang H Y, Oh J, Jang T S, et al. Glycolipids from the aerial parts of Orostachys japonicus with fatty acid synthase inhibitory and cytotoxic activities[J]. Food Chem, 2012, 131(4): 1097–1103. DOI:10.1016/j.foodchem.2011.09.058 |
| [11] | 金英花, 朴哲龙. 吉林省龙井地区瓦松属植物种群生态特性[J]. 延边大学农学学报, 2014, 36(4):306–310. |
| [12] | 袁鹏.钝叶瓦松中活性成分的研究[D].延边:延边大学, 2016. |
| [13] | Nugroho A, Kim M H, Han Y R, et al. High-performance liquid chromatographic quantification of flavonol glycosides in Orostachys species[J]. Nat Prod Sci, 2012, 18(1): 32–38. |
| [14] | Giumanini A G, Verardo G, Della Martina D, et al. Improved method for the analysis of organic acids and new derivatization of alcohols in complex natural aqueous matrixes:Application to wine and apple vinegar[J]. J Agric Food Chem, 2001, 49(6): 2875–2882. DOI:10.1021/jf0103368 |
| [15] | Houston T A, Wilkinson B L, Blanchfield J T. Boric acid-catalyzed chemoselective esterification of α-hydroxycarboxylic acids[J]. Org Lett, 2004, 6(5): 679–681. DOI:10.1021/ol036123g |
| [16] | Saxena U, Akella V. Novel conjugation-facilitated transport of drugs across blood brain barrier:India, WO 2013035053 A2[P]. 2013-03-14. |
| [17] | Jiang Z B, Jiang B Y, Zhu C G, et al. Aromatic acid derivatives from the lateral roots of Aconitum carmichaelii[J]. J Asian Nat Prod Res, 2014, 16(9): 891–900. DOI:10.1080/10286020.2014.939585 |
| [18] | Ahmadi F, Sadeghi S, Modarresi M, et al. Chemical composition, in vitro anti-microbial, antifungal and antioxidant activities of the essential oil and methanolic extract of Hymenocrater longiflorus benth of Iran[J]. Food Chem Toxicol, 2010, 48(5): 1137–1144. DOI:10.1016/j.fct.2010.01.028 |
| [19] | 李雯, 田新雁, 肖朝江, 等. 黄花香茶菜地下部分化学成分及生物活性研究[J]. 中草药, 2013, 44(9):1091–1095. |
| [20] | 李洋, 郑承剑, 秦路平. 毛鸡屎藤全草的化学成分研究[J]. 中草药, 2012, 43(4):658–660. |
| [21] | 林大都, 刘嘉炜, 李武国, 等. 蒲桃茎化学成分及其体外细胞毒活性研究[J]. 中草药, 2014, 45(14):1993–1997. |
| [22] | 刘冰晶, 陈光英, 蓝简, 等. 斜脉暗罗茎化学成分研究 (Ⅰ)[J]. 中草药, 2011, 42(7):1264–1266. |
 2017, Vol. 48
2017, Vol. 48


