2. 山西大学化学化工学院, 山西 太原 030006;
3. 中国医学科学院 北京协和医学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Science and Peking Union Medical College, Beijing 100050, China
衰老是受遗传、环境条件和生活方式等多因素影响的生物学过程。目前,衰老相关的理论涉及自由基、免疫、炎症和线粒体等方面,它们相互补充,揭示着衰老进程所涉及的生理变化。然而,现阶段对衰老及其防治措施的研究还远远不够[1],因此抗衰老药物及其机制研究仍然是医学界备受关注的重要课题。
黄芩素是从唇形科(Labiatae)黄芩属Scutellaria Linn.植物黄芩Scutellaria baicalensis Georgi干燥根中提取分离的黄酮类化合物,具有抗菌、抗病毒、抗炎、抗肿瘤、心脑血管和神经保护等作用[2]。Havermann等[3]研究发现100 μmol/L黄芩素能延长线虫的平均寿命45%,中位寿命57%和最高寿命24%;本课题组研究发现0.2 mg/mL黄芩素能延长自然衰老模型雄性果蝇的平均寿命19.80%和中位寿命25.64%[4-5],且黄芩醇提物在D-半乳糖致大鼠衰老模型中显示出一定的抗衰老作用[6]。然而,黄芩素在D-半乳糖致大鼠衰老模型中的作用机制尚不明确。
代谢组学是一种快速识别生物系统全部代谢成分的新方法,能够通过识别潜在生物标志物来评价系统反映的细微病理生理应激,为探索整个机体功能提供补充信息。代谢组学的运用是生命科学研究领域的重大突破,也是传统中医药研究的重要工具[7-8]。核磁共振(NMR)在代谢组学研究中广泛使用[9],因为它对样品提供了非选择性和非破坏性的信息,并且是一个以检测少量样品获得结果的首选平台。本研究采用旷场实验考察黄芩素在D-半乳糖致衰老大鼠模型中的作用,应用1H-NMR代谢组学技术结合多元统计方法分析模型大鼠血清中内源性代谢产物的变化规律,发现黄芩素抗衰老的潜在生物标志物,为抗衰老药物研发提供科学依据。
1 材料与方法 1.1 动物与分组SPF(无特定病原体)级雄性SD大鼠,体质量180~200 g,均购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2015-0001。在动物适应新环境1周之后进行实验。所有动物饲养在室温(20~25 ℃)、恒定湿度(45%~60%)、12 h的光暗循环下。75只SD大鼠称体质量并随机分为5组,包括对照组,模型组,黄芩素低、中、高剂量(50、100、200 mg/kg)组(n=15)。模型组与黄芩素低、中、高剂量组每天sc 150 mg/kg D-半乳糖,对照组sc等体积的生理盐水,连续10周。造模同时黄芩素低、中、高剂量组每天分别ig相应剂量的黄芩素,对照组与模型组每天ig等体积的蒸馏水,连续10周。
1.2 药材、仪器与试剂黄芩素(批号JZ20150711,质量分数>98%),购自南京景竹生物科技有限公司;Bruker 600 MHz Avance Ⅲ核磁共振仪(德国Bruker公司);Sartorius BSA124S分析天平(德国Sartorius公司);TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司);D-半乳糖(Sigma公司);核磁试剂重水(Norell,美国),娃哈哈纯净水。
1.3 旷场实验旷场实验是评价实验动物自主探索行为及紧张度的经典方法[10]。每组大鼠给予D-半乳糖10周后进行旷场实验,每次捏住大鼠尾巴距根部2/3处轻放入旷场木箱正中的格中让其自由活动,观察其在4 min内的活动情况,记录大鼠跨越方格总数和直立次数,每次测定结束将动物排泄物清除干净,每只仅测定1次。分析大鼠空间自发性探索运动活性,可以间接反映大鼠的衰老情况。
1.4 样品收集与制备造模结束后,将大鼠用10%水合氯醛按照3.5 mL/kg的剂量ip麻醉,行腹主动脉采血至EP管。全血静置后,4 ℃,3 500 r/min离心15 min,取血清,储存于−80 ℃冰箱中。
样品前处理:血清样品室温解冻后,取450 μL置于EP管中,加入D2O 350 μL,涡旋混匀,4 ℃,13 000 r/min离心20 min,取上清液600 μL于内径5 mm的核磁管中,用于检测。
1.5 1H-NMR测定与谱图处理样品于Bruker 600 MHz Avance Ⅲ核磁共振仪上测定(25 ℃),采用1D CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列,检测谱宽7 194.2 Hz,扫描次数为64,FID分辨率0.188 Hz,脉冲时间9.95 s,采样时间4.554 8 s,延迟时间1.0 s,采样间隔40.5 s,采样点为32 768。
所有谱图采用MestReNova(Mestrelab Research,Santiago de Compostella,西班牙)核磁图谱专业处理软件对血清1H-NMR图谱进行傅里叶转换,并进行手动相位、基线调整。血清谱图中以肌酐(δ 3.04,-CH3)为标准进行定标,以δ 0.01对化学位移区间δ 0.60~9.60进行分段积分,排除δ 4.7~5.1区域的水峰不进行积分,并将积分数据进行归一化。将上述数据保存在Excel文档中,用于多元统计分析。
运用SIMCA-P 13.0(Umetrics,瑞典)软件将积分数据进行中心化和规格化后,进行偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal PLS-DA,OPLS-DA),找出样品间差异代谢产物。
1.6 统计学方法数据以x±s表示,采用统计学软件Prism Graph Pad 5.0进行统计分析,通过配对t检验比较组间差异。
2 结果 2.1 旷场实验结果与对照组相比,D-半乳糖致衰老模型组大鼠穿越格数和直立次数均显著减少(P<0.01),表明其运动能力和自主探索能力下降,显示出一定的衰老特征;给予黄芩素后大鼠穿越格数和直立次数均增加,其中200 mg/kg黄芩素能显著增加模型大鼠的穿越格数和直立次数(P<0.05),表明黄芩素能明显改善D-半乳糖致衰老大鼠的自发行为(表 1)。
|
|
表 1 黄芩素对衰老大鼠旷场实验的影响 Table 1 Effects of baicalein on open field of aging rats |
2.2 血清图谱指认与分析
参照文献报道[11-12]并结合公共数据库HMDB(http://www.hmdb.ca/)、BMRB(http://www.bmrb.wisc.edu/)及软件Chenomx NMR Suite(ChenomxInc,加拿大),对图谱中的主要化合物进行指认,在大鼠血清中共指认出34种内源性代谢产物,见图 1和表 2。
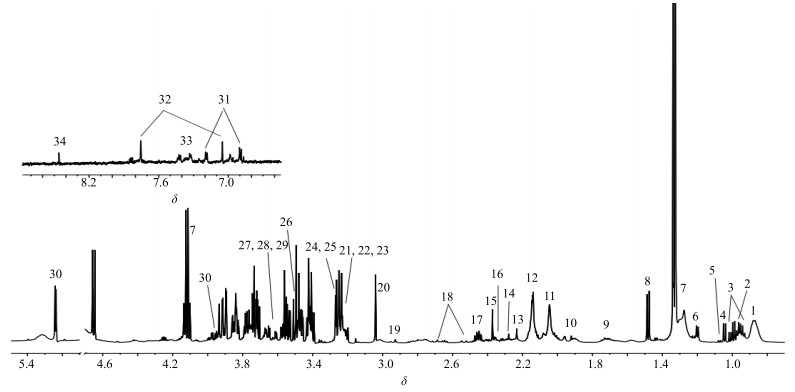
|
图 1 对照组大鼠血清样本1H-NMR图谱 Fig.1 Typical 1H-NMR spectrum of rat serum in control group |
|
|
表 2 大鼠血清样本1H-NMR数据归属 Table 2 1H-NMR assignments of major metabolites from rat serum |
2.3 多元统计分析
为进一步明确各组间代谢物的差异,对复杂数据降维处理来分析,采用有监督的PLS-DA方法对模型组,对照组,黄芩素低、中、高剂量组的血清进行数据矩阵的代谢轮廓分析(图 2),结果显示对照组和模型组明显分开,表明模型复制成功;黄芩素低、中剂量组更接近于模型组,而高剂量组和对照组均沿t[2]轴与模型组明显分开,进一步说明高剂量组具有显著的回调作用,与行为学结果一致。有监督的模式识别方法需用外部模型验证方法排列实验来证明模型的有效性。由图 2可知,2条回归线的斜率较大,下方回归线与纵轴截距较小,其中所有的R2和Q2的值均低于原始值,表明模型验证有效。
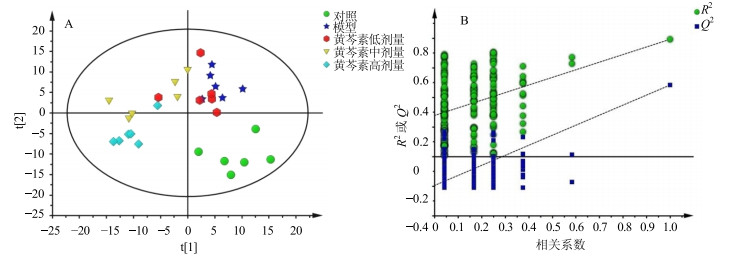
|
图 2 大鼠血清样本PLS-DA散点图(A)和相应的模型验证图(B) Fig.2 PLS-DA (A) and corresponding validation plot (B) derived from 1H-NMR spectra of serum from all rats |
2.4 血清差异代谢物的筛选
为进一步确定造模前后大鼠血清中内源性代谢产物的差异,最大化组间分离,寻找模型组和对照组血清样本差异代谢物,对对照组和模型组进行OPLS-DA分析得到OPLS-DA得分图(图 3-A)和S-plot图(图 3-B)。通过S-plot图结合VIP值(>1),独立样本t检验P<0.05寻找差异代谢物,从而得到11个峰面积具有显著性差异的潜在生物标志物。与对照组比较,模型组大鼠血清中丙氨酸、醋酸、丙酮酸、酪氨酸、N-乙酰糖蛋白水平升高,而谷氨酰胺、二甲基甘氨酸、甘氨酸、苏氨酸、肌酐、组氨酸水平降低。对于这11种潜在的生物标志物,给予黄芩素干预后能显著回调9个,包括谷氨酰胺、二甲基甘氨酸、甘氨酸、苏氨酸、肌酐、组氨酸、丙氨酸、酪氨酸、N-乙酰糖蛋白(表 3),表明黄芩素对衰老大鼠血清潜在生物标志物有显著的干预作用。
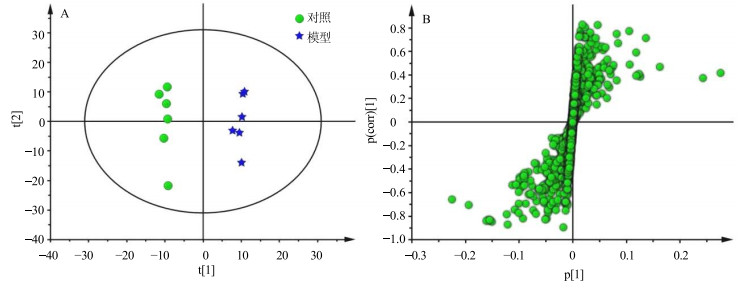
|
图 3 对照组与模型组大鼠血清样本OPLS-DA散点图(A)和相对应的S-plot图(B) Fig.3 OPLS scores plot (A) and corresponding S-plot (B) of serum of rats in control and model groups |
|
|
表 3 大鼠血清中1H-NMR谱潜在生物标志物的相对峰面积 Table 3 Relative peak areas of potential biomarkers in 1H-NMR spectra of serum |
2.5 血清差异代谢物的相关分析
血清中差异性代谢物相关性分析结果如图 4所示,根据此图可以看出差异性代谢物之间的相关性。从横轴看,在同一小分支下的物质它们的正相关性最强,即某一个物质的量升高或者降低,则与之相关性强的物质会随之升高或降低。结合表 1,可以看出组氨酸、苏氨酸、甘氨酸、谷氨酰胺之间正相关性较强,而与N-乙酰糖蛋白、酪氨酸负相关性较强;N-乙酰糖蛋白和酪氨酸正相关性较强。以上结果提示,黄芩素延缓衰老的作用机制有可能与多条代谢通路相关,且这些代谢物与代谢途径相互关联、相互影响。
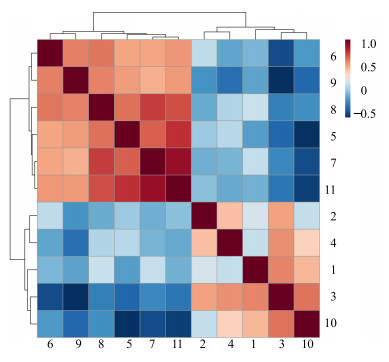
|
1-丙氨酸2-醋酸3-N-乙酰糖蛋白4-丙酮酸5-谷氨酰胺6-二甲基甘氨酸7-甘氨酸8-苏氨酸9-肌酐10-酪氨酸11-组氨酸;图中水平轴和垂直轴均代表变量信息;颜色越深反映相关性越强,颜色越浅反映相关性越弱;棕色表示正相关,蓝色表示负相关 1-alanine 2-acetic acid 3-N-acetylglycoprotein 4-pyruvic acid 5-glutamine 6-dimethylglycine 7-glycine 8-threonine 9-creatinine 10-tyrosine 11-histidine; The horizontal axis and vertical axis represent variable information; the deep color represents strong correlation, and the light color represents weak correlation; the brown denotes positive correlation, and the blue denotes negative correlation 图 4 差异代谢物相关性分析 Fig.4 Correlation analysis results of biomarkers |
2.6 代谢通路分析
采用1H-NMR分析手段检测出34种血清代谢产物,从中筛选出11种差异代谢物。将这些差异代谢物输入metaboanalyst中进行通路富集分析,MetPA通路分析结果(图 5)和代谢产物富集结果(图 6)一致。其中MetPA共给出24条通路分析的结果,综合Holm P值、FDR(false discovery rate)和Impact值共发现3条黄芩素干预D-半乳糖致衰老大鼠的代谢通路:甘氨酸、丝氨酸和苏氨酸代谢,丙酮酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成。而组氨酸代谢通路因具有较大的Impact值也被列为代谢途径进行通路分析。结合KEGG数据库本研究的差异代谢物涉及的代谢路径主要有糖代谢、氨基酸代谢及核苷酸代谢(表 4)。
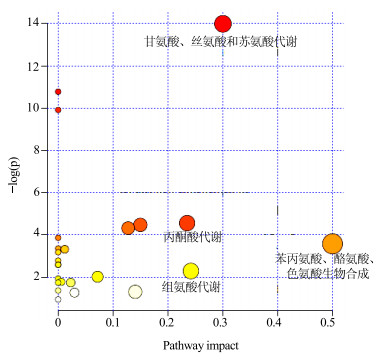
|
图 5 通路MetPA分析 Fig.5 MetPA analysis of metabolic pathway |
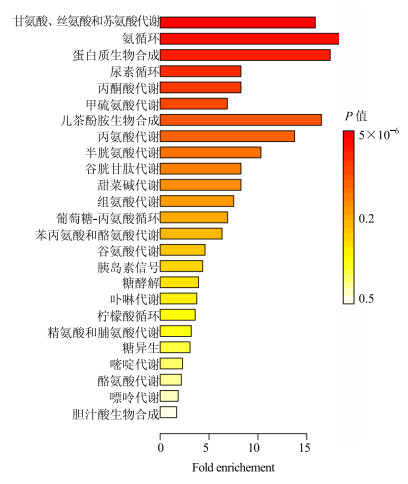
|
图 6 代谢产物富集 Fig.6 Enrichment of metabolite sets |
|
|
表 4 黄芩素干预D-半乳糖致衰老大鼠血清代谢物涉及的代谢途径 Table 4 Metabolic pathways affected by baicalein in serum of D-galactose-induced rats |
3 讨论
本课题组前期研究结果表明,黄芩素具有延长果蝇寿命的作用[4]。本研究基于D-半乳糖致衰老大鼠模型,采用代谢组学技术探讨黄芩素干预衰老大鼠的机制。
与对照组相比,模型组大鼠体内甘氨酸水平显著降低,这可能缘于甘氨酸为体内非必需氨基酸,需由葡萄糖转变而来,而模型组大鼠对葡萄糖的利用不足。另外,甘氨酸是一种抑制性神经递质,通过线粒体膜上的甘氨酸裂解系统在体内代谢,而给药组能显著回调甘氨酸水平表明黄芩素能通过干预甘氨酸代谢延缓衰老[13-14]。谷氨酰胺是人体含量最丰富的氨基酸,是糖代谢和氨基酸代谢的重要中间体,模型组大鼠体内谷氨酰胺水平降低提示衰老机体为减轻高血糖损伤而作出反应[15]。模型组大鼠体内酪氨酸水平升高提示衰老大鼠肠道内的菌群代谢发生紊乱[16];丙氨酸水平显著升高则提示能量代谢异常[17]。乙酰糖蛋白是一种炎症介质,能够改善机体代谢和机体免疫状况,对免疫功能的维持起到很好的作用[18]。黄芩素明显降低衰老大鼠血清乙酰糖蛋白的量,提示黄芩素可能通过抑制炎症从而延缓衰老。
本研究通过对D-半乳糖致衰老大鼠血清代谢物和代谢途径进行分析,发现黄芩素延缓衰老涉及的代谢路径--丙酮酸代谢、甘氨酸代谢和糖代谢都发生在线粒体内,而线粒体是进行氧化代谢的部位,是糖类、脂肪、氨基酸代谢释放能量的场所,可以将丙酮酸、脂肪酸、氨基酸转化为ATP[19]。大量实验研究表明线粒体在衰老进程中发挥着至关重要的作用,线粒体的氧化损伤是细胞衰老和细胞死亡的基础,线粒体DNA突变的累积加速老化,导致核DNA的氧化损伤,并损害基因转录[20-21]。此外,从转基因小鼠模型研究发现,线粒体功能障碍导致的神经损伤在衰老和许多神经退行性疾病的发生中起了一定的作用[22-23]。这就提示黄芩素可能通过调控代谢途径保护线粒体功能,从而延缓衰老,与Oliveira等[24]论述黄芩素是线粒体功能的重要保护剂相一致。
本研究表明给予黄芩素后能够对衰老大鼠血清中差异代谢物的量起到回调的作用,对衰老大鼠的代谢紊乱起到一定的改善作用,其延缓衰老的作用具有多环节、多层次、多靶点综合作用的特点,但在其他模型条件下是否也会引起类似的变化有待进一步探讨。
| [1] | Zarrouk A, Vejux A, Mackrill J, et al. Involvement of oxysterols in age-related diseases and ageing processes[J]. Ageing Res Rev, 2014, 11(18): 148–162. |
| [2] | 辛文妤, 宋俊科, 何国荣, 等. 黄芩素和黄芩苷的药理作用及机制研究进展[J]. 中国新药杂志, 2013, 22(6):647–653. |
| [3] | Havermann S, Rohrig R, Chovolou Y, et al. Molecular effects of baicalein in Hct116 cells and, caenorhabditis elegans:Activation of the Nrf2 signaling pathway and prolongation of lifespan[J]. J Agr Food Chem, 2013, 61(9): 2158–2164. DOI:10.1021/jf304553g |
| [4] | Gao L, Duan D D, Zhang J Q, et al. A bioinformatic approach for discovery of the anti-aging effects of baicalein from Scutellaria baicalensis Georgi[J]. Rejuv Res, 2016, 19(5): 414–422. DOI:10.1089/rej.2015.1760 |
| [5] | 闫明亮, 周玉枝, 李明花, 等. 基于1H-NMR代谢组学的黄芩醇提物延长果蝇寿命研究[J]. 中草药, 2016, 47(10):1714–1722. |
| [6] | 常艳芬, 宫文霞, 郑艳红, 等. 黄芩醇提物干预D-半乳糖致衰老大鼠的尿液代谢组学研究[J]. 药学学报, 2016, 51(1):86–92. |
| [7] | Liu X, Zhou Y, Li Z, et al. Anti-depressant effects of Xiaoyaosan on rat model of chronic unpredictable mild stress:a plasma metabonomics study based on NMR spectroscopy[J]. J Pharm Pharmacol, 2012, 64(4): 578–588. DOI:10.1111/j.2042-7158.2011.01412.x |
| [8] | 刘彩春, 刘欢, 谷陟欣, 等. 基于1H-NMR代谢组学的驴胶补血颗粒补血作用机制研究[J]. 中草药, 2016, 47(7):1142–1148. |
| [9] | 雷荣辉, 王青秀, 颜贤忠, 等. 利用1H-NMR技术研究大黄素染毒后大鼠内源性代谢物的改变[J]. 药物评价研究, 2015, 38(1):29–35. |
| [10] | 林晓春, 李云鹏, 卞艳芳, 等. 大鼠旷场实验指标检测及参考值的探讨[J]. 毒理学杂志, 2010, 24(3):224–225. |
| [11] | Gey C, Seeger K. Metabolic changes during cellularsenescence investigated by proton NMR-spectroscopy[J]. Mech Ageing Dev, 2013, 134(3/4): 130–138. |
| [12] | He P, Li Z Y, Xing J, et al. 1H-NMR based metabolic profiling of the processing effect on Rehmanniae Radix[J]. Anal Methods-UK, 2014, 6(8): 2736–2744. DOI:10.1039/c3ay42119h |
| [13] | 艾斯木提拉·奴拉合买提.异常黑胆质成熟剂延缓衰老作用的代谢组学研究[D].乌鲁木齐:新疆医科大学, 2013. |
| [14] | Zhou Y Z, Zheng X Y, Liu X J, et al. Metabonomic analysis of urine from chronic unpredictable mild stress rats using gas chromatography-mass spectrometry[J]. Chromatographia, 2012, 75(3/4): 157–164. |
| [15] | 夏小涛, 孙宁, 刘彩春, 等. 基于1H-NMR代谢组学的抑郁症生物标志物发现及帕罗西汀干预作用[J]. 药学学报, 2016, 51(4):595–599. |
| [16] | 刘焕兰, 曲卫玲, 武夏林, 等. 琼玉膏干预D-半乳糖致衰老大鼠的血清代谢组学研究[J]. 广州中医药大学学报, 2014, 31(4):561–565. |
| [17] | Sofy S H, Kakey E S, Alshamaa S D. Anti-aging role of grape seed extract and α-lipoic acid in D-galactose-induced aging rats[J]. Int J Agricbiol, 2014, 3(3): 110–114. |
| [18] | Saric J, Li J V, Swann J R, et al. Integrated cytokine and metabolic analysis of pathological responses to parasite exposure in rodents[J]. J Proteome Res, 2010, 9(5): 2255–2264. DOI:10.1021/pr901019z |
| [19] | Boczonadi V, Horvath R. Mitochondria:Impaired mitochondrial translation in human disease[J]. Int J Biochem Cell B, 2014, 48(100): 191–199. |
| [20] | Szarka A, Banhegyi G, Sumegi B. Mitochondria, oxidative stress and aging[J]. Free Radic Res, 2014, 155(12): 447–452. |
| [21] | Lee H Y, Choi C S, Birkenfeld A L, et al. Targeted expression of catalase to mitochondria prevents age-associated reductions in mitochondrial function and insulin resistance[J]. Cell Metab, 2010, 12(6): 668–674. DOI:10.1016/j.cmet.2010.11.004 |
| [22] | Beal M F. Mitochondria take center stage in aging and neurodegeneration[J]. Ann Neurol, 2005, 58(4): 495–505. DOI:10.1002/(ISSN)1531-8249 |
| [23] | Fukui H, Moraes C. Mechanisms of formation and accumulation of mitochondrial DNA deletions in aging neurons[J]. Hum Mol Genet, 2009, 18(6): 1028–1036. DOI:10.1093/hmg/ddn437 |
| [24] | Oliveira M R D, Nabavi S F, Habtemariam S, et al. The effects of baicalein and baicalin on mitochondrial function and dynamics:A review[J]. Pharmacol Res, 2015, 10(100): 296–308. |
 2017, Vol. 48
2017, Vol. 48


