中药是多组分的的组合体,中药质量控制应采用多指标、多手段等方法进行综合性评价。中药指纹图谱能全面体现中药成分的整体性与稳定性[1-3],并体现种属间的共有性图谱片段;一测多评法(QAMS)以样品中某一典型组分为内标,建立与其他组分之间的相对校正因子(f),并通过f计算其他组分的量[4-7],是《中国药典》2015年版品种修订中重点推广技术。QAMS常应用于对照品难分离、单体不稳定或价格昂贵的中药质量控制[8]。指纹图谱与QAMS相结合的方法全面、科学地评价中药的质量,提高了中药的稳定性和一致性[8-9]。近年来,国内外也有文献报道将2种方法结合用于中药的质量控制与定量测定[8-11]。多酚类成分含有活性羟基,有很强的抗氧化能力。具有抑菌[12-14]、抗氧化[15-16]、抗感染[17]、抗衰老[18]、抗肿瘤[19-20]和保护心脏[16, 21-24]等作用。荔枝Litchi chinensis Sonn.为无患子科(Sapindaceae)荔枝属Litchi Sonn.南方常青植物,荔枝极具开发价值。古有记载,荔枝根可行气止痛、固肾止涩;树皮可舒肝解郁、祛风健胃;树枝可治虚喘;叶可解暑消滞、收湿敛疮;花可治喉痹肿痛;果壳可治血崩;果核则有行气散结、祛寒止痛之功效[25]。本课题组前期得到的荔枝多酚提取物[26],经过分离、分析和鉴定,已经鉴定出4个化合物的结构,分别为表儿茶素、原花青素A2、原花青素B2和表儿茶素-(4β→8, 2β→O→7)-表儿茶素-(4β→8)-表儿茶素(以下简称PC-C)。采用指纹图谱对荔枝多酚提取物进行整体评价,并采用QAMS法对多酚提取物中单个组分进行定量测定,为荔枝多酚的质量控制提供技术支持。
1 仪器与材料Acquity UPLC H-Class液相色谱仪,检测器为PDA及QDA,工作站为Empower 3,美国Waters;CP225D电子分析天平,德国Sartorius;Acquity UPLC® HSS T3(100 mm×2.1 mm,1.8 μm)色谱柱。共收集22批荔枝不同部位、不同采收期的原材料,见表 1。其中共获得5个成熟期的荔枝皮。取原材料适量,用68%乙醇按液料比20:1、59 ℃回流提取93 min,共2次。合并滤液,减压浓缩至无醇味,AB-8大孔吸附树脂吸附,收集65%乙醇洗脱液,43 ℃减压浓缩,冷冻干燥,即得22批多酚提取物,以原材料采集日期作为批号。荔枝生长过程中,荔枝形成果实但未成熟会出现3次大面积生理落果,未成熟核和未成熟皮由生理落果剥离获得。
|
|
表 1 22批荔枝原材料 Table 1 22 Batches of raw materials of Litchi chinensis |
表儿茶素对照品,质量分数≥98%,批号878-200102,中国食品药品检定研究院;原花青素A2、原花青素B2、PC-C,从提取物中分离制备所得,经UV、IR、ESI-MS2、NMR谱确证,质量分数均≥98%。甲醇、乙腈,色谱纯,德国Merck KGaA;甲酸,色谱纯,天津市科密欧化学试剂有限公司;液相用蒸馏水,屈臣氏;其他用水为去离子水,其他化学试剂为分析纯。
2 方法与结果 2.1 分析条件 2.1.1 色谱条件Acquity UPLC® HSS T3(100 mm×2.1 mm,1.8 μm)色谱柱;流动相为乙腈-1%甲酸水溶液,梯度洗脱:0~9 min,8%~13%乙腈;9~10.5 min,13%~15%乙腈;10.5~13 min,15%~18%乙腈;13~15 min,18%~22%乙腈;15~17 min,22%~50%乙腈;17~17.5 min,50%~8%乙腈;17.5~21 min,8%乙腈;检测波长:光谱扫描范围200~800 nm,检测波长为280 nm;体积流量0.35 mL/min;柱温35 ℃;进样量3 μL。
2.1.2 质谱条件电离模式ESI−;正极性毛细管电压1.5 kV;负极性毛细管电压0.8 kV;探头温度270 ℃;锥孔电压30 V;采样速率5 Hz;MS扫描范围m/z 100.00~1 100.00。
2.2 溶液配制 2.2.1 混合对照品溶液的制备取原花青素B2 15 mg,置20 mL量瓶,用30%甲醇溶解并稀释至刻度,即得原花青素B2对照品储备液。
分别取表儿茶素、原花青素A2、PC-C约30、25、12 mg,精密称定,置同一100 mL量瓶中,加入原花青素B2对照品储备液2 mL,用30%甲醇溶解并稀释至刻度,即得混合对照品储备液。
精密吸取混合对照品储备液5 mL,置10 mL量瓶,30%甲醇稀释至刻度,摇匀,即得。
2.2.2 供试品溶液的制备取荔枝多酚提取物约100 mg,精密称定,置100 mL量瓶,30%甲醇溶解并定容至刻度,即得。
2.3 方法学考察 2.3.1 线性关系考察取混合对照品贮备液定量稀释制成分别含表儿茶素30、60、90、150、180、240、300 μg/mL,原花青素B2 3、6、9、15、18、24、30 μg/mL,原花青素A2 25、50、75、125、150、200、250 μg/mL,PC-C 12、24、36、60、72、96、120 μg/mL的系列混合对照品溶液,取上述系列溶液,按“2.1”项色谱条件进样分析,以质量浓度(C)为横坐标,峰面积(A)为纵坐标,进行线性回归,分别得各对照品的标准曲线及回归方程L1:A=kC+b。将所得的标准曲线截距校正为0后,得曲线回归方程L2:A=kC。各对照品校正前后曲线回归方程及线性范围见表 2。
|
|
表 2 线性回归方程 Table 2 Linear regression equations |
2.3.2 精密度试验
取批号20140507供试品溶液,在“2.1”项色谱条件下,连续进样6次,结果表儿茶素、原花青素B2、原花青素A2、PC-C的峰面积平均值RSD分别为0.12%、0.37%、0.12%、0.20%。以表儿茶素的保留时间和峰面积为参照,各共有峰的相对保留时间和峰面积RSD均≤2.5%,相似度均为1.0,符合指纹图谱技术要求,表明仪器精密度良好。
2.3.3 稳定性试验取批号20140507供试品溶液,在“2.1”项色谱条件下,在0、4、8、12、18、24 h分别进样测定,结果表儿茶素、原花青素B2、原花青素A2、PC-C的峰面积平均值RSD分别为0.07%、0.74%、0.09%、0.26%。以表儿茶素的保留时间和峰面积为参照,各共有峰的相对保留时间和峰面积RSD均≤2.5%,相似度均为1.0,符合指纹图谱技术要求,表明供试品溶液在24 h内稳定。
2.3.4 重复性试验取批号20140507荔枝多酚提取物6份,按“2.1”项下供试品溶液制备方法处理,在“2.1”项色谱条件下测定,表儿茶素、原花青素B2、原花青素A2、PC-C平均质量分数分别为13.37%、0.86%、10.44%、5.32%,RSD分别为1.12%、1.86%、1.58%、1.33%。以表儿茶素的保留时间和峰面积为参照,各共有峰的相对保留时间和相对峰面积RSD均≤5%,相似度均大于0.990,符合指纹图谱技术要求,表明本法重复性良好。
2.3.5 加样回收率试验取批号20140507荔枝多酚提取物50 mg,置100 mL量瓶中,共6份,分别加入含表儿茶素、原花青素B2、原花青素A2、PC-C对照品各730.9、65.35、537.9、263.0 μg/mL的混合对照品溶液10 mL,按供试品溶液制备方法制备,分别按“2.1”项色谱条件进样分析,计算加样回收率及其RSD,结果表儿茶素、原花青素B2、原花青素A2、PC-C平均加样回收率分别为99.8%、97.9%、100.9%、100.0%,RSD分别为1.16%、0.67%、1.36%、1.18%。表明方法的准确度符合要求。
2.4 指纹图谱研究 2.4.1 指纹图谱共有模式的建立及部分共有峰的指认及定位将22批样品指纹图谱导入国家药典委员会颁布的“中药色谱指纹图谱相似度评价系统软件”(2012.130723版),生成指纹图谱共有模式(对照指纹图谱,R),其中19个色谱峰为共有峰,见图 1。14号峰的分子离子[M-H]− m/z 577.20与Friedrich等[27]报道的B型原花青素二聚体在ESI负离子模式下检测的分子离子质量数一致,推测为B型原花青素二聚体。

|
图 1 22批荔枝多酚提取物UPLC指纹图谱及对照指纹图谱(R) Fig.1 UPLC fingerprint of 22 batches of polyphenol in extracts of Litchi chinensis and reference fingerprint (R) |
12、16和17号峰的分子离子分别为[M-H]− m/z 863.10、[M-H]−m/z 863.20和[M-H]−m/z 863.20,与Gu等[28]报道的ESI负离子模式下A型原花青素三聚体的分子离子质量数一致,比B型原花青素三聚体在ESI负离子模式下的分子离子少了2个质子,推测3个组分均为A型原花青素三聚体。19号峰的分子离子[M-H]− m/z 575.10与Roux等[29]报道的ESI负离子模式下A型原花青素二聚体的分子离子质荷比一致,与B型原花青素二聚体在质谱ESI负离子条件下的分子离子相比,少了2个质子,推测19号峰为A型原花青素二聚体。
根据MS图、UV光谱图(图 2)及相对分子质量初步确定:12、16和17号峰为原花青素A型三聚体,14号峰为B型原花青素二聚体,19号峰为原花青素A型二聚体。通过与混合对照品谱图(图 3)各成分进行比对,指认了19个共有峰中的4个,分别为6号峰(原花青素B2)、8号峰(表儿茶素)、9号峰(PC-C)、15号峰(原花青素A2)。

|
6-原花青素B2 8-表儿茶素9-PC-C 15-原花青素A2 6-procyanidin B2 8-epicatechin 9-PC-C 15-procyanidin A2 图 2 12、14、16、17及19号色谱峰的质谱和UV光谱组合图 Fig.2 MS and UV spectra combination chart of component chromatographic peaks 12, 14, 16, 17, and 19 |

|
6-原花青素B2 8-表儿茶素 9-PC-C 15-原花青素A2 6-procyanidin B2 8-epicatechin 9-PC-C 15-procyanidin A2 图 3 混合对照品HPLC图 Fig.3 HPLC of mixed reference substances |
以表儿茶素为参照峰考察各待测组分,计算各共有指纹峰的保留时间、相对保留时间和相对峰面积,见表 3。22批荔枝多酚提取物部分共有峰保留时间及相对峰面积差异较大,相对保留时间无明显差异,故采用相对保留时间对共有峰进行定位。
|
|
表 3 荔枝UPLC指纹图谱技术参数 Table 3 Technical parameters for UPLC fingerprint of Litchi chinensis |
2.4.2 指纹图谱相似度评价
采用药典委员会“中药色谱指纹图谱相似度评价系统”(2012.130723版)对22批荔枝多酚提取物的指纹图谱进行相似度评价。以批号20140507为参照谱图,以平均数法生成22批荔枝多酚提取物的对照谱图,22批荔枝多酚提取物的相似度分别为0.995、0.996、0.972、0.997、0.977、0.996、0.992、0.987、0.958、0.963、0.975、0.906、0.989、0.988、0.950、0.928、0.985、0.983、0.993、0.920、0.997、0.967。
2.5 QAMS研究采用斜率比值法[30]:通过各对照品校正后曲线的斜率比求得f。f的计算公式为f=kS/kR,式中kS、kR分别为表儿茶素及其他待测组分对照品经校正后的回归方程的斜率(k)。在定量测定时,以单一的表儿茶素作为对照品,计算供试品中表儿茶素的量,其他待测成分量测定公式为Cx=fAxNW/(AS/CS)。式中N、W、Ax和Cx分别为供试品中某待测成分x的稀释倍数、称样量、峰面积和质量浓度,AS和CS分别为供试品中表儿茶素的峰面积及质量浓度。计算内标物表儿茶素对其他待测成分原花青素B2、原花青素A2、PC-C的f,见表 4。
|
|
表 4 f计算结果 Table 4 Calculation results of f |
2.5.1 f耐用性试验
通过改变体积流量、柱温及检测波长,考察f的耐用性。各变动因素及结果见表 5,结果表明,f的耐用性良好,见表 5。
|
|
表 5 f的耐用性试验 Table 5 Robustness test of f |
2.5.2 QAMS与外标法测定结果比较
采用QAMS(以表儿茶素为内标物)计算各待测成分的量,并与外标法测得的供试品中各待测成分的量值进行比较,2种方法测定的结果见表 6。
|
|
表 6 荔枝提取物中4种成分的测定结果 Table 6 Total amounts of four compounds in Litchi chinensis extract |
比较传统外标法的实测值和QAMS的计算值结果,t检验结果表明,2种方法没有差别(P>0.25),说明建立的QAMS对荔枝提取物进行定量测定的结果可靠。
2种方法所得不同部位中4种组分总量见表 6。以QAMS法结果做图,见图 4。未成熟期均比成熟期高,且在花和未成熟叶中最高,核中最低。
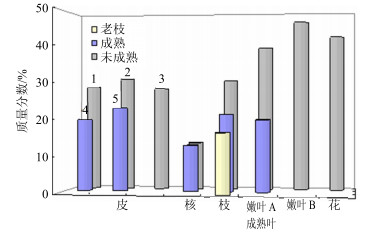
|
1~5分别为荔枝5个成熟期 1-5-Litchi five mature period respectively 图 4 22批荔枝多酚提取物中4种组分总量 Fig.4 Total contents of four components in polyphenol extract of Litchi chinensis |
3 讨论
本实验采用指纹图谱结合QAMS评价模式,考察了22批不同荔枝原材料得到的多酚提取物的稳定性及一致性。通过PAD在线检测,UV光谱显示280 nm为荔枝多酚类成分的特征吸收波长,且出峰较多、丰度较高,故选择280 nm为测定波长。采用QAMS测定荔枝多酚提取物,表儿茶素为荔枝多酚提取物的成分,其量较高、稳定且较其他3个成分易得,故选为内标物;文献多采用平均值法计算校正因子,本实验采用标准曲线斜率比值计算校正因子,避免单个点偏差大造成的误差。
指纹图谱中已知组分采用对照品确认;其他共有峰先根据UV光谱确定为多酚类物质,再结合ESI负离子模式下检测的分子离子质量数和文献报道确认了3个A型原花青素三聚体、1个A型原花青素二聚体和1个B型原花青素二聚体。为进一步考察荔枝多酚类物质提供了参考。
采用QAMS测定22批荔枝多酚提取物4个已知组分量并与外标法比较。2种方法荔枝多酚提取物中4种指标成分量测定值无显著差异。22批荔枝多酚提取物中4种已知成分总量未成熟期均高于成熟期。提取物中多酚以A型原花青素为主;单体主要是表儿茶素,2个采收期嫩叶及花中其量最高。已确定的B型原花青素为原花青素B2,成熟荔枝核中原花青素B2远低于未成熟核及其他部位。核及老枝中4种指标成分总量最低,由于取样少,有待进一步研究,建议暂不作为荔枝多酚的原材料。本实验初步得出已知的4个组分在不同部位的分布、不同生长期其量的变化规律,为荔枝多酚有效成分的收集、研究奠定了基础。
总的来说,22批荔枝原材料多酚提取物特征指纹图谱相似度大于0.90,按指纹图谱相似度评价标准,整体上成分结构一致。但是采收期不同、产地不同及部位不同导致各指标成分量不同。荔枝核及老枝除外,其他19批中表儿茶素、原花青素B2、原花青素A2和PC-C的量分别为7.73%~30.77%、0.43%~1.40%、6.36%~11.43%和2.26%~5.41%。故暂定荔枝多酚提取物中表儿茶素、原花青素B2、原花青素A2和PC-C的量应分别不低于5.0%、0.5%、5.0%和3.0%,4个成分总量不低于20.0%。指纹图谱结合QAMS测定单个组分的量解决了对照品难以获得或不稳定的难题,并保证了荔枝提取物的稳定性及一致性。2014年广东荔枝产量124万吨,预计在2020年总产量达150万吨以上,2015年75%在省内鲜销[31]。大量被废弃的荔枝果皮和果核、成熟过程中的生理落果、枝和叶等的综合应用可扩大多酚的来源。除多酚类成分以外,荔枝原材料中还有黄酮、皂苷等组分。其他成分的进一步开发研究更是达到了变废为宝、物尽其用的效果。
| [1] | 尤春雪, 张振秋, 李峰, 等. HPLC波长切换技术对葛根中8种成分的测定及指纹图谱研究[J]. 中草药, 2013, 44(5):616–621. |
| [2] | 马鸿雁, 周婉珊, 褚夫江, 等. 苦参中黄酮类成分的高效液相指纹图谱及5种成分的含量测定[J]. 中国中药杂志, 2013, 38(16):2690–2695. |
| [3] | 黄洋, 邵慧凯, 路丽, 等. 不同采收期小叶榕叶HPLC指纹图谱研究[J]. 中草药, 2014, 45(2):271–275. |
| [4] | 陆兔林, 石上梅, 蔡宝昌, 等. 基于一测多评的中药多成分定量研究进展[J]. 中草药, 2012, 43(12):2525–2529. |
| [5] | 田璐, 闫海霞, 傅欣彤, 等. 一测多评法同时测定川芎、当归饮片中多种化学成分的含量[J]. 药物分析杂志, 2014, 34(5):848–854. |
| [6] | 何兵, 刘艳, 杨世艳, 等. 一测多评同时测定款冬花中10个成分的含量[J]. 药物分析杂志, 2013, 33(9):1518–1524. |
| [7] | 卿大双, 罗维早, 孙建彬, 等. 一测多评法测定黄连及其炮制品中6种生物碱[J]. 中草药, 2016, 47(2):324–329. |
| [8] | 朱春胜.基于谱效关系的菊苣降尿酸物质基础及质量评价研究[D].北京:北京中医药大学, 2016. |
| [9] | 张婷, 郑夺, 王文彤, 等. 指纹图谱结合一测多评模式在参芎养心颗粒质量评价中的应用研究[J]. 中草药, 2015, 46(13):1920–1925. |
| [10] | Stavrianidi A, Stekolshchikova E, Porotova A, et al. Combination of HPLC-MS and QAMS as a new analytical approach for determination of saponins in ginseng containing products[J]. J Pharmaceut Biomed, 2017, 132(5): 87–92. |
| [11] | Li D W, Zhu M, Shao Y D, et al. Determination and quality evaluation of green tea extracts through qualitative and quantitative analysis of multi-components by single marker (QAMS)[J]. Food Chem, 2016, 197(B): 1112–1120. |
| [12] | 汪金莲, 邱业先, 扶教龙, 等. 茶多酚对稻瘟病菌的抑制作用及抑菌机理[J]. 天然产物研究与开发, 2011, 23(5):918–922. |
| [13] | 李楠.海棠多酚的种类及其体外抗氧化活性和抑菌活性研究[D].咸阳:西北农林科技大学, 2014. |
| [14] | 刘忠义, 彭丽, 包浩, 等. 籽瓜皮多酚的提取及其抑菌作用研究[J]. 天然产物研究与开发, 2015, 27(1):173–178. |
| [15] | 王立峰, 陈静宜, 谢慧慧, 等. 薏米多酚细胞抗氧化及HepG2细胞毒性和抗增殖作用[J]. 中国农业科学, 2013, 46(14):2990–3002. |
| [16] | 卢晓霆, 许中畅, 王田田, 等. 玉米多孔淀粉-海藻酸钠-壳聚糖-葡萄多酚缓释微胶囊的制备及表征[J]. 中草药, 2016, 47(13):2252–2259. |
| [17] | 冯亮, 汪燕, 潘小玲. 茶多酚对酒精性肝损伤大鼠的抗炎抗氧化保护作用[J]. 中国药业, 2015(22):37–39. |
| [18] | 游庭活.桑椹多酚类化合物抗氧化及延缓衰老作用研究[D].广州:广东药学院, 2015. |
| [19] | 张如楠, 吴冬梅, 杨留勤. 茶多酚对食管癌Eca-109细胞生长的影响[J]. 现代肿瘤医学, 2015, 23(19):2727–2729. |
| [20] | 王驰, 陈鸿雁, 叶琳, 等. 茶多酚与抗肿瘤药物联合作用对人鼻咽癌耐药细胞株HNE-1增殖抑制的影响[J]. 中国药房, 2009, 20(1):33–35. |
| [21] | 李红月, 陈超. 香椿子总多酚对心肌缺血再灌注大鼠的保护作用[J]. 中国实验方剂学杂志, 2011, 17(1):117–119. |
| [22] | 王美菊, 陶明煊, 牛文颖, 等. 石榴叶多酚对急性酒精性肝损伤小鼠肾脏、心脏及免疫器官的抗氧化作用[J]. 食品科学, 2016, 37(1):208–212. |
| [23] | 董淑英, 童旭辉, 刘浩, 等. 石榴多酚对大鼠心肌缺血-再灌注损伤后心肌细胞凋亡的影响[J]. 中药材, 2012, 35(11):1824–1828. |
| [24] | 吕昕泽, 吴秀祯, 张卫. 葡萄多酚对心肌保护作用研究进展[J]. 药物评价研究, 2012, 35(1):46–52. |
| [25] | 佟屏亚. 果树史话[M]. 北京: 农业出版社, 1983. |
| [26] | 李焕清, 邓红, 张蜀, 等. 响应面法优化荔枝皮原花青素的提取工艺[J]. 广东农业科学, 2015, 42(9):93–98. |
| [27] | Friedrich W, Eberhardt A, Galensa R. Investigation of proanthocyanidins by HPLC with electrospray ionization mass spectrometry[J]. Eur Food Res Technol, 2000, 211(1): 56–64. DOI:10.1007/s002170050589 |
| [28] | Gu L W, Kelm M A, Hammerstone J F, et al. Liquid chromatographic/electrospray ionization mass spectrometric studies of proanthocyanidins in foods[J]. J Mass Spectrom, 2003, 38(12): 1272–1280. DOI:10.1002/(ISSN)1096-9888 |
| [29] | Le Roux E, Doco T, Sarni-Manchado P, et al. A-type proanthocyanidins from pericarp of Litchi chinensis[J]. Phytochemistry, 1998, 48(7): 1251–1258. DOI:10.1016/S0031-9422(97)01070-4 |
| [30] | 何兵, 杨世艳, 张燕. 一测多评中待测成分校正和定位的新方法研究[J]. 药学学报, 2012, 47(12):1653–1659. |
| [31] | 余华荣, 周灿芳, 万忠, 等. 2015年广东荔枝产业发展形势与对策建议[J]. 广东农业科学, 2016, 43(4):21–24. |
 2017, Vol. 48
2017, Vol. 48


