八仙花Hydrangea macrophylla (Thunb.) Ser. 又名绣球花、紫阳花,为虎耳草科(Saxifragaceae)绣球属Hydrangea Linn. 植物。八仙花为落叶灌木,枝粗壮,叶近革质大而稍厚,边缘有粗锯齿,叶面鲜绿色,叶背黄绿色。花丰满密集,为粉红色、淡蓝色或白色。八仙花产于我国长江以南各省区,民间常用其全草治疗痢疾、心热惊悸等疾病,现代药理及临床研究表明八仙花叶具有很好的抗疟、抗过敏﹑调血脂、降血糖[1]等作用。因此对八仙花叶中所含的化学成分进行系统的研究,有利于进一步探究其生物活性。本实验对八仙花叶的化学成分进行了较为系统的研究,从其正丁醇部分分离得到11个环烯醚萜类化合物,分别鉴定为断马钱子苷乙基甲基缩醛(secologanin ethyl methyl acetal,1)、断马钱子苷二甲基缩醛(secologanin dimethyl acetal,2)、断氧化马钱子苷(secoxyloganin,3)、7-去氧马钱子酸(7-deoxyloganic acid,4)、马钱子酸(loganic acid,5)、8-表马钱子苷(8-epi-loganin,6)、马钱子苷(loganin,7)、7-脱氢马钱子苷(7-dehydrologanin,8)、獐牙菜苷(sweroside,9)、表断马钱子苷半缩醛内酯(epi-vogeloside, 10)、断马钱子苷半缩醛内酯(vogeloside,11)。其中化合物1为新化合物,命名为八仙花叶苷。化合物3、8为八仙花属植物中首次分离得到。
1 仪器与材料JNM-ECA600型核磁共振仪(TMS为内标,日本电子株式会社,日本);Waters 2535制备型高效液相色谱仪、Waters 2414型视差检测器(沃特斯公司,美国);薄层色谱和柱色谱硅胶(青岛海洋化工厂产品);反相ODS(Fuji Silysia Chemical有限公司,日本);高效液相色谱所用试剂为色谱级,其他试剂均为分析纯。
八仙花叶于2013年9月采集于中国四川省石柱县,由黑龙江中医药大学王振月教授鉴定为八仙花Hydrangea macrophylla (Thunb.) Ser. 的叶。样本(HLJZYY-100905)保存于黑龙江中医药大学中药化学教研室。
2 提取与分离八仙花的干燥叶2.0 kg经甲醇提取3次,每次3 h,合并提取液,浓缩干燥得甲醇提取物452.3 g。将甲醇提取物加水悬浮,依次以等体积醋酸乙酯和正丁醇萃取3次,减压回收溶剂,得正丁醇提取物125.5 g。正丁醇提取物经硅胶柱色谱,氯仿-甲醇-水(15∶3∶1→甲醇)梯度洗脱,得到6个组分Fr. 1~6。Fr. 2经中压ODS柱色谱,甲醇-水(10∶90→70∶30)梯度洗脱,得到5个组分Fr. 2-1~2-5。Fr. 2-3经制备型HPLC,甲醇-水(40∶60)等度洗脱,得到化合物8(21.8 mg)。Fr. 2-4经制备型HPLC,乙腈-水(15∶85)等度洗脱得化合物1(17.2 mg)和10(15.1 mg)。Fr. 2-5经制备型HPLC,甲醇-水(45∶55)等度洗脱,得到化合物11(23.3 mg)。Fr. 3组分经中压ODS柱色谱,甲醇-水(10∶90→70∶30)梯度洗脱,得到3个组分Fr. 3-1~3-3,Fr. 3-3经制备型HPLC,甲醇-水(12∶88)等度洗脱得化合物9(7.1 mg)。Fr. 4经中压ODS柱色谱,甲醇-水(10∶90→70∶30)梯度洗脱,得到7个组分Fr. 4-1~4-7,Fr. 4-3经制备型HPLC,乙腈-水(10∶90)等度洗脱得化合物2(238.2 mg)和7(99.2 mg)。Fr. 4-4经制备型HPLC,以甲醇-水(35∶ 65)等度洗脱得化合物3(17.2 mg)和6(10.3 mg)。Fr. 5经中压ODS柱色谱,甲醇-水(10∶90→70∶30)梯度洗脱,得到5个组分Fr. 5-1~5-5,Fr. 5-3经制备型HPLC,甲醇-水(25∶75)等度洗脱得到化合物4(1.8 g)、5(51.2 mg)。
3 结构鉴定化合物1:白色粉末,[α]D23−113.1° (c 0.15,甲醇),HR-FAB-MS m/z: 471.188 9 [M+Na]+(C20H31O11Na+,计算值471.189 7)。UVλmaxMeOH(nm):233;IR vmaxKBr(cm-1): 3 408,1 708,1 631,1 287,1 074 处的吸收峰提示该结构中存在羟基、羰基、醚键等。
化合物1的1H-NMR (600 MHz,CD3OD) 谱中 δH 7.41 (1H,s) 是环烯醚萜3-H特征信号,且C4有COOR取代基;δH 5.49 (d,J = 4.8 Hz) 是环烯醚萜1位缩醛质子信号;δH 5.31 (1H,dd,J = 17.6,1.4 Hz) 和5.26 (1H,dd,J = 10.3,1.4 Hz) 是末端双键的质子信号;δH4.66 (d,J = 7.6 Hz) 为糖端基质子信号。13C-NMR谱中可见20个碳信号,其中羰基碳信号为δC169.2;2个烯碳信号为δC 135.9,119.8;δC 153.2为环烯醚萜类化合物3位连氧烯碳信号;1位和7位2个双连氧碳信号为δC 97.9,103.5;1分子糖的碳信号为δC100.6,74.6,78.1,71.5,78.5,62.7。据1H-NMR和3C-NMR可以初步推测出分子中含有1分子葡萄糖,13C-NMR谱数据见表 1。
|
|
表 1 化合物1~11的13C-NMR数据 (150 MHz,CD3OD) Table 1 13C-NMR data of compounds 1~11 (150 MHz,CD3OD |
化合物1用1 mol/L盐酸水解,水液经处理并用HPLC分析,旋光检测器检测,鉴定为D-葡萄糖,由端基质子的偶合常数 (J = 7.6 Hz) 可知糖的端基为β构型。
通过HMQC谱确定氢和碳的直接连接情况。在DQF COSY谱中,δH4.56和δH 2.09、1.62相关,δH2.92与δH 2.09、1.62和2.67相关,δH2.67和δH 5.73相关,δH 5.73与δH 5.31、5.26相关,可以确定骨架中C-7、6、5、9和10的连接方式;δH 1.17和δH 3.73、3.61相关,可以确定C-2″和C-3″相连。通过HMBC谱可知,δH 7.41与δC 169.2、97.9相关,δH 2.92与δC 153.2、97.9相关,δH 2.67与δC 111.8、97.9相关,由此可确定苷元上六元环的结构。δH 4.66与δC 97.9相关,说明β-D-葡萄糖连接在C-1位。δH 5.31、5.26和δC45.4相关,δH 5.73与δC 29.4相关,说明末端 双 键连接在C-9位。δH 4.56与δC 29.4相关,δH2.09、1.62与δC 3.28相关,说明C-6和C-7的结构片段连接在C-5位。δH 3.28、3.73和3.61与δC 103.5相关,可确定-OCH3和-CH2CH3连接在C-7位。由此可推断出化合物1的结构,关键的DQF COSY和HMBC见图 1。
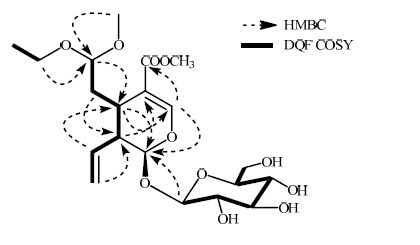
|
图 1 化合物1主要的HMBC和DQF COSY相关 Fig.1 Key HMBC and DQF COSY correlations of compound 1 |
NOSEY谱中显示,H-7与H-5、H-9存在NOE相关,说H-5、H-9处在在同一平面上。同时,H-1与H-6相关,H-6与H-8相关,而H-6与H-9不相关,推测1位的H为α构型,5位和9位的H为β构型。NOSEY谱中没有观察到与7位碳连的甲氧基和乙氧基的相关峰,所以不能确定7位碳的构型。
通过对比化合物1和断马钱子苷二甲基缩醛[2] (化合物2)的核磁数据可以判断,化合物1仅比化合物2缺少1个OCH3信号,多1个OCH2CH3信号。综合分析,化合物1的化学结构被确定为断马钱子苷乙基甲基缩醛(图 2),经检索为新化合物。
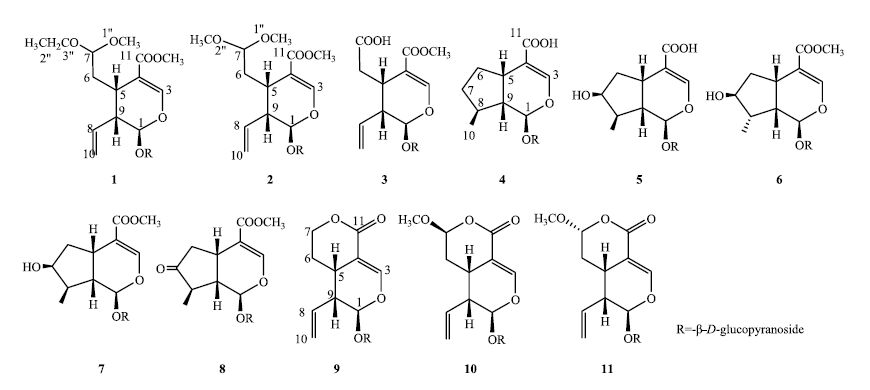
|
图 2 化合物1~11的结构 Fig.2 Structures of compounds 1—11 |
化合物1的1H-NMR谱数据为δ: 5.49 (1H,d,J = 4.8 Hz,H-1),7.41 (1H,s,H-3),2.92 (1H,ddd,J = 8.3,6.9,6.8 Hz,H-5),2.09 (1H,ddd,J = 13.7,6.9,6.8 Hz,H-6a),1.62 (1H,ddd,J = 13.7,8.3,4.2 Hz,H-6b),4.56 (1H,dd,J = 6.8,4.2 Hz,H-7),5.73 (1H,ddd,J = 17.6,10.3,8.9 Hz,H-8),2.67 (1H,ddd,J = 8.9,6.8,4.8 Hz,H-9),5.31 (1H,dd,J = 17.6,1.4 Hz,H-10a),5.26 (1H,dd,J = 10.3,1.4 Hz,H-10b) 3.69 (3H,s,H-OCH3),4.66 (1H,d,J = 7.6 Hz,H-1′),3.18 (1H,dd,J = 8.9,7.6 Hz,H-2′),3.35 (1H,dd,J = 9.6,8.9 Hz,H-3′),3.27 (1H,dd,J = 9.6,8.9 Hz,H-4′),3.29 (1H,overlapped,H-5′),3.89 (1H,dd,J = 11.7,2.1 Hz,H-6′a),3.66 (1H,dd,J = 11.7,5.5 Hz,H-6′b),3.28 (3H,s,H-1″),1.17 (3H,t,J = 7.6,6.9 Hz,H-2″),3.73 (1H,m,H-3″a),3.61 (1H,m,H-3″b)。
化合物2:白色粉末,FAB-MS: m/z 457 [M+Na]+。1H-NMR (600 MHz,CD3OD) δ: 5.50 (1H,d,J = 5.5 Hz,H-1),7.42 (1H,s,H-3),2.91 (1H,ddd,J = 8.3,6.9,6.8 Hz,H-5),2.06 (1H,ddd,J = 13.7,6.9,6.8 Hz,H-6a),1.63 (1H,ddd,J = 13.7,8.3,4.1 Hz,H-6b),4.69 (1H,dd,J = 6.8,4.1 Hz,H-7),5.72 (1H,ddd,J = 17.6,10.3,8.9 Hz,H-8),2.67 (1H,ddd,J = 8.9,6.8,5.5 Hz,H-9),5.30 (1H,dd,J = 17.6,1.4 Hz,H-10a),5.26 (1H,dd,J = 10.3,1.4 Hz,H-10b),3.69 (3H,s,OCH3),4.67 (1H,d,J = 7.6 Hz,H-1′),3.19 (1H,dd,J = 8.9,7.6 Hz,H-2′),3.35 (1H,dd,J = 9.6,8.9 Hz,H-3′),3.27 (1H,dd,J = 9.6,8.9 Hz,H-4′),3.89 (1H,dd,J = 11.7,1.8 Hz,H-6′a),3.66 (1H,dd,J = 11.7,6.2 Hz,H-6′b),3.26 (3H,s,H-1″),3.29 (3H,s,H-2″)。13C-NMR谱数据见表 1。以上数据与文献报道一致[2],故鉴定化合物2为断马钱子苷二甲基缩醛。
将化合物的核磁和质谱数据与已知文献中的数据对比,将化合物3~11分别鉴定为断氧化马钱子苷[3]、7-去氧马钱子酸[4]、马钱子酸[5]、8-表马钱子苷[6]、马钱子苷[7]、7-脱氢马钱子苷[8]、獐牙菜苷[9]、表断马钱子苷半缩醛内酯[10]和断马钱子苷半缩醛内酯[11],13C-NMR谱数据见表 1。
| [1] | Ishih A, Nagata T, Kobayashi F, et al. Cytokine and antibody production during the course of resolution in Plasmodium yoelii 17XL-infected BALB/c mice treated with febrifugine and isofebrifugine mixture from leaves of Hydrangea macrophylla var. otaksa[J]. Parasitol Res, 2004, 94(3): 176–182. DOI:10.1007/s00436-004-1187-4 |
| [2] | Kakuda R, Imai M, Yaoita Y, et al. Secoiridoid glycosides from the flower buds of Lonicera japonica[J]. Phytochemistry, 2000, 55(8): 879–881. DOI:10.1016/S0031-9422(00)00279-X |
| [3] | Calis I, Sticher O. Secoiridoid glucosides from Lonicera periclymenum[J]. Phytochemistry, 1984, 23(11): 2539–2540. DOI:10.1016/S0031-9422(00)84094-7 |
| [4] | Teng R W, Wang D Z, Wu Y S, et al. NMR assignments and single-crystal X-ray diffraction analysis of deoxyloganic acid[J]. Magn Reson Chem, 2005, 43(1): 92–96. DOI:10.1002/(ISSN)1097-458X |
| [5] | Yang X L, Jiang M Y, Hsieh K L, et al. Chemical constituents from the seeds of Morinda citrifolia[J]. Chin J Nat Med, 2009, 7(2): 119–122. DOI:10.3724/SP.J.1009.2009.00119 |
| [6] | Háznagy-Radnai E, Wéber E, Czigle S, et al. Identification of iridoids, flavonoids and triterpenes from the methanolic extract of Melampyrum bihariense A. Kern. and the antioxidant activity of the extract[J]. Chromatographia, 2014, 77(17): 1153–1159. |
| [7] | 朱伟明, 何红平, 王跃虎, 等. 药用植物盆架树中的马钱子苷及其衍生物[J]. 植物分类与资源学报, 2004, 26(6):683–686. |
| [8] | Gross G A, Sticher O, Anklin C, et al. Ein neues esteriridoidglycosid aus Sambucus ebulus L. (Caprifoliaceae). 1. Mitteillung uber die inhaltsstoffe der zwergholunderwurze[J]. Helve Chim Acta, 1986, 69(1): 156–162. DOI:10.1002/hlca.v69:1 |
| [9] | 李雨蔚, 李荣娇, 袁绿益, 等. 西藏秦艽花的化学成分研究[J]. 中草药, 2015, 46(14):2052–2056. |
| [10] | Chai X, Su Y F, Yan S L, et al. Chemical constituents of the toots of Triosteum pinnatifidum[J]. Chem Nat Compd, 2014, 50(6): 1149–1152. |
| [11] | 李畅, 戴毅, 张金博, 等. 金银花中1个新的环烯醚萜苷类化合物[J]. 中草药, 2013, 44(21):2951–2954. |
 2017, Vol. 48
2017, Vol. 48


