2. 益阳医学高等专科学校解剖教研室, 湖南益阳 413000;
3. 湖南中医药大学中西医结合学院, 湖南长沙 410208;
4. 邵阳医学高等专科学校解剖教研室, 湖南邵阳 422000
2. Department of Anatomy, Yiyang Medical College, Yiyang 413000, China;
3. Department of Integrated Traditional and Western Medicine, Hunan University of Traditional Chinese Medicine, Changsha 410208, China;
4. Department of Anatomy, Shaoyang Medical College, Shaoyang 422000, China
侧脑室的室管膜下层(Subventricular zone,SVZ)是神经再生的主要区域之一,当受到脑缺血等外界病理性刺激时,SVZ区神经再生能力大大增强,所产生的新生神经元可迁移到受损皮质参与修复和构建新的突触联系。脑缺血后这种通过神经元替代的自我修复方式可促进某种程度的恢复,但是内源性神经干细胞神经再生能力有限,产生的新生神经元数量难以完全替代丢失的细胞。例如在局灶性脑缺血模型中,新生的神经元只能替代纹状体0.2%凋亡神经元[1]。因此寻找一种可靠药物或者其他治疗方案来放大或者加速脑自身神经干细胞的增殖、分化、迁移、成熟和存活,对开展全脑缺血后的恢复性治疗有着重要意义。
三七是我国名贵中药材,又称田七、参三七,为五加科植物三七Panax notoginseng (Burk.) F. H. Chen的干燥根和根茎。三七总皂苷(total saponins of Panax notoginseng,TSPN)是三七的主要活性成分[2],一项多中心临床研究证实TSPN治疗脑梗死安全而有效[3]。前期研究发现剂量为75 mg/kg的TSPN可促进全脑缺血后大鼠嗅球新生的未成熟神经元的神经发生[4]。TSPN也可抑制缺氧复氧后大脑皮层神经元凋亡[5],发挥神经保护作用[6]。体外实验表明TSPN可调节大鼠海马神经干细胞的增殖和分化,提高分化为神经元的比例[7]。然而目前国内外关于TSPN是否能促进大鼠全脑缺血后SVZ区的神经再生鲜有报道,因此本研究通过四血管阻断法建立全脑缺血模型,观察全脑缺血后TSPN对SVZ区神经再生的影响,探讨TSPN在全脑缺血中的神经保护作用及其相关机制。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠,体质量250~290 g,8周龄,由中南大学湘雅医学院实验动物中心提供,合格证号SCXK(湘)2009-0012。所有动物适应环境5 d后开始实验,模型制作过程中尽可能减少动物的痛苦和动物使用的数,整个实验程序都通过中南大学伦理委员会的批准。
1.2 仪器、药品与试剂Kopf脑立体定位仪(David KOPF Instruments公司);珊顿冰冻切片机(Shan Don公司);GX.SS.22-3手术显微镜(上海医疗器械股份有限公司);Olympus BX67荧光显微镜(奥林巴斯);TSPN(HPLC测得总皂苷质量分数≥98%,四川成都麦卡希化工有限公司,批号12052901);BrdU生化试剂(Sigma公司);微管相关蛋白Doublecortin(DCX)羊抗(Santa Cruz Biotechnology公司);BrdU抗体(Serotec公司);Ki67(Vector公司)、胶质纤维酸性蛋白(GFAP,Sigma-Aldrich公司)。
2 方法 2.1 实验分组、全脑缺血模型的制备及给药大鼠随机分成假手术组、模型组和TSPN组。通过四动脉血管阻断法建立全脑缺血模型[4, 8]:大鼠ip 1%戊巴比妥钠(50 mg/kg)麻醉,仰卧固定于Kopf脑立体定位仪台面;钝性分离两侧颈总动脉;俯卧位,电凝两侧椎动脉;过夜,乙醚吸入麻醉,外科缝线拉出颈总动脉,微动脉夹阻塞血管30 min。模型制作过程中,维持直肠温度和大鼠体温在(37.0±0.5)℃。假手术组组只分离两侧血管,不夹闭动脉。模型组在脑缺血后30 min ip等体积生理盐水,每天1次,TSPN组ip给予大鼠75 mg/kg的TSPN[9],每天1次,连续14 d。模型组和TSPN组分别于再灌注1、3、7、14 d给药1 h后大鼠ip给予BrdU(50 mg/kg,终质量浓度为50 mg/mL),连续注射3次,每次间隔8 h。假手术组行假手术后以相同方式注射BrdU。模型组和TSPN组在再灌注1、3、7、14 d分别处死5只大鼠,假手术组在全脑缺血后14 d处死大鼠作为参照。
2.2 组织处理及染色深度麻醉大鼠,灌注取出脑组织,4 ℃固定过夜,梯度沉糖,以防冰晶出现。恒低温冰冻切片机进行冠状位切片。采用邻切法切片,首先按顺序切12张(1套)30 μm切片放入组织培养板中,然后切12张(1套)6 μm切片贴在镀阳离子玻片上,接着弃取12×30 μm切片,然后再收集下一轮脑片。
2.2.1 免疫组织化学染色采用ABC-DAB免疫组织化学方法染色。DCX的实验步骤:脑片以3% H2O2处理30 min以消除内源性过氧化物酶;5%马血清+0.1% tritonX-100磷酸缓冲液孵育2 h;加入山羊抗DCX(1:1 000),4 ℃孵育过夜;经广谱生物素化二抗(1:400)处理,反应1 h后在提前30 min配好的ABC溶液孵育2 h,免疫反应产物经DAB显色。BrdU的实验步骤:甲醇-30% H2O2-磷酸钠缓冲溶液(7:1:2)处理脑片15 min;放入50%甲酰胺和柠檬酸钠(pH值6.0)液体中,65 ℃水浴进行抗原修复1 h,50%甲酰胺与柠檬酸钠的比例为1:1;室温2 mol/L HCl处理组织30 min;0.01 mol/L Tris-HCl反应10 min;5%山羊血清+0.1% tritonX-100孵育2 h;加入大鼠抗BrdU(1:2 000)4 ℃孵育过夜;经生物素化山羊抗大鼠IgG二抗(1:400)处理;反应1 h后在提前30 min配好的ABC溶液孵育2 h,免疫反应产物经DAB显色。阴性对照:用正常马血清代替一抗,以排除二抗的非特异性染色,结果为阴性。
2.2.2 免疫荧光双标染色法选取6 μm切片染色。5%驴血清+0.1% tritonX-100磷酸盐缓冲液室温孵育2 h,以抑制非特异性抗体结合;将脑片与以下2组抗体孵育:山羊抗DCX(1:1 000)与兔抗GFAP(1:2 000)、山羊抗DCX(1:1 000)与兔抗Ki67(1:1 000)。大鼠抗BrdU(1:1 000)与山羊抗DCX(1:1 000)的共表达实验需经过以下处理:将脑片挑入装有50%甲酰胺和1×柠檬酸钠(pH=6.0)的1 mL EP管中,放入65 ℃水浴1 h进行抗原修复(甲酰胺-柠檬酸钠1:1);室温2 mol/L HCl处理组织30 min;0.01 mol/L Tris-HCl反应10 min;5%驴血清+0.1% tritonX-100孵育2 h;加入一抗过夜。Alexa Fluor 488与Alexa Fluor 594偶联驴抗大鼠、驴抗兔及驴抗山羊IgG(1:200)室温孵育2 h;双苯酰亚胺(Bisbenzimide,1:5 000)染核,10 min;贴片,50%甘油封片。
2.3 成像和统计学分析免疫组织化学片子在目镜(×10)下拍照,每套组化片子取相同的部位进行细胞计数,取均值。考虑到侧脑室的DCX聚集成团状,采用NIH Image J测量平均光密度值。免疫荧光双标图片分析:选用一套6 μm厚度的SVZ区的脑片,每个动物挑选4张片子,图像在目镜(×20)下拍照。每张片子拍照4个视野,记录每张片子4个视野总细胞数目和共表达细胞的数目,然后统计4张脑片的细胞数量(1只大鼠的细胞数量总和),每个时间点挑选5只大鼠,计算各个时间点各类细胞总数量。数据以x±s表示,采用统计学软件Prism GraphPad 5.0进行统计分析,通过双因素方差分析或者配对t检验比较组间差异。
3 结果 3.1 对SVZ区DCX和BrdU阳性细胞表达的影响全脑缺血后SVZ区DCX阳性细胞(DCX+,呈深棕色团状)和BrdU阳性细胞(BrdU+,呈棕黄色颗粒状)密集,尤其在SVZ区后角大量的DCX+细胞聚集成团状。见图 1。用平均光密度值来测量DCX的免疫阳性产物,阳性产物越高,平均光密度值也越高。与假手术组比较,模型组DCX+和BrdU+细胞大量增加,给予TSPN干预后,这2种细胞增加更为显著(P<0.05),见图 1。与模型组比较,TSPN组DCX+的平均光密度值在7、14 d显著升高(P<0.001)。
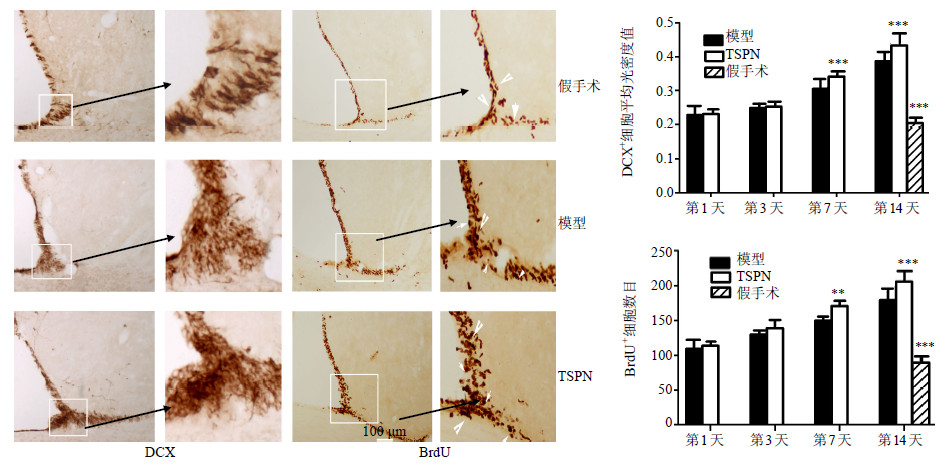 |
与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下同 *P < 0.05 **P < 0.01 ***P < 0.001 vs model group,same as below 图 1 TSPN对全脑缺血后大鼠SVZ区DCX+和BrdU+细胞表达的影响 (x±s,n = 5) Fig.1 Effectof TSPN on expression of DCX+ and BrdU+ cells in SVZ of rats with global cerebral ischemia injury (x±s,n = 5) |
从“3.1”项结果可知,与1、3、7 d相比,模型组与TSPN组大鼠SVZ区14 d时BrdU+细胞表达最多。考虑到BrdU是外源性细胞增殖标记物,因此探讨SVZ区神经祖细胞增殖和转化未成熟神经元的情况。实验结果显示TSPN组在14 d时BrdU/DCX共表达的细胞数量明显高于模型组(P<0.01)。见图 2。
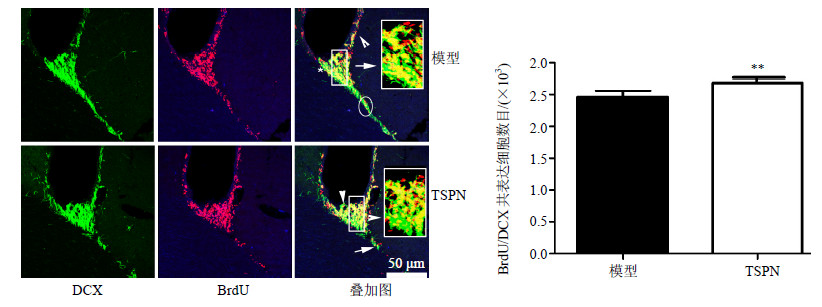 | 图 2 TSPN对全脑缺血后大鼠SVZ区BrdU与DCX共表达的影响 (x±s,n = 5) Fig.2 Effects of TSPN on BrdU/DCX co-labeled cells in SVZ of rats with global cerebral ischemia injury (x±s,n = 5) |
全脑缺血后SVZ区大量的Ki67分裂成与DCX共表达。TSPN组这种共表达现象更加明显,并且沿着侧脑室的下角成线状迁移到纹状体。在再灌注7、14 d,TSPN组与模型组SVZ区Ki67与DCX的共表达细胞差异显著(P<0.05、0.001),且TSPN组Ki67与DCX细胞数量增加较模型组更快。见图 3。
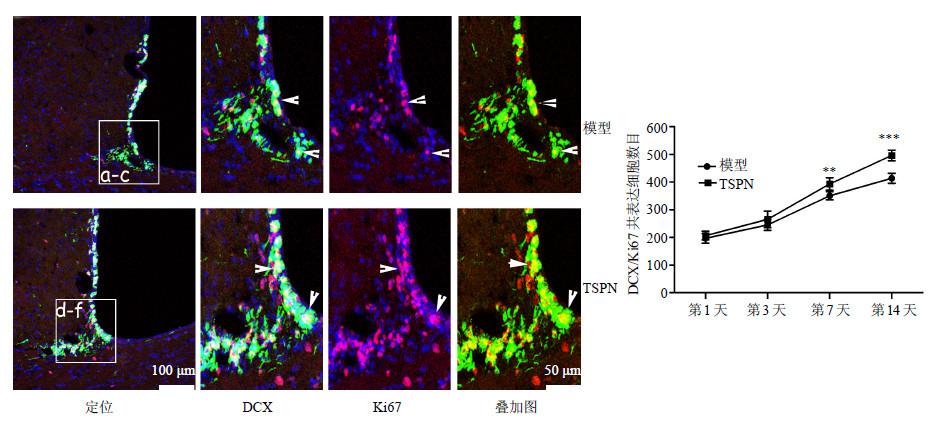 | 图 3 TSPN对全脑缺血后大鼠SVZ区Ki67与DCX共表达影响 (x±s,n = 5) Fig.3 Effect of TSPN on Ki67/DCX co-labeled cells in SVZ of rats with global cerebral ischemia injury (x±s,n = 5) |
先统计模型组和TSPN组各个时间点(1、3、7、14 d)GFAP/DCX共表达细胞的数目,再统计2组相应时间点DCX阳性表达的数目,以GFAP/DCX共表达的细胞数目与DCX阳性表达细胞数目的比值代表神经干细胞的分化。2组全脑缺血大鼠SVZ区GFAP与DCX的共表达主要位于胞浆,呈“小环形”,见图 4。TSPN组与模型组比较,SVZ区GFAP/DCX共表达细胞数目与DCX阳性表达细胞数目比值在再灌注后3、7、14 d显著提高(P<0.05、0.001),见图 5。
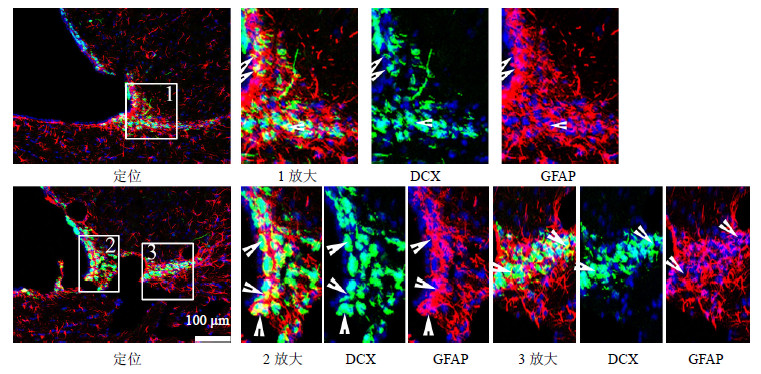 | 图 4 全脑缺血后14 d大鼠SVZ区GFAP/DCX共表达免疫荧光图 Fig.4 Representative immunofluorescent pictures of GFAP/DCX expression in SVZ of rats with global cerebral ischemia injury |
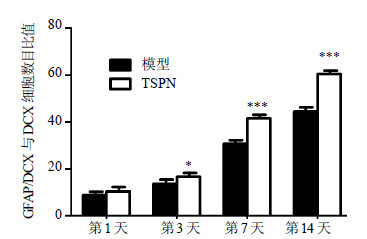 | 图 5 TSPN对全脑缺血后大鼠SVZ区GFAP/DCX共表达细胞数目与DCX阳性表达细胞数目比值的影响 (x±s,n = 5) Fig.5 Effect of TSPN on ratio of GFAP-labeled cells co-expressing DCX to DCX in SVZ of rats with global cerebral ischemia injury (x±s,n = 5) |
当前经典的检测成年神经再生方法是注入BrdU渗入分裂细胞的DNA合成期的S期并进行标记,同时观察BrdU标记的阳性细胞与成熟神经元标记物的共表达情况。但考虑到BrdU有一定神经细胞毒性,抑制了部分神经组细胞的增殖分化,同时BrdU的注射常在活体,不适合用来标记人类神经祖细胞的有丝分裂[10]。DCX是一种微管蛋白,相对分子质量为40 000,是未成熟神经元和神经再生的标记物[11, 12],参与神经突的外生和突触发生[13]。因此,目前研究神经再生常联用这2种方法。
4.1 TSPN促进全脑缺血后大鼠SVZ区神经再生本实验结果表明SVZ区BrdU+细胞数目在第2周达到峰值,这与先前报道一致[14]。给予TSPN治疗后,全脑缺血后SVZ区BrdU+细胞显著增加。这表明TSPN可促进全脑缺血后SVZ区神经祖细胞发生增殖,产生更多的新生神经元。在成年神经再生过程中,DCX的表达开始于神经祖细胞的产生,在第2周神经元的表达达到高峰,随后随着成熟神经元NeuN的出现,DCX的表达开始下调[14]。DCX的免疫组织化学结果显示全脑缺血后SVZ区DCX的表达在14 d最多,而给予TSPN治疗,可显著促进大鼠SVZ区DCX的表达,并且迁移到纹状体。这说明TSPN可加速SVZ区神经元迁移到脑缺血区域,并且这些未成熟和迁移神经元被整合到神经网络,参与大脑的修复且在迁移过程中保持细胞分裂的能力[15, 16, 17]。
4.2 TSPN加速SVZ区细胞增殖和分化Ki67是一种核蛋白质,参与调控细胞的有丝分裂,在细胞增殖G1、S、G2和M期中均有表达,可作为标记细胞处于增殖状态的一个标记物。由于Ki67的半衰期为1 h,所以在细胞静止期(G0)不表达。全脑缺血后2组大鼠SVZ区1、3、7、14 d DCX与Ki67均有表达,SVZ在脑缺血14 d共表达的细胞最多。这说明全脑缺血后SVZ区新生的未成熟神经元中有部分处于增殖状态,并且TSPN可使更多新生的未成熟神经元发生增殖。BrdU是标记细胞增殖和分裂的外源性标记物,全脑缺血14 d SVZ区BrdU/DCX细胞表达最多,这说明脑缺血刺激了SVZ区神经祖细胞分裂成新生的未成熟神经元[18, 19],而全脑缺血大鼠经TSPN治疗后,SVZ区BrdU/DCX细胞较模型组更多(P<0.01),这表明TSPN在神经祖细胞的分裂活动中起强有力的驱动作用。
4.3 TSPN刺激SVZ区星形胶质细胞转化成新生未成熟神经元星形胶质细胞有神经干细胞的属性,是成年神经再生的主要“龛”,脑缺血可引起星形胶质细胞活化增生且分化成新生神经元[20, 21]。免疫荧光双标染色结果显示全脑缺血后SVZ区GFAP/DCX细胞与DCX的比值在14 d最高,这提示脑缺血的确可刺激星形胶质细胞分化成新生的具有迁移功能的未成熟神经元,并且在脑缺血早期阶段这种现象不断加强。而给予TSPN干预后,这种现象更明显,这表明全脑缺血后TSPN可刺激增生的星形胶质细胞进一步分化。
综上所述,TSPN可以促进全脑缺血后大鼠SVZ区的神经再生,加速全脑缺血后大鼠SVZ区细胞增殖和分化以及刺激全脑缺血后大鼠SVZ区星形胶质细胞转化成新生未成熟神经元。
| [1] | Arvidsson A, Collin T, Kirik D, et al. Neuronal replacement from endogenous precursors in the adult brain after stroke[J]. Nat Med, 2002, 8(9):963-970. |
| [2] | 王莹, 禇扬, 李伟, 等. 三七中皂苷成分及其药理作用的研究进展[J]. 中草药, 2015, 46(9):1381-1392. |
| [3] | 白羽, 张淑瑶, 任杰, 等. 三七总皂苷注射液治疗脑梗死的多中心研究[J]. 中国新药与临床杂志, 2001, 20(4):257-259. |
| [4] | He X, Deng F, Ge J, et al. Effects of total saponins of Panax notoginseng on immature neuroblasts in the adult olfactory bulb following global cerebral ischemia/reperfusion[J]. Neural Regeneration Res, 2015, 10(9):1450-1456. |
| [5] | 康立源, 周志焕, 张萌, 等. 三七总皂苷对缺氧复氧致皮质神经元损伤细胞凋亡相关基因及蛋白表达的影响[J]. 天津中医药大学学报, 2010, 29(1):22-25. |
| [6] | 唐婧姝, 裴清华. 三七总皂苷对大鼠脑缺血再灌注损伤的神经保护机制研究[J]. 中国实验方剂学杂志, 2011, 17(15):210-213. |
| [7] | 张建平, 司银楚, 朱培纯. 三七总皂苷对体外培养的大鼠海马神经干细胞增殖分化的作用[J]. 解剖学报, 2010, 41(3):362-366. |
| [8] | Pulsinelli W A, Brierley J B. A new model of bilateral hemispheric ischemia in the unanesthetized rat[J]. Stroke, 1979, 10(3):267-272. |
| [9] | 贺旭, 葛金文, 邓长青, 等. 三七总皂苷上调Bcl-2/Bax的比率抑制大鼠全脑缺血后海马CA1区神经元的凋亡[J]. 中草药, 2016, 47(8):1337-1344. |
| [10] | Cooper-Kuhn C M, Kuhn H G. Is it all DNA repair? Methodological considerations for detecting neurogenesis in the adult brain[J]. Brain Res Dev Brain Res, 2002, 134(1-2):13-21. |
| [11] | Couillard-Despres S, Winner B, Schaubeck S, et al. Doublecortin expression levels in adult brain reflect neurogenesis[J]. Eur J Neurosci, 2005, 21(1):1-14. |
| [12] | Manohar S, Paolone N A, Bleichfeld M, et al. Expression of doublecortin, a neuronal migration protein, in unipolar brush cells of the vestibulocerebellum and dorsal cochlear nucleus of the adult rat[J]. Neuroscience, 2012, 202(2012):169-183. |
| [13] | Francis F, Koulakoff A, Boucher D, et al. Doublecortin is a developmentally regulated, microtubule-associated protein expressed in migrating and differentiating neurons[J]. Neuron, 1999, 23(2):247-256. |
| [14] | Jin K, Minami M, Lan J Q, et al. Neurogenesis in dentate subgranular zone and rostral subventricular zone after focal cerebral ischemia in the rat[J]. Proc Natl Acad Sci USA, 2001, 98(8):4710-4715. |
| [15] | Brown J P, Couillard-Despres S, Cooper-Kuhn C M, et al. Transient expression of doublecortin during adult neurogenesis[J]. J Comp Neurol, 2003, 467(1):1-10. |
| [16] | 李鑫, 毕桂南, 石胜良, 等. 微管相关蛋白和NF-κB在大鼠脑缺血预处理中的神经保护作用[J]. 中国脑血管病杂志, 2011, 8(7):362-366. |
| [17] | Otero L, Zurita M, Bonilla C, et al. Endogenous neurogenesis after intracerebral hemorrhage[J]. Histol Histopathol, 2012, 27(3):303-315. |
| [18] | Yagita Y, Kitagawa K, Ohtsuki T, et al. Neurogenesis by progenitor cells in the ischemic adult rat hippocampus[J]. Stroke, 2001, 32(8):1890-1896. |
| [19] | Tanaka Y, Tanaka R, Liu M, et al. Cilostazol attenuates ischemic brain injury and enhances neurogenesis in the subventricular zone of adult mice after transient focal cerebral ischemia[J]. Neuroscience, 2010, 171(4):1367-1376. |
| [20] | Robel S, Berninger B, Gotz M. The stem cell potential of glia:lessons from reactive gliosis[J]. Nat Rev Neurosci, 2011, 12(2):88-104. |
| [21] | Pan A, Li M, Gao J Y, et al. Experimental epidural hematoma causes cerebral infarction and activates neocortical glial and neuronal genesis in adult guinea pigs[J]. J Neurosci Res, 2013, 91(2):249-261. |
 2016, Vol. 47
2016, Vol. 47


