2. 厦门市医药研究所厦门市天然药物研究与开发重点实验室, 福建厦门 361008
2. Xiamen Key Laboratory of Natural Medicine Research and Development, Xiamen Medicine Institute, Xiamen 361008, China
膜分离技术在中药分离中有着独特的优势,首先它是以传统的水提液为原液,其次它根据有效成分相对分子质量特征进行“集群筛选”[1,2,3],物理筛分对原药液影响很小,能保持水提液的一般特性。同时分离过程简便,适用于热敏性物质的分离,不消耗有机溶剂,可以缩短生产周期,降低成本,分离选择性高,满足中药现代化生产的要求[4,5]。在工业化生产中,无机膜与有机膜相比,更显示了耐高温、耐化学腐蚀、耐细菌和强度高等优点,从而使它在许多方面有着潜在的应用优势[5,6]。
复方板蓝根利咽颗粒是由板蓝根、玄参、桔梗、甘草等6味中药经提取加工制成的复方制剂,该制剂中以板蓝根清热解毒、凉血利咽为君药,玄参清热凉血、滋阴降火、解毒散结和桔梗宣肺利咽、祛痰排脓共为臣药,甘草清热解毒、祛痰止咳为佐使药,具有清热解毒、祛痰利咽的功效,用于咽喉肿痛、口咽干燥以及急、慢性咽喉炎和扁桃体炎见以上证候者的治疗。该制剂已获福建省医院制剂批准文号(闽药制字Z20120001),临床使用疗效显著[7,8]。
本实验采用200nm和50 nm 2种孔径陶瓷膜分别对复方板蓝根利咽颗粒水提液进行分离精制,连续多次取样,以优化的HPLC法[9]同时测定板蓝根、玄参、桔梗、甘草中的腺苷、(R,S)-告依春、哈巴俄苷、桔梗皂苷D、甘草苷和甘草酸铵6种有效成分,与膜滤前原液比较,计算其动态迁移率,并比较其膜滤通量、固含物去除率,以揭示中药复方中有效成分群在不同孔径陶瓷膜分离过程中的动态迁移规律。
1 仪器与材料Agilent 1260高效液相色谱仪,包括低压梯度四元泵,自动进样器,恒温箱,DAD紫外检测器,Chem station色谱工作站,美国Agilent公司;XS205电子分析天平,瑞士梅特勒-托利多公司,d=0.01mg;陶瓷膜小试设备,江苏久吾高科技股份有限公司,膜材质A12O3,膜孔径200、50 nm,膜面积0.1 m2。乙腈(批号13020466)、甲醇(批号13080417),色谱纯,Tedia公司;磷酸(批号201301042)、正丁醇(批号20140216),分析纯,西陇化工股份有限公司;超纯水(自制)。
腺苷(批号110879-200202,质量分数100%)、(R,S)-告依春(批号111753-201103,质量分数99.5%)、甘草苷(批号111610-201005,质量分数94.9%)、哈巴俄苷(批号111730-201106,质量分数96.0%)、桔梗皂苷D(批号111851-201204,质量分数94.9%)、甘草酸铵(批号110731-200614,质量分数100%)等对照品均购自中国食品药品检定研究院。
药材均购自厦门鹭燕制药有限公司,经厦门市医药研究所杨辉副主任药师鉴定,板蓝根为十字花科植物菘蓝Isatisindigotica Fort.的干燥根、桔梗为桔梗科植物桔梗Platycodongrandiflorum(Jacq.)A.DC.的干燥根、玄参为玄参科植物玄参Scrophularianingpoensis Hemsl.的干燥根、甘草为豆科植物甘草Glycyrrhizuralensis Fisch.的干燥根及根茎,均符合《中国药典》2015年版正品要求。
2 方法与结果 2.1 复方板蓝根利咽颗粒水提液的制备分别称取板蓝根1350 g、玄参450 g、桔梗450g、甘草180 g等,按优选的最优提取工艺[10],提取3次,每次加8倍量水微沸提取1 h,采用200目无纺滤布滤过,合并滤液,称质量,得到约62 kg的原液,取样后,备用。
2.2 复方板蓝根利咽颗粒水提液的陶瓷膜分离 2.2.1 膜初始水通量的测定将200 nm陶瓷膜装入膜分离小试设备中,加入纯化水10 L,接通电源,调节阀门,使进口压力为0.2 MPa,此时的膜通量即为该孔径膜的初始水通量,同法测定50 nm的陶瓷膜初始水通量,结果见表 1,可见200 nm膜初始水通量比50 nm膜大。
| 表 1 不同孔径陶瓷膜的膜滤过程参数比较(n=5) Table 1 Comparison on parameters of filtration process in different aperture ceramic membrane (n=5) |
测完初始水通量后,向装有200nm陶瓷膜小试设备储液桶内加入30kg复方板蓝根利咽颗粒水提液,直接膜滤,进口压力为0.2 MPa[11],分别在0、10、20、30、40、50 min收集1000 mL的膜滤液样品,密封备用,并记录药液膜通量,当膜滤液达23 kg时,立即向储液桶内加7 kg纯化水进行顶洗,并从加入纯化水开始,继续每10 min(即膜滤60、70 min时)收集膜滤液样品,并记录药液膜通量。当总膜滤液达到30 kg(76 min)时结束膜滤,共得8份膜滤精制液样品。
同法制备50nm孔径的膜滤液,因其药液通量较小,故分别在0、20、40、60、80、100、120 min取样,当膜滤液达23 kg时,立即向储液桶内加7 kg纯化水进行顶洗,并从加入纯化水开始,继续每20 min收集膜滤液样品,并记录药液膜通量。当总膜滤液达到30 kg(128min)时结束膜滤,共得7份膜滤精制液样品。2种孔径膜的通量变化见表 1、2。
| 表 2 膜通量随时间的变化(n=5) Table 2 Changes of membrane flux over time(n=5) |
由表 1、2可知,对于复方板蓝根利咽颗粒水提液体系,随着膜滤的进行,200 nm孔径的膜初始水通量较大,达1065 L/(m2∙h),分离过程中,通量衰减较小,稳定通量在426~340 L/(m2∙h);而50 nm的膜初始通量较小,为870 L/(m2∙h),分离过程中,通量衰减较大,稳定通量在258~228 L/(m2∙h)。200 nm膜结束时的药液通量也比50 nm的大,分别为340、228 L/(m2∙h),仅占初始水通量的31.9%、26.2%,说明2种膜均被污染,这可能与膜孔被水提液体系中的大分子物质堵塞导致有效孔隙率下降有关。
2.3 样品中腺苷、(R,S)-告依春、哈巴俄苷、桔梗皂苷D、甘草苷和甘草酸铵的HPLC定量测定[9] 2.3.1 色谱条件Agilent ZorboxEclipse XDB-C18色谱柱(250 mm×4.6mm,5 μm);流动相为乙腈-0.05%磷酸水溶液,梯度洗脱:0~10 min,3%~10%乙腈;10~14 min,10%~18%乙腈;14~22 min,18%~24%乙腈;22~30 min,24%~27%乙腈;30~34 min,27%~28%乙腈;34~35 min,28%~33%乙腈;35~40 min,33%~50%乙腈;40~45 min,50%~80%乙腈;45~47 min,80%~100%乙腈;47~48 min,100%~3%乙腈;48~50 min,3%乙腈;检测波长为260 nm(0~10 min)、245 nm(10~14 min)、278 nm(14~34.5 min)、210 nm(34.5~35.5 min)、250 nm(35.5~50 min);体积流量1 mL/min;柱温30 ℃;进样量为10 μL。
2.3.2 对照品溶液的配制分别称取腺苷、(R,S)-告依春、甘草苷、哈巴俄苷、桔梗皂苷D、甘草酸铵适量,置于10 mL量瓶中,加适量甲醇溶解后,用甲醇定容,摇匀即得混合对照品溶液,4 ℃冷藏备用。
2.3.3 供试品溶液的制备量取相当于临床1日服用剂量的复方板蓝根利咽颗粒水提液,浓缩成110 mL,加入甲醇110 mL,摇匀,离心15 min(1200 r/min),精密量取上清液20 mL,置水浴上蒸干,残渣加20 mL水溶解,用水饱和正丁醇萃取3次,每次20 mL,合并正丁醇液,将正丁醇液蒸干,残渣加适量甲醇溶解,迁移并定容至5mL量瓶中,摇匀,0.45 μm滤膜滤过即得。
2.3.4 6种有效成分迁移率的计算按照公式计算有效成分迁移率,结果见表 3~5。
| 表 3 6 种有效成分在200 nm 陶瓷膜分离过程中的动态迁移率 (n=5) Table 3 Dynamic migration rates of six active ingredients in separation process of 200 nm ceramic membrane(n=5) |
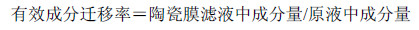
表 3结果可见,复方板蓝根利咽颗粒水提液在200 nm陶瓷膜分离过程中,6种有效成分的迁移率均有波动,波动范围在71%~104%,平均迁移率85%,在膜滤刚开始时和在20 min时相对全过程较低,平均为82%和87%,膜滤30~50 min时较高,达98%。在约60 min开始顶洗时,因加入7 kg的水,因此,60~70 min的迁移率均降低,平均为70%和53%。
表 4数据可见,复方板蓝根利咽颗粒水提液在50 nm陶瓷膜分离过程中,6种有效成分的迁移率也均有波动,波动范围在83%~107%,平均迁移率83%,因其膜滤通量较小,在膜滤刚开始时和在20 min时相对全过程较低,平均为90%和89%,膜滤40~80 min时较高,达98%。在约100 min开始顶洗时,因加入7 kg的水,因此,100~120 min的迁移率降低,平均为61%和57%。
| 表 4 6 种有效成分在50nm陶瓷膜分离过程中的动态迁移率(n=5) Table 4 Dynamic migration rates of six active ingredients in separation of 50 nm ceramic membrane(n=5) |
从表 5结果可见,复方板蓝根利咽颗粒水提液中6种成分在200nm陶瓷膜分离全过程中迁移率从高到低的顺序为(R,S)-告依春、哈巴俄苷、腺苷、桔梗皂苷D、甘草苷、甘草酸铵,而在50 nm中的顺序为哈巴俄苷、(R,S)-告依春、桔梗皂苷D、甘草酸铵、腺苷、甘草苷。6种有效成分在200nm陶瓷膜分离全过程中的总体迁移率比50nm的略高,分别为85%和83%。
| 表 5 6 种有效成分在2 种孔径陶瓷膜分离过程中的平均动态迁移率比较(n=5) Table 5 Comparison on dynamic migration rates of six active ingredients in separation of two kinds of ceramic membrane(n=5) |
分别精密吸取复方板蓝根利咽颗粒水提液原液、200nm陶瓷膜分离液、50nm陶瓷膜分离液等样品液各15 mL,置已干燥至恒定质量的蒸发皿中,于105 ℃烘箱中干燥5 h,移置硅胶干燥器中,放冷30 min,迅速精密称定质量,得各样品液固含物量,按如下公式计算固含物去除率。

200、50 nm孔径陶瓷膜的固含物去除率分别为21.0%、23.9%,可见,200 nm孔径陶瓷膜微滤的固含物去除率比50 nm的略低。
3 讨论复方板蓝根利咽颗粒由板蓝根、玄参、桔梗、甘草等组成,现代研究表明,板蓝根主要含有生物碱类、有机酸类、氨基酸类、核苷类等,其中腺苷等核苷类和(R,S)-告依春等生物碱类均是其抗病毒的重要有效成分[12,13,14];玄参主要含环烯醚萜类、苯丙素苷类,其中哈巴俄苷为玄参特征性有效成分,具有抗炎等作用[15,16,17];桔梗主要有效成分为三萜皂苷类,桔梗皂苷D是其主要皂苷,具有祛痰作用[18];甘草主要活性成分为甘草苷等甘草黄酮类和甘草酸等甘草皂苷类,具有抗炎、抗病毒、祛痰等活性[19]。这6种有效成分与复方板蓝根利咽颗粒的功效主治密切相关,故本实验探讨了这6种有效成分在2种孔径陶瓷膜分离精制过程中的动态迁移率。
中药多成分、多功效的作用特点决定着单一成分难以表达中药的质量,多成分同步质量控制模式应运而生,并得到了迅速普及。本实验表明,复方板蓝根利咽颗粒水提液用200 nm和50nm孔径的A12O3陶瓷膜均有较好的分离除杂效果,复方中的6种有效成分的全过程平均迁移率分别达85%和83%以上,膜滤结束时药液的平均膜通量分别为340和228 L/(m2∙h),总体上表明对于复方板蓝根利咽颗粒水提液体系,陶瓷膜的孔径以200 nm的较好[11]。
本实验中,200、50nm孔径陶瓷膜的固含物去除率分别为21.0%、23.9%。可能是因为复方板蓝根利咽颗粒水提液中含有淀粉、果胶、蛋白质等大分子杂质,导致本体系中50 nm孔径对大分子的截留更多,使200 nm孔径陶瓷膜分离的固含物去除率比50 nm的略低。
本实验初步反映了中药复方有效成分群在2种不同孔径陶瓷膜分离过程的动态迁移情况,掲示了中药复方有效成分群的动态迁移特征,说明200和50nm陶瓷膜技术可以较好保持中药复方药效物质的整体与多元性(实验结果未出现某类成分较大损失)。本研究也提示200和50nm孔径范畴可避免多种成分的竞争透过作用,为现代陶瓷膜技术在中药精制中的推广应用奠定药效物质迁移理论基础。
| [1] | 郭立玮. 中药膜分离领域的科学与技术问题[J]. 膜科学与技术, 2003, 23(4):209-213. |
| [2] | 李存玉,马赟,陈涛,等.一种适用于制药行业中快速评价超滤膜孔径的方法[J].中草药,2015,46(11):1603-1608. |
| [3] | 伍利华,黄英,刘婷,等.陶瓷膜分离技术应用于中药口服液的研究进展[J].药物评价研究,2014,37(2):184-187. |
| [4] | 岑琴, 周丽莉, 礼彤. 膜分离技术及其在中药领域中的应用[J]. 沈阳药科大学学报, 2008, 25(1):77-80. |
| [5] | 宋忠兴,唐志书,刘红波,等.决明子水提液微滤过程中膜通量和膜污染阻力的影响因素研究[J].中草药,2015,46(12):1774-1778. |
| [6] | 黄敏燕, 潘林梅, 郭立玮. ZrO2陶瓷膜精制增液汤复方水提液的膜过程研究[J]. 中成药, 2010, 32(3):495-497. |
| [7] | 罗友华, 杨辉, 黄亦琦, 等. 咽舒宁颗粒祛痰镇痛及抑菌作用[J]. 中国实验方剂学杂志, 2013, 19(1):287-290. |
| [8] | 罗友华, 杨辉, 黄亦琦, 等. 咽舒宁颗粒抗炎药效试验研究[J]. 海峡药学, 2013, 25(6):18-21. |
| [9] | 罗友华, 杨辉, 黄亦琦, 等. HPLC法同时测定复方板蓝根利咽颗粒水提液中6种成分[J]. 中成药, 2014, 36(7):1435-1439. |
| [10] | 罗友华, 李成付, 杨辉, 等. 咽舒宁颗粒提取精制工艺优选研究[J]. 海峡药学, 2010, 22(11):18-21. |
| [11] | 罗友华, 李成付, 杨辉, 等. 陶瓷膜微滤技术精制复方咽舒宁水提液的研究[J]. 中国实验方剂学杂志, 2010, 16(13):12-16. |
| [12] | 方建国, 汤杰, 杨占秋, 等. 板蓝根体外抗单纯疱疹病毒I型作用[J]. 中草药, 2005, 36(2):242-244. |
| [13] | 徐丽华, 黄芳, 陈婷, 等. 板蓝根中的抗病毒活性成分[J]. 中国天然药物, 2005, 3(6):359-360. |
| [14] | 陈凯, 窦月, 陈智, 等. 板蓝根抗病毒与抗内毒素等清热解毒药效作用及化学基础研究进展[J]. 中国实验方剂学杂志, 2011, 17(18):275-278. |
| [15] | 胡瑛瑛, 黄真. 玄参的化学成分及药理作用研究进展[J]. 浙江中医药大学学报, 2008, 32(2):268-270. |
| [16] | 谢丽华, 刘洪宇, 钱瑞琴, 等. 哈巴苷与哈巴俄苷对阴虚小鼠免疫功能及血浆环化核苷酸的影响[J]. 北京大学学报:医学版, 2001, 33(3):283-284. |
| [17] | 张建春, 朱建美. 玄参的化学成分与药理活性研究进展[J]. 山东医药工业, 2003, 22(1):25-27. |
| [18] | 李婷, 徐文珊, 李西文, 等. 中药桔梗的现代药理研究进展[J]. 中药药理与临床, 2013, 29(2):205-208. |
| [19] | 高雪岩, 王文全, 魏胜利, 等. 甘草及其活性成分的药理活性研究进展[J]. 中国中药杂志, 2009, 34(21):2695-2700. |
 2016, Vol. 47
2016, Vol. 47


