板蓝根IsatidisRadix为十字花科(Cruciferae)菘蓝属Isatis L.植物菘蓝Isatis indigotica Fort.的干燥根,是我国多年来常用的清热解毒药,具有抗病毒、抗内毒素、解热镇痛、抗炎、活血化瘀、抗癌等功效,是我国传统治疗病毒性感冒及腮腺炎的理想药物[1,2],近年来大量药理研究表明,板蓝根抗炎、免疫调节机制主要与其生物碱(告依春、靛玉红)及核苷类成分(尿苷、鸟苷、腺苷)密切相关,不仅具有调节免疫[3]、消炎抑菌[4,5]、抗肿瘤[6]、干扰病毒核酸合成[7,8]等药理活性,且因其所占比例较高,广泛作为指标性成分衡量药材质量[9,10]。
中药制剂传统制备过程包括药材的预处理、提取、浓缩、精制、干燥、制粒等各个工艺环节,经1次或多次物理、化学和生物等信息的传递或整合后,构成了最终产品的质量内涵,并最终影响产品效能的发挥。前期实验及文献调研发现,板蓝根制剂中主要指标性成分告依春、靛玉红和核苷类成分存在热不稳定性,传统制备过程各阶段操作水平对其有效成分的质量分数及其药效影响显著[11,12,13],并最终导致产品质量及疗效参差不齐。因此,本实验系统研究板蓝根制剂制备过程,以提取-浓缩-精制-干燥-制粒5个关键工艺环节为研究对象,考察各环节主要指标性成分(告依春、尿苷、鸟苷、腺苷、靛玉红)质量分数变化,构建抗氧化活性模型,并运用计量学方法将化学成分信息-药效数据进行相关性研究,初探板蓝根提取物制备过程的关键影响环节,为后续制备工艺优化提供理论基础。
1 仪器与材料Agilent 1260型高效液相色谱仪,包括四元泵、DAD检测器、柱温箱、工作站,安捷伦科技有限公司;BT25S电子分析天平(十万分之一)、BSA124电子分析天平(万分之一),德国Sartorius公司;电热套,鄄城华鲁电热仪器有限公司;XH-B型漩涡混合器,江苏康健医疗用品有限公司;KQ5200型超声波清洗器,昆山市超声仪器有限公司;QSB-2000油浴锅,上海爱朗仪器有限公司;SHB-III循环水式多用真空泵,郑州长城科工贸有限公司。
对照品鸟苷(批号N007-110416,质量分数≥98%,20mg)、尿苷(批号N08-130416,质量分数≥98%,20 mg)、腺苷(批号110879-200202,质量分数≥98%,20 mg),中国食品药品检定研究院;对照品告依春(批号B-014-150320,质量分数≥98%,20 mg)、靛玉红(批号D-025-150126,质量分数≥98%,20 mg),成都瑞芬思生物科技有限公司;糊精,天津市大茂化学试剂厂;水杨酸、七水合硫酸亚铁、30%过氧化氢,西陇化工股份有限公司;乙腈为色谱纯,Tedia公司;水为双蒸馏水,实验室自制;其他试剂均为分析纯。
板蓝根药材2014年购于江西樟树天齐堂中药饮片有限公司,经江西中医药大学现代中药制剂教育部重点实验室杨明教授鉴定为为十字花科菘蓝属植物菘蓝Isatis indigotica Fort.的干燥根。
2 方法与结果 2.1 采用HPLC法测定各阶段指标成分的质量分数变化 2.1.1 供试品溶液的制备按照《中国药典》2015年版收载的板蓝根颗粒的制法,精密称取板蓝根药材25 g,10倍量的水(250 mL),加水煎煮回流提取2次,第1次2 h,第2次1 h,煎液滤过,滤液合并,得到提取液,提取液减压浓缩至一定体积得浓缩液,加乙醇使含醇量达60%,静置使沉淀,取上清液,回收乙醇并浓缩至适量(约25 mL),从浓缩液中取10 mL继续浓缩至恒定质量,所得干膏样品用20 mL甲醇溶解,用涡旋仪混匀,再从浓缩液中取10 mL继续浓缩至流浸膏状态,加入适量的糊精,制成颗粒,干燥,即得提取液、浓缩液、干膏、颗粒供试品溶液。提取-浓缩-醇沉-干燥-制粒各环节所取溶液均用0.22 μm微孔滤膜滤过,即得供试品溶液(S1:提取液合并且定容至500 mL,S2:减压浓缩至250 mL,S3:减压浓缩至200 mL,S4:减压浓缩至100 mL,S5:减压浓缩至50 mL,S6:醇沉后浓缩至25 mL,S7:干膏样品用甲醇超声溶解,S8:制备成颗粒后甲醇超声溶解)。
2.1.2 对照品溶液的制备分别精密称取5个对照品适量:尿苷11.7 mg、鸟苷9.7 mg、腺苷13.5 mg、告依春12.0 mg、靛玉红12.4 mg,置于100 mL量瓶中,核苷类成分用双蒸水超声溶解,告依春和靛玉红分别用甲醇溶解,定容摇匀,配成质量浓度分别为尿苷0.117 mg/mL、鸟苷0.097 mg/mL、腺苷0.135 mg/mL、告依春0.120 mg/mL、靛玉红0.124 mg/mL的对照品储备液,置4 ℃冰箱保存备用。
2.1.3 色谱条件色谱柱为Gemini 5 u C18110A柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水,梯度洗脱:0~10 min,2%乙腈;10~20 min,10%乙腈;20~30 min,40%乙腈;30~50 min,100%乙腈;50~60 min,100%乙腈;体积流量1 mL/min,检测波长245 nm,柱温30 ℃,进样量20 μL。色谱图见图 1。
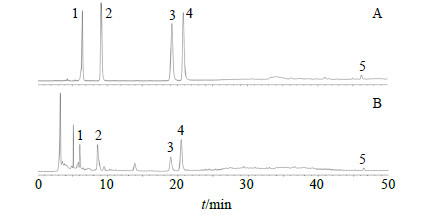 |
1-尿苷2-鸟苷3-腺苷4-告依春5-靛玉红 1-uridine 2-guanosine 3-adenosine 4-epigoitrin 5-indirubin 图 1 5种对照品(A)与板蓝根S1部分粗提物(B)HPLC图Fig.1 HPLC of five reference substances(A)and crude extracts from Isatidis Radix(B) |
分别精密量取“2.1.2”项下对照品储备液适量,置于10 mL量瓶中,用相应的溶剂溶解稀释至刻度,得系列质量浓度的混合对照品溶液,各取1 mL用0.22微孔滤膜滤过,按“2.1.3”项色谱条件分别进样,记录各色谱峰峰面积,以质量浓度为横坐标(X),峰面积积分值为纵坐标(Y)绘制标准曲线,得各成分的回归方程、相关系数及线性范围,结果分别为尿苷Y=18.704X+27.49,R2=0.9995,2.34~29.25μg/mL;鸟苷Y=27.985X+147.61,R2=0.9992,1.91~24.25 μg/mL;腺苷Y=39.296X+8.260 9,R2=0.9997,2.7~33.75 μg/mL;告依春Y=122.64X-0.120 5,R2=0.9990,2.4~30 μg/mL;靛玉红Y=0.309 7X+15.72,R2=0.9996,12.4~37.2 μg/mL。结果表明,尿苷、鸟苷、腺苷、告依春、靛玉红分别在2.34~29.25、1.91~24.25、2.7~33.75、2.4~30.0、12.4~37.2μg/mL线性关系良好。
2.1.5 精密度试验精密吸取混合对照品溶液20 μL,按“2.1.3”项色谱条件重复进样6次,记录峰面积,结果尿苷、鸟苷、腺苷、告依春、靛玉红峰面积的RSD分别为1.56%、2.47%、2.67%、1.24%、2.63%,均小于3%,表明仪器的精密度良好。
2.1.6 稳定性试验精密吸取同一供试品溶液20 μL按“2.1.3”项色谱条件进样,记录峰面积,每隔4 h测定1次,共考察24 h。结果尿苷、鸟苷、腺苷、告依春、靛玉红峰面积的RSD分别为1.30%、1.67%、2.86%、0.44%、1.80%,均小于3%,表明样品溶液在24 h内稳定。
2.1.7 重复性试验精密称取板蓝根药材各6份并制备供试品溶液,按“2.1.3”项色谱条件分别进样,结果尿苷、鸟苷、腺苷、告依春、靛玉红质量分数的RSD分别为2.80%、0.80%、2.63%、0.26%、2.57%,均小于3%,表明方法的重复性良好。
2.1.8 回收率试验取已测定的板蓝根粗提液样品9份,按照样品中相应成分质量分数的100%分别精密加入各对照品适量,按“2.1.3”项色谱条件分别进样测定,计算各成分的回收率,结果尿苷、鸟苷、腺苷、告依春、靛玉红的平均回收率分别为98.94%、98.07%、97.95%、98.25%、92.42%,RSD分别为1.12%、2.29%、2.54%、1.55%、2.68%,结果表明该方法的回收率良好。
2.1.9 板蓝根制剂制备过程中各指标性成分的质量分数测定分别精密吸取各供试品溶液20 μL,注入HPLC液相色谱仪,在“2.1.3”项色谱条件下测定各指标成分的质量分数,混合对照品溶液、板蓝根供试品溶液色谱图见图 1。结果表明,在“2.1.3”项色谱条件下,各成分分离度良好。
在板蓝根制剂制备过程中,5种指标性成分整体呈下降趋势,每一步操作环节都会造成指标成分质量分数波动,其中热处理环节(浓缩、干燥)损失较大。在整体制备过程中告依春损失率最大,达到67.3%,其次为鸟苷、靛玉红、腺苷、尿苷,损失率分别为57.8%、56.3%、47.7%、39.5%,结果见图 2。
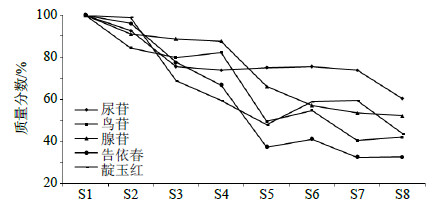 | 图 2 板蓝根制剂制备过程化学成分的质量分数变化Fig.2 Content changes of chemical ingredients in process of Isatidis Radix preparation |
各环节过程中各指标成分损失明显,其中浓缩环节尿苷、鸟苷、腺苷、告依春、靛玉红的损失率分别为24.8%、50.4%、33.8%、62.5%、51.9%,告依春在此环节损失最大,其次是靛玉红、鸟苷、腺苷、尿苷;醇沉环节腺苷损失率为9.07%,其他指标成分在此环节无减少;干燥环节尿苷、鸟苷、腺苷、告依春损失率分别为1.68%、14.29%、3.61%、8.61%,鸟苷在此环节损失最大,其次是告依春、腺苷、尿苷,靛玉红在此环节无减少;制粒环节尿苷、腺苷、靛玉红的损失率分别为13.49%、1.25%、15.87%,靛玉红在此环节损失最大,其次是尿苷、腺苷,鸟苷、告依春在此环节无减少。综合分析表明,在板蓝根制剂整个制备过程中,各环节损失顺序依次为浓缩>干燥>制粒>醇沉。
2.2 各环节色谱图的聚类分析以HPLC色谱图中的共有峰作为描述样品化学特征的变量,应用SPSS 20.0统计软件、采用系统聚类分析方法对板蓝根制剂各制备环节进行聚类分析,即以色谱图的5个化学成分所对应的峰面积对数值为变量,然后采用SPSS 20.0统计软件对各环节进行聚类,结果见图 3。当分类距离为10时,可将板蓝根制剂各制备环节分为2类,S1与S2、S3、S4聚为一类,其他环节聚为一类;当聚类距离为5时,可将板蓝根制剂各制备环节分为3类,S1与S2聚为一类,S3与S4聚为一类,其他环节聚为一类。由此可见,浓缩环节是造成制剂质量内涵变异的关键环节,与前期质量分数差异结果一致。
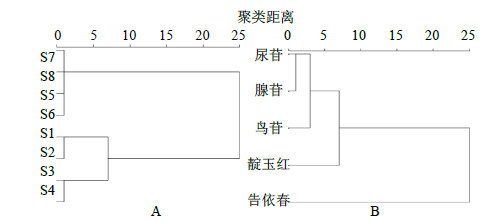 | 图 3 板蓝根制剂制备过程中色谱图聚类分析树状图(A)与变量聚类分析树状图(B)Fig.3 Cluster dendrogram of chromatograms(A)and variable hierachical cluster dendrogram of chromatograms (B)in process of Isatidis Radix preparation |
对色谱数据进行变量聚类,所得分析结果见图 3-B。当分类距离为10时,可将5个化学成分分为2类,即告依春为一类,其他化学成分聚为一类;当分类距离为5时,可将5个化学成分分为3类,即告依春为一类,靛玉红为一类,其他色谱峰聚为一类。尿苷、鸟苷、腺苷为核苷类化合物,告依春为含硫类化合物,靛玉红为吲哚类化合物,提示化学成分结构一致则制剂过程质量分数变化趋势类似。
2.3 羟基自由基清除率的测定在96孔板中加入浓度为2.5 mmol/L FeSO4•7H2O溶液和终浓度为2.5 mmol/L水杨酸各50 μL,加入板蓝根制剂制备过程不同阶段的提取液50 μL后,加入终浓度为5% H2O2,37 ℃水浴锅加热30 min,在536 nm波长下测定其吸光度(A)为A0。同时用双蒸水代替样品作空白对照,在相同条件下测定其A为A1。为扣除药物本底颜色对实验的影响,同时加入FeSO4•7H2O,水杨酸和板蓝根制剂制备过程不同阶段的提取液各50 μL后,加入50 μL蒸馏水在相同条件下测定其A为A2。按公式进行计算板蓝根制剂制备过程不同阶段的提取液羟基自由基清除率[清除率=1-(A0-A2)/A1]。
结果S1~S8的清除率分别为62.94%、56.85%、37.82%、36.55%、31.47%、23.86%、21.07%、14.95%。板蓝根制剂制备过程不同阶段的提取液羟基自由基清除率整体呈下降趋势,即其抗氧化活性在制备过程中缓慢减弱。其中浓缩、醇沉、干燥环节抗氧化活性下降明显,浓缩过程羟基自由基清除率下降最快,高达31.47%,醇沉过程降低了7.61%,干燥过程降低了2.79%,制粒过程降低了6.12%。
2.4 化学成分质量分数-药效活性数据的相关性 2.4.1 偏最小二乘法相关性分析运用偏最小二乘法对色谱-药效活性数据进行相关分析,利用SIMCA-P+12.0软件,以板蓝根提取物特征峰峰面积为自变量(X),羟基自由基清除率为因变量(Y),构建板蓝根制剂制备过程谱-效关系方程。得到谱效关系方程:Y=−2.09407 X1+2.110 84 X2+0.085 300 1X3-2.58097 X4+3.528 79 X5(R2=0.996)(X1~X5分别代表尿苷、鸟苷、腺苷、告伊春及靛玉红,下同),由方程可知制备过程中板蓝根的鸟苷、腺苷、靛玉红的色谱峰与羟基自由基清除率的相关性呈正相关,其中靛玉红的色谱峰相关性最强,其次是鸟苷、腺苷。提示靛玉红、鸟苷、腺苷可能是其发挥抗氧化活性的关键指标性成分。
2.4.2 多元线性回归分析运用SPSS 20.0软件对对色谱-药效活性数据进行多元线性回归,以板蓝根提取物的特征峰峰面积为自变量(X),羟基自由基清除率为因变量(Y),构建板蓝根制剂生产过程谱-效关系方程,由回归的方差分析,F=108.042,P=0.009<0.01,拟合的回归方程具有统计学意义(表 1)。得到谱效关系方程:Y=−242.567-1.047 X1+0.396 X2+0.020 X3-0.154 X4+15.273 X5。由回归系数t检验,5个系数的P值均未小于0.05,这与方差分析的结果有出入,所以要对自变量做进一步的筛选,继续进行逐步回归。逐步回归对方程的方差分析检验,F=55.177,P=0.000<0.001,说明逐步回归方程均有高度的统计学意义,最终得到回归方程Y=0.197 X1-0.057 X2+0.128 X3+0.357 X5。根据相关系数可以认为鸟苷、腺苷、靛玉红与羟基自由基清除率呈正相关,其中靛玉红相关性最强,其次是鸟苷、腺苷,提示靛玉红、鸟苷、腺苷可能是其发挥抗氧化活性的药效物质基础。所得出的结论与运用偏最小二乘法对色谱-药效活性数据进行相关分析的结果一致。
| 表 1 多元线性回归方差分析结果 Table 1 Analysis of varianceofMLR |
由于偏最小二乘法和多元线性回归对色谱-药效活性数据进行相关分析的结果均显示靛玉红、鸟苷、腺苷可能是其发挥抗氧化活性的关键指标性成分,因此采用活性验证的方法,测定板蓝根各指标性成分的对照品以及抗坏血酸的羟基自由基清除率。结果显示尿苷、鸟苷、腺苷、告依春、靛玉红以及抗坏血酸的羟基自由基清除率分别为−3.63%、46.53%、30.03%、−11.75%、88.12%、99.34%。可见其中靛玉红的羟基自由基清除率最高,与对照药(抗坏血酸)最为接近,其次是鸟苷、腺苷,提示靛玉红、鸟苷、腺苷可能是其抗氧化活性的关键物质基础,与运用偏最小二乘法和多元线性回归法对色谱-药效活性数据进行相关分析的结果一致。
3 讨论本研究结果表明,板蓝根制剂各制备环节中指标性成分质量分数整体呈下降趋势,其中热处理环节(浓缩、干燥)影响最大;由板蓝根药材提取液至制剂成品,其抗氧化活性呈逐步降低趋势,浓缩干燥环节下降速率最快(约为40%),成分和药效的分析结果一致,均说明浓缩干燥环节对板蓝根制剂质量影响较大。长时间的浓缩干燥过程易造成板蓝根制剂药效降低,而目前《中国药典》2015年版标准并未对浓缩干燥环节做出具体规范化的标准及指导意见,提示板蓝根制剂不同批次产品质量差异较大可能与浓缩、干燥环节操作规范化不足有关,其制剂生产过程中应尽量缩短高温浓缩处理的时间。
中药制剂的生产过程主要包括药材的预处理、提取、浓缩、精制、干燥、制粒等各个工艺环节,不同阶段产品质量内涵的变异经1次或多次整合后构成了最终产品的质量变异度,其间包括物理、化学和生物等信息的传递或转变,并最终影响产品效能的发挥,即“产品质量是生产出来的,而非检测出来的”[14]。因此,如何有效控制中药制剂产品质量,将中药产品质量控制在生产线上,非常有必要对中药生产全过程的各个环节进行细致分析。采用药效活性指导,研究制剂生产过程、化学成分的变化趋势及其与药效的相关性是探究制剂工艺科学性、合理性的有效途径。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 马毅敏, 李娜, 刘承伟, 等. 板蓝根不同提取部位抗炎镇痛活性比较研究[J]. 中草药, 2014, 45(17):2517-2521. |
| [3] | 晋玉章, 宋光明, 赵艳威, 等. 板蓝根免疫调节作用活性部位的筛选[J]. 武警医学院学报, 2011, 20(7):538-540. |
| [4] | 胡晓燕, 刘明华, 孙琴, 等. 板蓝根抑菌活性部位的谱效关系研究[J]. 中草药, 2013, 44(12):1615-1620. |
| [5] | 赫媛媛, 赵子剑, 赵铭. 板蓝根含片抑菌、抗炎作用的实验研究[J]. 现代中医药, 2006, 26(2):57-58. |
| [6] | 肖珊珊, 金郁, 孙毓庆. 板蓝根化学成分、药理及质量控制研究进展[J]. 沈阳药科大学学报, 2003, 20(6):456-458. |
| [7] | 窦希波, 于晓蕾, 王颖. RP-HPLC法测定板蓝根中腺苷的含量[J]. 齐鲁药事, 2004, 23(7):28-29. |
| [8] | 黄芳, 熊雅婷, 徐丽华, 等. 板蓝根不同提取物中抗病毒成分表告依春在大鼠体内的药代动力学[J]. 中国药科大学学报, 2006, 37(6):519-522. |
| [9] | Lmo Y, Zhang J, Zhao H P, etal. SimμLtaneoμs determination of chlorogenic acid, phillyrin, arctiin, liqμiritin and glycyrrhizin in yinqiao powder by HPLC[J]. ChinPharmJ, 2013, 48(6):473-476. |
| [10] | 黄家娣. 板蓝根化学成分和药理作用综述[J]. 中国现代药物应用, 2009, 3(15):197-198. |
| [11] | 雷黎明, 潘清平. 板蓝根化学、药理、质量及提取方法的研究进展[J]. 时珍国医国药, 2007, 18(10):2578-2580. |
| [12] | 孙琴, 李寒冰, 鄢丹, 等. 基于抗菌效价检测的板蓝根颗粒制备过程质量变化评价[J]. 中草药, 2012, 43(2):259-264. |
| [13] | 罗云, 金城, 鄢丹, 等. 不同干燥工艺对板蓝根水提物中有效成分的影响[J]. 中草药, 2011, 42(8):1532-1536. |
| [14] | 谭曼容, 鄢丹, 邱玲玲, 等. 中药生产过程质量生物评控方法研究-以板蓝根颗粒为例[J]. 中国中药杂志, 2012, 37(8):1122-1126. |
 2016, Vol. 47
2016, Vol. 47


