2. 广州医科大学附属第一医院呼吸疾病国家重点实验室, 广东广州 510230
2. State Key Laboratory of Respiratory Diseases, the First Affiliated Hospital of GuangzhouMedicalUniversity, Guangzhou 510230, China
板蓝根IsatidisRadix是中国传统中草药,始载于《神农本草经》,味苦,性寒,具有清热解毒、凉血利咽之功效,临床上常用于病毒性及细菌性感染疾病等[1,2]。多糖是板蓝根入药部位(水提部位)的主要化学成分,Du等[3]对95%醇沉板蓝根粗多糖进行分离纯化得到相对分子质量(MW)为57 000的均一多糖RIWP,并首次报道了多糖RIWP对小鼠肺泡巨噬细胞的抗氧化和抗炎活性;杨子峰等[4,5]对板蓝根水提物S-03进行研究发现其可以体外抑制甲、乙型流感病毒的感染;对MW在3500~7 000的粗多糖G2研究发现,在病毒感染早期G2可能通过影响病毒颗粒来干扰流感病毒的附着,从而防止流感病毒的感染;日本学者Yamada认为板蓝根抗病毒成分之一为糖肽与蛋白质或多肽的复合物,即糖蛋白或糖肽,且分离出一种抗病毒的糖蛋白[6]。板蓝根粗多糖是一种较为复杂的混合物,由多种不同组成、不同MW的均一多糖以及糖蛋白等构成,因此,对板蓝根粗多糖进行系统分离纯化,对于筛选活性多糖(糖蛋白)成分,阐明板蓝根多糖(糖蛋白)的抗病毒机制至关重要。
本实验在前期粗分离和活性追踪的基础上[7],以抗病毒活性较好的80%醇沉板蓝根粗多糖为研究对象,采用系统分离纯化法,得到2种板蓝根均一多糖IRPS1A和IRPS1B及2种板蓝根均一糖蛋白IRPS2A和IRPS3A,并测定其单糖组成和氨基酸组成,为板蓝根的抗病毒物质及机制研究奠定基础。
1 材料 1.1 仪器Agilent 1100高效液相色谱仪,美国Agilent公司;配备Alltech 3300 ELSD检测器,上海埃纹斯科贸有限公司;RE-52C旋转蒸发仪,巩义市英峪予华仪器有限公司;FDl冷冻干燥机,北京博医康仪器有限公司;CH-8606微量分析天平,瑞士Mettler Toledo公司;BSZ-100自动部分收集器,上海青浦沪西仪器厂;EPED-E2-10TF超纯水器,南京易普易达科技发展有限公司;UV-2550紫外可见分光光度计,日本Shimadzu公司。
1.2 药材与试剂板蓝根由广州白云山和记黄埔中药有限公司提供,采自黑龙江大庆及安徽阜阳板蓝根GAP基地,由中国科学院华南植物院叶华国研究员鉴定为十字花科菘蓝属植物菘蓝IsatisindigoticaFort.的根;硫酸、盐酸、苯酚、氯化钠、磷酸二氢钠、磷酸氢二钠,分析纯,上海凌峰化学试剂有限公司;DEAE-Sepharose Fast Flow、Sephacryl-200,GE Healthcare;乙腈,色谱纯,Honeywell;无水乙醇,分析纯,上海泰坦科技股份有限公司;葡萄糖、甘露糖、木糖、阿拉伯糖、鼠李糖、半乳糖、半乳糖醛酸,上海源聚生物科技有限公司,质量分数≥99%;三氯甲烷,分析纯,上海化学试剂有限公司;透析袋,截留MW3500,联合碳化;标准葡聚糖的MW1 000(批号31416)、5 000(批号31417)、12 000(批号31418)、25 000(批号31419)、50 000(批号31420)、150000(批号31422),瑞士Fluka公司;邻苯二甲醛(OPA)、9-芴甲基氯甲酸酯(FMOC),质量分数≥99%,Sigma公司;17种氨基酸混合标准溶液,美国Pierce公司,批号61105,其中L-天门冬氨酸、L-谷氨酸、L-丝氨酸、L-组氨酸、甘氨酸、L-苏氨酸、L-精氨酸、L-丙氨酸、L-酪氨酸、L-脯氨酸、L-缬氨酸、L-蛋氨酸、L-苯丙氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸浓度为2.5 μmol/mL;L-胱氨酸浓度为1.25 μmol/mL;1-苯基-3-甲基-5-吡唑啉酮(PMP),阿拉丁试剂,质量分数≥99.0%;磷酸奥司他韦,上海罗氏制药有限公司;二甲基亚砜(DMSO),美国Sigma公司;MEM基础培养基(Minimum Essential Medium),美国Gibco公司,批号20140217;胎牛血清,美国Gibco公司,批号10099;1mg/mL甲苯磺酰苯丙氨酸氯甲酮处理过的胰酶(TPCK胰酶),广州捷倍斯生物科技有限公司,批号20140220;噻唑蓝[MTT,3-(4,5-二甲基噻唑-2)-2],Genebase公司。
1.3 细胞株与病毒株狗肾细胞(MDCK)引自中国科学院典型培养物保藏委员会细胞库。甲型H1N1流感病毒PR8株(A/PR/8/34,H1N1)、甲型H3N2流感病毒Aichi株(A/Aichi/2/68,H3N2)均购自美国经典培养物收藏中心(ATCC);新甲型H1N1流感病毒株(A/Guangzhou/GIRD07/09,H1N1,Genebank No.HM014332.1)为临床分离株。上述毒株流感病毒通过接种于9日龄的鸡胚尿囊腔中扩增,35 ℃孵育2d,收获尿囊液。用MDCK细胞滴定病毒,以细胞病变抑制法(CPE)[8]判定这些毒株的半数感染量(TCID50/100μL),作为病毒原始滴度。
2 方法与结果 2.1 粗多糖制备准确称取板蓝根药材粉末300 g,加入10倍量去离子水,回流提取2 h,冷却,滤过,重复上述提取过程2次,合并提取液,减压浓缩至料液比约1:2,加入无水乙醇,使乙醇的体积分数达50%,4 ℃下冷藏24 h,4500r/min离心10 min,收集沉淀,冷冻干燥。重复上述醇沉过程,使上清液中乙醇的体积分数依次达60%、70%、80%、90%,最终得到不同体积分数乙醇的醇沉粗多糖。分级醇沉板蓝根粗多糖的性状及产率见表 1。
| 表 1 分级醇沉板蓝根粗多糖性状及产率 Table 1 Characteristic and productivity of crude polysaccharides precipitated by ethanol at different concentration |
按每孔约2.5×104 MDCK细胞接种到96孔板,24 h后待细胞长成单层后,弃去培养液,加入不同稀释度的药物100 μL/孔,空白对照和正常细胞对照孔加入100 μL/孔MEM,37 ℃、5% CO2继续培养36~48 h,每孔加MTT液(5 mg/mL)20 μL,置37 ℃、5% CO2温箱中继续孵育4h。吸弃培养上清液,每孔加100 μLDMSO,低速振荡10 min,使结晶物充分溶解。选择490 nm波长,在酶联免疫监测仪上测定各孔吸光度(A)值,计算抑制率,并用Reed-Muench法计算药物的半数有毒浓度(TC50),抑制率=(正常组平均A值-给药组平均A值)/(正常组平均A值-空白组平均A值)。结果显示MTT法体外检测板蓝根多糖的TC50>40 mg/mL。
2.2.2 板蓝根多糖体外抗流感病毒活性实验在治疗作用模式下,以细胞病变抑制法(cytopathic effect reduction method)研究板蓝根多糖对流感病毒的抑制作用。长满单层的96孔细胞培养板内的MDCK细胞吸附病毒2 h,同时设定阳性药物(磷酸奥司他韦)和细胞对照,然后加入含不同质量浓度(40、20、10、5、2.5、1.25、0.625、0.3125、0.156 2mg/mL)药物的培养液,置34 ℃、5% CO2环境下培养48 h。
细胞出现病变程度按以下6级标准记录:“−”为细胞生长正常,无病变出现;“±”为细胞病变少于整个单层细胞的10%;“+”为细胞病变约占整个单层细胞的25%;“++”为细胞病变约占整个单层细胞的50%;“+++”为细胞病变约占整个单层细胞的75%:“++++”为细胞病变约占整个单层细胞的75%以上。用Reed-Muench法计算半数抑制浓度(IC50),并以选择指数(SI)表示(SI=TC50/IC50),SI>2表示低毒高效;SI=1~2表示高毒低效;SI<1表示无效。结果显示板蓝根多糖对多种亚型的甲型流感病毒有体外抑制作用,见表 2。
| 表 2 板蓝根80%醇沉粗多糖体外对多种甲型流感病毒药效作用 Table 2 Pharmacodynamics of crude polysaccharides precipitated by 80% ethanol on different influenza a virus in vitro |
取80%乙醇醇沉板蓝根粗多糖样品1.0 g,用纯水溶解后上DEAE-Sepharose Fast Flow色谱柱,依次以纯水及0.1、0.5 mol/L NaCl溶液进行洗脱,自动部分收集器收集馏份,7.5 mL/管。分别用苯酚-硫酸法[9]与紫外分光光度法(λ=280nm)对每管洗脱液中的糖质量浓度和氨基酸质量浓度进行跟踪检测。苯酚-硫酸法测定的标准曲线为A=15.2C-0.0309,相关系数为r=0.997,其中A为吸光度值,C为葡萄糖质量浓度(mg/mL)。以洗脱管数为横坐标,糖质量浓度与280 nm处的A为纵坐标绘制洗脱曲线,如图 1所示。将图 1中的水及0.1、0.5 mol/LNaCl洗脱部分分别合并,减压浓缩至一定体积后,转移至透析袋中透析48h,样品减压浓缩,冷冻干燥,得3个粗多糖亚组分,反复冻溶除去游离蛋白,分别命名为IRPS1、IRPS2、IRPS3,得率(得率=冻干粗多糖质量/上样质量)分别为5.4%、2.7%、2.0%。
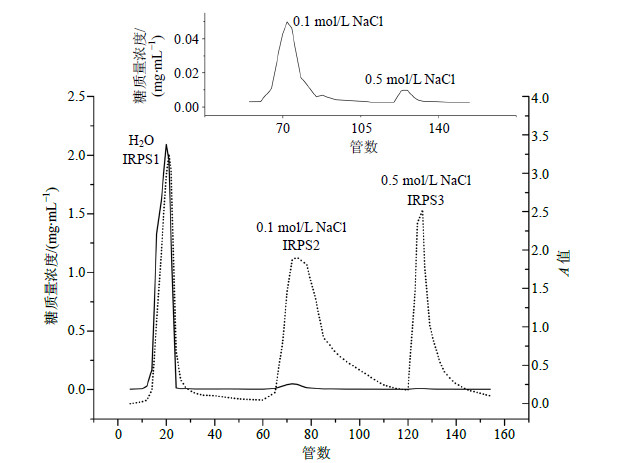 |
实线为多糖质量浓度曲线,虚线为280nm紫外吸收曲线,上方为多糖质量浓度曲线的局部放大图 Solid line is sugar concentration curve.Dotted line is curve of UV absorption at 280 nm.Curves above picture is a partially enlarged view of sugar concentration curve 图 1 80%乙醇醇沉粗多糖的DEAE-Sepharose Fast Flow洗脱曲线Fig.1 Elution curve of crude polysaccharides precipitated by 80% ethanol on DEAE-Sepharose Fast Flow |
取IRPS1 50 mg,水溶解后,上Sephacryl-200聚丙烯胺葡聚糖凝胶柱。以水作为洗脱剂,自动部分收集器收集洗脱馏份,每管3 mL,采用苯酚-硫酸法和凝胶色谱-蒸发光散射检测器(GPC-ELSD,分析条件参见“2.5.1”)进行监测,以糖质量浓度为纵坐标,洗脱管数为横坐标,绘制洗脱曲线见图 2。
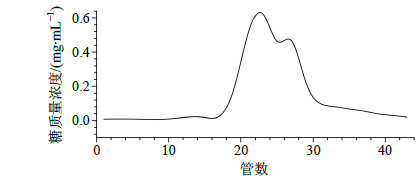 | 图 2 IRPS1的Sephacryl-200洗脱曲线Fig.2 Elution curve of IRPS1A on Sephacryl-200 |
由图 2可以看出,亚组分IRPS1经过Sephacryl-200柱色谱分离纯化后,不同MW的多糖之间仍无法达到完全分离。分别合并18~25管及22~26管溶液进行凝胶色谱测定,发现色谱峰不完全对称。为了得到质量分数更高的均一多糖,对2组合并液再用高效凝胶色谱法进行进一步纯化。以超纯水作为流动相,体积流量0.6 mL/min,色谱柱为TSK-G3000PWXL柱,收集不同时间段的流出物,减压浓缩,冷冻干燥,得板蓝根均一多糖IRPS1A和IRPS1B,产率(产率=冻干均一多糖质量/上样质量)分别为23.5%和20.7%。其凝胶色谱图分别见图 3-A、B。
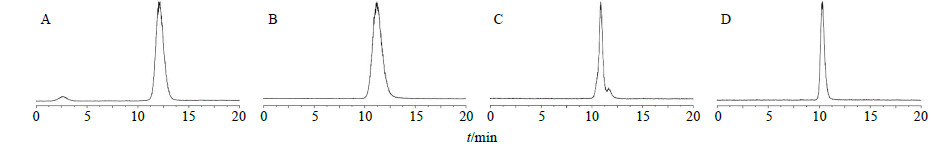 | 图 3 IRPS1A(A)、IRPS1B(B)、IRPS2A(C)与IRPS3A(D)的GPC-ELSD色谱图Fig.3 GPC-ELSD chromatogrms of IRPS1A (A), IRPS1B (B), IRPS2A (C), and IRPS3A (D) |
称取IRPS2或IRPS350 mg,用0.15 mol/LNaCl溶液溶解后,上Sephacryl-200聚丙烯胺葡聚糖凝胶柱。以0.15 mol/L NaCl溶液作为洗脱剂,自动部分收集器收集洗脱馏份,每管约3 mL,透析48 h除盐后,采用GPC-ELSD进行检测,合并MW相同馏份,减压浓缩,冷冻干燥,即得板蓝根均一糖蛋白IRPS2A和IRPS3A,产率(产率=冻干均一糖蛋白质量/上样质量)分别为5.7%和19.8%。其凝胶色谱图分别见图 3-C、D。
2.5 板蓝根多糖(糖蛋白)的MW测定[10]用凝胶过滤色谱法结合ELSD检测器测定多糖组分的MW及其分布。
2.5.1 色谱分析条件色谱柱为TSK-G3000PW柱;流动相为4 mmol/L甲酸铵水溶液;体积流量0.6mL/min;进样量10 μL;ELSD检测温度50 ℃;气体体积流量1.6 L/min。
2.5.2 对照品溶液的配制分别精密称取MW为1000、5000、12000、25000、50000、150000的葡聚糖,配制成质量浓度为10 mg/mL的对照品水溶液。
2.5.3 MW的测定以标准葡聚糖的保留时间(t)为横坐标,MW对数值lgMW为纵坐标,绘制得到标准曲线的回归方程为lgMW=10.038-0.4964t,相关系数r=0.996。将图 3中IRPS1A、IRPS1B、IRPS2A与IRPS3A的t代入回归方程中,计算得到4种均一多糖的MW分别为18 000、31000、36 000和82000。
2.6 板蓝根糖蛋白的氨基酸组成测定 2.6.1 色谱分析条件与方法色谱柱为Zorbax Eclipse-AAA柱(150 mm×4.6 mm,3.5 μm);流动相A为40 mmol/L Na2HPO4,用NaOH溶液调pH至7.8,流动相B为乙腈-甲醇-水(45:45:10),梯度洗脱:0.0~1.9 min,2.0% B;1.9~25.0 min,2.0%~23.7% B;25.0~25.3 min,23.7%~34.9% B;25.3~45.6 min,34.9%~57.0% B;45.6~46.1 min,57.0%~100% B;46.1~49.8 min,100% B;49.8~51.7 min,100%~2.0% B;51.7~53.0 min,2.0% B;体积流量1.0 mL/min;柱温40 ℃;检测波长338、262nm。OPA溶液的配制方法:10 mg OPA溶于1 mL溶液(0.16 mL甲醇+0.14 mL硼酸缓冲液+0.69 mL纯水+0.01 mL 3-巯基丙酸)。硼酸缓冲液的配制方法:首先配制0.1 mol/L硼酸溶液,用0.4 mol/L的NaOH调节pH至10.0。FMOC溶液的配制:10 mg FMOC溶于1 mL乙腈。氨基酸的柱前在线衍生化在高效液相色谱仪自动进样器的定量环中进行。自动衍生程序:抽取硼酸盐缓冲液2.5 μL;抽取样品1.0 μL;混合5次;等待0.2min;抽取OPA溶液1.0 μL;混合10次;抽取FMOC溶液1.0 μL,抽取纯水32 μL,等待0.3 min,进样。
2.6.2 供试品溶液的制备和氨基酸组成测定参考文献方法[11,12,13]对板蓝根糖蛋白IRPS2A与IRPS3A进行酸水解和氨基酸组成测定。水解时间为17 h,水解温度为104 ℃,盐酸浓度为10 mol/L。取1 mL水解液,氮吹至干,加入100 μL纯水复溶,按“2.6.1”项方法进行柱前衍生化HPLC分析。
16种一级氨基酸标样和IRPS2A、IRPS3A的OPA衍生化产物色谱图见图 4,样品中未检测出二级氨基酸脯氨酸。通过单点校正计算得IRPS2A的氨基酸组成(各氨基酸的物质的量之比)为天门冬氨酸-谷氨酸-丝氨酸-组氨酸-甘氨酸-苏氨酸-精氨酸-丙氨酸-酪氨酸-胱氨酸-缬氨酸-苯丙氨酸-异亮氨酸-亮氨酸-赖氨酸(5.1:7.2:5.6:1.4:7.7:3.1:3.5:4.8:1.0:1.8:4.6:1.1:3.2:2.0:1.6)。IRPS3A的氨基酸组成为天门冬氨酸-谷氨酸-丝氨酸-组氨酸-甘氨酸-苏氨酸-精氨酸-丙氨酸-胱氨酸-缬氨酸-苯丙氨酸-异亮氨酸-亮氨酸-赖氨酸(5.2:6.8:3.3:1.6:8.6:3.7:19.6:4.0:1.5:3.0:1.0:1.3:2.7:2.3)。
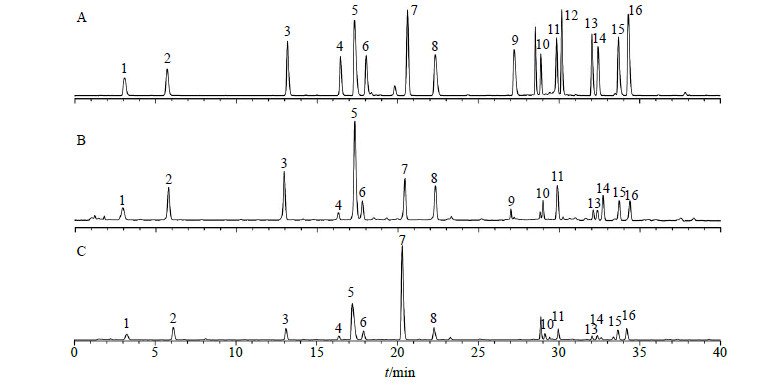 |
1-L-天门冬氨酸2-L-谷氨酸3-L-丝氨酸4-L-组氨酸5-甘氨酸6-L-苏氨酸7-L-精氨酸8-L-丙氨酸9-L-酪氨酸10-L-胱氨酸11-L-缬氨酸12-L-蛋氨酸13-L-苯丙氨酸14-L-异亮氨酸15-L-亮氨酸16-L-赖氨酸 1-L-aspartic acid 2-L-glutamic acid 3-L-serine4-L-histidine 5-glycine 6-L-threonine 7-L-arginine 8-L-alanine9-L-tyrosine 10-L-gysteine 11-L-valine 12-L-methionine13-L-phenylalanine 14-L-isoleucine 15-L-leucine 16-L-lysine 图 4 16种一级氨基酸标样(A)和IRPS2A(B)、IRPS3A(C)的OPA衍生化产物色谱图Fig.4 OPA derivatives chromatograms of 16 kinds of amino acids reference solution (A), IRPS2A (B), and IRPS3A (C) |
色谱柱为Inertsil®ODS-3柱(250 mm×4.6 mm,5 μm);流动相为0.1 mol/L磷酸盐缓冲液(pH6.68)-乙腈(83:17),等度洗脱;柱温30 ℃;检测波长250 nm;体积流量1.0 mL/min;进样体积20 μL。
2.7.2 对照品溶液的制备利用PMP柱前衍生化法对板蓝根多糖的单糖组成进行测定。取1 mL单糖混合对照品溶液(葡萄糖、木糖、甘露糖、阿拉伯糖、半乳糖、半乳糖醛酸、鼠李糖),加入1 mL 0.6 moL/L NaOH溶液,置于10 mL的具塞试管中混合均匀;加入1 mL 0.5 mol/L PMP甲醇溶液,混匀后,置于70 ℃烘箱中加热反应60 min,取出,室温放置10 min;再加入l mL 0.3 mol/L盐酸溶液中和。加3 mL三氯甲烷,振摇,静置,弃去三氯甲烷相,萃取3次。水相用0.45μm微孔膜滤过后进行HPLC分析。配制不同质量浓度的混标溶液,以质量浓度(C,mg/mL)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,结果各单糖的标准曲线分别为甘露糖A=29353C-9.57,r=0.999 4;鼠李糖A=25107C+11.02,r=0.999 2;半乳糖醛酸A=30842C-346.57,r=0.996 3;葡萄糖A=24914C-98.65,r=0.999 1;半乳糖A=31183C-58.89,r=0.999 3;木糖A=31075C-62.47,r=0.999 5;阿拉伯糖A=35545C-84.34,r=0.999 6。
2.7.3 供试品溶液的制备和单糖组成测定分别称取适量的IRPS1A、IRPS1B、IRPS2A与IRPS3A于5 mL安瓿中,加入1 mL水溶解,再加入2 mL 2 mol/L的硫酸溶液,封管,110 ℃烘箱中水解8 h,冷却至室温,加入8 mol/L NaOH溶液,调节pH值约为7。取1 mL水解液于10 mL试管中,按“2.7.2”项方法进行衍生化和测定。单糖混合对照品溶液与水解产物IRPS1A、IRPS1B、IRPS2A、IRPS3A的PMP衍生色谱图见图 5。经计算,IRPS1A单糖组成主要为甘露糖-葡萄糖-半乳糖-阿拉伯糖(2.9:4.8:1.0:23.4);IRPS1B单糖组成为甘露糖-葡萄糖-半乳糖-阿拉伯糖(1.0:3.8:3.0:24.5);IRPS2A单糖组成为半乳糖醛酸-葡萄糖-半乳糖-阿拉伯糖(12.6:27.1:1.9:1.0);IRPS3A单糖组成为甘露糖-鼠李糖-半乳糖醛酸-葡萄糖-半乳糖-阿拉伯糖(2.2:1.0:1.6:13.5:2.3:4.7)。
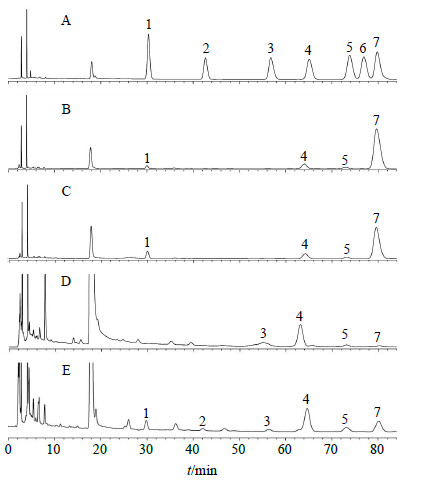 |
1-甘露糖2-鼠李糖3-半乳糖醛酸4-葡萄糖5-半乳糖6-木糖7-阿拉伯糖 1-mannose 2-rhamnose 3-galacturonic acid 4-glucose 5-galactose6-xylose 7-arabinose 图 5 单糖混合对照品(A)与IRPS1A(B)、IRPS1B(C)、IRPS2A(D)、IRPS3A(E)水解产物的PMP衍生色谱图Fig.5 PMP derivative HPLC of mixed reference substances of monosaccharide (A), IRPS1A (B), IRPS1B (C), IRPS2A ( D), and IRPS3A (E) |
板蓝根的抗病毒作用在临床上已被证实[16,17],多糖作为板蓝根入药部位的主要化学物质,其抗病毒的活性及作用机制亦受到广泛关注。然而,板蓝根多糖是组成复杂的混合物,其分离纯化一直是抗病毒活性及机制研究的瓶颈问题。本实验采用系统分离的研究思路,首先将板蓝根药材水提物进行分级醇沉,选择具有较强抗病毒活性的80%乙醇醇沉粗多糖作为分离对象,以降低后续分离纯化的难度。再通过快速离子交换柱色谱,将不带电荷或者带有极少数电荷的多糖成分与带有大量电荷的糖蛋白成分进行初步分离,得到3个亚组分IRPA1、IRPS2与IRPS3。最后,利用快速凝胶色谱柱对各亚组分进行进一步的分离纯化。对于MW接近、但均一性不够的混合部位,则采用分辨率更高的高效凝胶色谱法进一步纯化,最终得到4种均一多糖(糖蛋白)IRPS1A、IRPS1B、IRPS2A、IRPS3A。该系统分离纯化的研究策略也可运用于其他复杂中药多糖的高效制备。
在板蓝根多糖的分离纯化过程中,分离过程的监控十分重要。本实验选用苯酚-硫酸法、紫外分光光度法和高效凝胶色谱法等多种方法进行过程跟踪,可以同时兼顾糖量较高的多糖组分和氨基酸量较高的糖蛋白组分,还可以依据MW的差异进行馏份的切割和合并,从而有效避免单一监测方法的缺陷,提高系统分离的效率和目标产物的均一性。
本实验是在前期研究的基础上[10],选择最优条件对板蓝根多糖进行水解,而后利用柱前衍生化的方法对多糖中的氨基酸残基进行分析。结果表明,IRPS2A含有以甘氨酸为主的15种氨基酸,IRPS3A中包含以精氨酸为主的14种氨基酸,且质量分数较高,故IRPS2A和IRPS3A为板蓝根均一糖蛋白。2种糖蛋白中均未检测出二级氨基酸,所含有的一级氨基酸种类丰富且大致相同。研究过程中还对IRPS1A、IRPS1B的氨基酸残基进行了测定,结果表明IRPS1A、IRPS1B的氨基酸残基总量极低,可能由少量杂质引入,因此IRPS1A、IRPS1B为板蓝根均一多糖。
板蓝根多糖的组成分析已有少量文献报道,马莉等[18]从60%乙醇醇沉板蓝根粗多糖中分离得到4种均由单一木糖组成、MW不同的均一多糖。张体祥等[19]分离得到1种MW为2.24×105,由鼠李糖、果糖、葡萄糖、半乳糖组成的板蓝根均一多糖。陈浩然等[20]从70%乙醇醇沉板蓝根粗多糖分离得到一种MW为11700的均一板蓝根多糖A,其单糖组成为阿拉伯糖和半乳糖。本实验主要研究80%乙醇醇沉板蓝根粗多糖,分离得到的4种均一多糖(糖蛋白)MW为1.8×104~8.2×104,IRPS1A与IRPS1B主要由阿拉伯糖残基构成,同时还含有少量的甘露糖、葡萄糖和半乳糖,糖组成与文献报道[20]相近。板蓝根糖蛋白IRPS2A、IRPS3A中,单糖组成以葡萄糖为主,还含有少量半乳糖醛酸、半乳糖和阿拉伯糖等。
| [1] | 周威. 现代分离分析技术在板蓝根成分分析中的应用研究[D]. 上海:复旦大学, 2012. |
| [2] | 胡晓燕,刘明华,孙琴,等.板蓝根抑菌活性部位的谱效关系研究[J].中草药,2013,44(12):1615-1620. |
| [3] | Du Z, Liu H, Zhang Z, etal. Antioxidant and anti-inflammatory activities of RadixIsatidis polysaccharide in murine alveolar macrophages[J]. Int JBiolMacromol, 2013, 58:329-335. |
| [4] | Yang Z F, Wang YT, Zhao S, etal. In vitro inhibition of influenza virus infection by a crude extract from Isatis indigotica root resulting in the prevention of viral attachment[J]. MolMedRep, 2012, 5(3):793-799. |
| [5] | 杨子峰, 王玉涛, 秦笙, 等. 板蓝根水提物S-03体外抑制甲、乙型流感病毒感染的实验研究[J]. 病毒学报, 2011, 27(3):218-223. |
| [6] | Yamada H. Antiviral compositions containing new glycoprotein from Isatistinctoria:日本, JP, 11-60599[P]. 1999-03-02. |
| [7] | Yang Z F, Hu P, Zhong S, etal. Extraction and separation of polyshccharides from Radixisatidis and their effects towards hemagglutinin protein of influenza virus[J]. AsianJChem, 2015, 27(5):1615-1620. |
| [8] | Reed L J, Muenc H. A simple method of estimating fifty precent endpoints[J]. AmJ Epidemiol, 1938, 27(3):493-497. |
| [9] | 范传颍, 陶正明, 吴志刚. 苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J]. 浙江农业科学, 2013, 1(7):799-801. |
| [10] | 胡坪, 乔晚芳, 沈俊文, 等. 麦冬多糖单糖组成的分析方法研究[J]. 药物分析杂志, 2013, 33(1):50-56. |
| [11] | 胡坪, 陈烨, 杨子峰, 等. 板蓝根糖肽的组成测定[J]. 中成药, 2015, 37(2):336-342. |
| [12] | Roch MC, Harmony MD. Determination of amino acids at subfemtomale levels by high performance liquid chromatography with laserinduced fluorescence detection[J]. AnalChem, 1987, 59(3):411. |
| [13] | Li H, Lee J R, Nguyen D Q A, etal. Quantitative analysis of valiolamine through pre-column derivatization with phenyl isocyanate using high performance liquid chromatography with UV detection:Selection of regent, identification of dervative and opitimization of dervatization conditions[J]. J Pharm Biomed Anal, 2009, 49(4):957-963. |
| [14] | 范刚, 唐策, 李艳, 等. 柱前衍生HPLC分析黄连多糖的单糖组成[J]. 中国实验方剂学杂志, 2014, 20(11):74-78. |
| [15] | Bai W, Fang X, Zhao W, etal. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J]. J Food Drug Anal, 2015, 23(4):645-651. |
| [16] | 马毅敏,李娜,刘承伟,等.板蓝根不同提取部位抗炎镇痛活性比较研究[J].中草药,2014,45(17):2517-2521. |
| [17] | 何立巍,董伟,杨婧妍,等.板蓝根抗病毒有效部位的化学成分及其活性研究[J].中草药,2013,44(21):2960-2964. |
| [18] | 马莉, 唐健元, 李祖伦, 等. 板蓝根多糖分离纯化及其性质研究[J]. 中草药, 2007, 38(8):1143-1146. |
| [19] | 张体祥, 李艳福, 刘婕, 等. 板蓝根多糖分离纯化及其单糖组成研究[J]. 河南工程学院学报, 2009, 21(3):13-17. |
| [20] | 陈浩然, 李祥, 何立巍, 等. 板蓝根多糖A的分离纯化及结构研究[J]. 中国药房, 2009, 20(21):1642-1644. |
 2016, Vol. 47
2016, Vol. 47


