人参Panax ginseng C. A. Mey.、西洋参Panax quinque foliusm L. 和三七Panax notoginseng (Burk.) F. H. Chen为五加科(Araliaceae)人参属重要的药用植物,收载于《中国药典》2015年版[1]。研究表明,人参属植物含有多种化学成分,其中人参皂苷是评价人参属植物品质的重要指标[2],其药理作用包括抗肿瘤[3, 4, 5, 6, 7, 8]、调节血糖[9, 10, 11, 12]、改善心血管功能[13, 14, 15]、抗酒精肝[16]和延缓衰老[17, 18]等。
人参皂苷在人参中分布广泛,存在于植物的各个部位中,但不同部位的人参皂苷量和组成各不相同[19]。人参皂苷可分为3类,分别是以达玛烷型为主的四环三萜类,以齐墩果酸为主的五环三萜类和其他类型,而达玛烷型结构的人参皂苷又分为2类:原人参二醇(PPD)型和原人参三醇(PPT)型。其中原人参三醇型人参皂苷[20]主要包括人参皂苷Re、Rg1等。Quan等[21]发现人参皂苷Re能够通过感应孤儿核受体的小异二聚体伴侣分子(SHP)抑制肝葡萄糖的产生。Liu等[22]在四氧嘧啶糖尿病小鼠实验研究中发现人参皂苷Rg1可在一定的剂量范围内降低糖尿病小鼠的血糖。20(R)-25-羟基-原人参三醇(20(R)-25-OH-PPT,图 1)是本课题组1990年首次从人参茎叶中发现的原人参三醇型新天然产物[23],2008年又从人参果总皂苷水解产物中获得 [24],但人参属植物地上其他部分是否含有20(R)-25-OH-PPT及其测定未见报道。本课题组大量的前期研究结果显示[25],20(R)-25-OH-PPT具有较强的蛋白酪氨酸磷酸酶(PTP1B)和α-葡萄糖苷酶抑制活性,表明人参皂苷20(R)-25-OH-PPT具有一定的降血糖和改善葡萄糖耐量的功能。
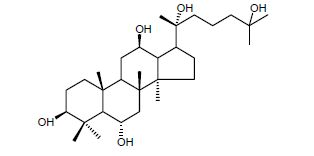
|
图 1 人参皂苷元20(R)-25-OH-PPT的结构 Fig. 1 Chemical structures of ginseng sapogenins 20(R)-25-OH-PPT |
为了寻找20(R)-25-OH-PPT的廉价资源,研制开发防治糖尿病的天然功能食品和创新药物,本实验采用HPLC-ELSD方法,对辽宁产人参属植物不同部位中的20(R)-25-OH-PPT进行了测定,为人参属植物地上资源含有的20(R)-25-OH-PPT综合开发利用提供科学依据。
1 材料 1.1 仪器与试药K-501液相色谱仪(德国诺尔公司);ELSD-6000蒸发光检测器(美国奥泰公司);XWK-34空气压缩机(天津华生分析仪器有限公司);JS-3050色谱工作站(大连江申公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);BS124S型分析天平(北京赛多利斯仪器系统有限公司);数控超声波清洗器 KQ3200DB(昆山市超声仪器有限公司)。丙酮(分析纯,天津市凯信化学工业有限公司);甲醇(色谱纯,天津市康科德科技有限公司);二次蒸馏水(实验室自制)。
1.2 药材人参茎叶总皂苷、人参花总皂苷、人参果总皂苷(批号GL130412)购自辽宁省抚顺市鑫录参茸保健品有限公司;人参根总皂苷(批号 WE130402)、西洋参根总皂苷(批号 AE130420)购自本溪阳光保健品有限公司;三七芦头总皂苷(批号 WE130402)购自云南文山州三七科学技术研究所;西洋参茎叶总皂苷(批号 AL130422)购自大连天马制药有限公司。
2 方法与结果 2.1 色谱条件色谱柱Agilent C18(250 mm×4.6 mm,5 μm);流动相甲醇-水(70∶30);柱温35 ℃;体积流量1.0 mL/min;ELSD气化室温度87.0 ℃,载气体积流量2.20 L/min;进样体积10 μL。
2.2 对照品溶液的制备精密称定10.0 mg对照品20(R)-25-OH-PPT由实验室自制,置于10.0 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密吸取上述溶液1 mL,置于2.0 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成质量浓度为0.5 mg/mL的对照品溶液。
2.3 供试品溶液的制备精密称定人参茎叶、根、花和果总皂苷,西洋参茎叶和根总皂苷、三七芦头总皂苷粉末各1.00 g,分别置于100 mL锥形瓶中,精密加入丙酮50 mL,称定质量,超声处理1 h,冷却至室温,再次称定质量,用丙酮补足减少的质量,摇匀。将上清液减压浓缩后,得到固体产物。精密称取1.50 mg固体产物,置于1.0 mL量瓶中,加甲醇溶解至刻度,摇匀,过0.45 μm微孔滤膜,即为供试品溶液。
2.4 标准曲线的制备精密吸取“2.2”项中对照品溶液1 mL于10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得质量浓度为0.05 mg/mL的对照品溶液,同法制备质量浓度为0.001、0.005、0.01、0.025 mg/mL的标准系列溶液,在“2.1”项色谱条件下测定,记录色谱图。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,进行线性回归计算,线性回归方程Y=1×107 X+28 321,R2=0.999 2,结果表明20(R)-25-OH-PPT在质量浓度为0.001~0.05 mg/mL内线性关系良好。色谱图见图 2。
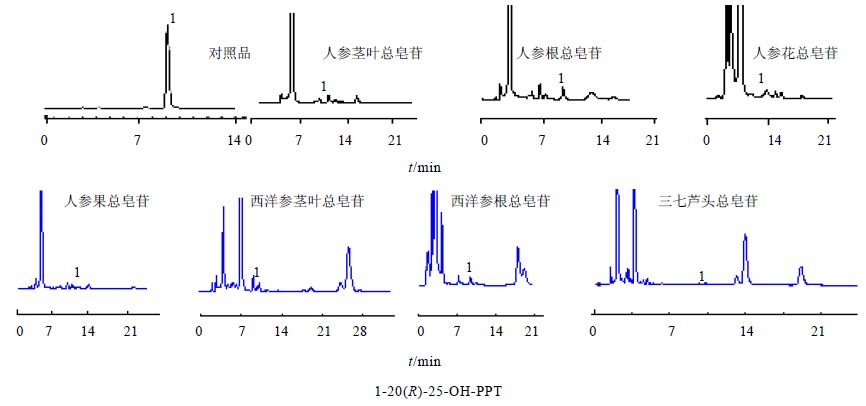
|
图 2 人参属植物不同部位样品色谱图 Fig. 2 Chromatogram of different parts of species of Panax Linn. |
分别取同一对照品溶液,在“2.1”项色谱条件下连续进样6次,记录峰面积,计算其精密度RSD为1.88%,表明仪器精密度良好。
2.6 稳定性试验取同一供试品溶液,室温下放置,分别在0、2、4、6、8、24 h后进样分析,按“2.1”项色谱条件进行测定,记录峰面积,得人参茎叶、根、花和果总皂苷、西洋参茎叶和根总皂苷、三七芦头总皂苷峰面积RSD值分别为1.82%、1.99%、1.92%、1.95%、1.77%、1.78%和1.97%,表明供试品溶液在24 h内稳定性良好。
2.7 重复性试验取同一批人参茎叶、根、花和果总皂苷、西洋参茎叶和根总皂苷、三七芦头总皂苷各6份,按“2.3”项下操作,分别平行制备6份供试品溶液,在“2.1”项色谱条件下进样分析,峰面积的RSD值分别为1.82%、1.97%、1.93%、1.85%、1.96%、1.96%和1.91%,表明方法重复性良好。
2.8 加样回收率试验取已测定的同一批人参茎叶、根、花、果总皂苷,西洋参茎叶和根总皂苷,三七芦头总皂苷各9份,精密称定,分别含20(R)-25-OH-PPT为3.74%、2.59%、0.40%、2.37%、0.68%、0.22%和0.39%,,每3份为一组。分别单独加入1 mL,浓度比分别为0.5∶1、1∶1、1.5∶1的对照品溶液,每次进样10 μL进行测定。计算得人参茎叶、根、花和果总皂苷,西洋参茎叶和根总皂苷,三七芦头总皂苷中20(R)-25-OH-PPT的平均回收率分别为98.54%、97.5 4%、101.46%、100.35%、97.46%、99.14%和99.38%,RSD值分别为1.81%、1.68%、1.76%、1.87%、1.99%、1.84%和1.92%,表明本方法有良好的准确度。
2.9 样品测定取各批次样品,按照“2.3”项下方法制备供试品溶液,采用外标一点法计算,测定7个样品中20(R)-25-OH-PPT的量,其在人参茎叶、根、花和果总皂苷,西洋参茎叶和根、三七芦头总皂苷中的量分别为3.74%、2.59%、0.40%、2.37%、0.68%、0.22%和0.39%。可以看出不同植物的同一部位中,人参茎叶、根总皂苷中20(R)-25-OH-PPT的量分别高于西洋参茎叶、根总皂苷,而在人参中,20(R)-25-OH-PPT的量在人参茎叶、根、花和果的总皂苷中依次递减。
3 讨论人参和其中含有的人参皂苷潜在的降血糖作用得到了广泛的研究和关注。从人参茎叶中发现的新天然产物20(R)-25-OH-PPT自20世纪90年代初至今关于该化合物的生物活性、来源分布及药学方面的研究未见报道。因此,在人参属植物及不同部位中寻找天然存在的20(R)-25-OH-PPT,并开展系统的化学及生物学等方面的研究,对于人参属植物新的药用资源的发现和综合利用及开发20(R)-25-OH-PPT的新医药用途和保健作用将具有重要的社会和经济意义。
本研究表明,20(R)-25-OH-PPT在人参茎叶、人参果及人参根中的量较高,西洋参及三七中的各不同部位量较少。其中廉价的人参茎叶含有高质量分数的20(R)-25-OH-PPT,具有进行深入研究和开发的必要。
蒸发光检测器是一种通用型检测器,只与样品的质量有关,与有无紫外吸收无关。人参皂苷紫外吸收较弱,故本实验采用了HPLC-ELSD法,实现了对20(R)-25-OH-PPT的检测及不同来源的量进行了比较分析和评价,为人参属植物及地上资源的充分开发利用提供了科学依据。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 徐 静, 贾 力, 赵余庆. 人参的化学成分与人参产品的质量评价[J]. 药物评价研究, 2011, 34(3): 199-203. |
| [3] | 刘雅飞, 崔玉娜, 赵余庆. 基于抗肿瘤活性的达玛烷型人参皂苷(元)结构修饰[J]. 中草药, 2013, 44(9): 1203-1210. |
| [4] | 郭军辉, 刘雅飞, 赵余庆. 达玛烷-3β, 12β, 20, 25-四醇及其衍生物的抗肿瘤活性研究进展[J]. 中国药物化学杂志, 2015, 25(1): 66-73. |
| [5] | 赵 琛, 苏光悦, 赵余庆. 人参皂苷及其衍生物抗结肠癌作用及机制的研究进展[J]. 中草药, 2015, 46(16): 2477-2483. |
| [6] | 高文芹, 贾 力, 赵余庆. 人参的抗癌作用及其机制研究进展[J]. 药物评价研究, 2011, 34(1): 53-58. |
| [7] | 刘 娜, 朴虎日, 赵余庆. 原人参二醇及其衍生物的化学与抗癌活性研究进展[J]. 中国药物化学杂志, 2008, 18(5): 384-388. |
| [8] | 张 虹, 付雯雯, 徐华丽. 20(S)-原人参二醇、人参皂苷Rh2及人参皂苷Rg3抗肿瘤作用的对比[J]. 中国老年学杂志, 2014, 10(17): 4911-4913. |
| [9] | 唐伟卓, 赵余庆, 贾 力. 人参和人参皂苷新近研究证明的生物活性和临床用途[J]. 人参研究, 2010, 22(2): 32-38. |
| [10] | 孟凡丽, 苏晓田, 郑毅男. 人参皂苷Rb3对糖尿病模型小鼠的降血糖和抗氧化作用[J]. 华南农业大学学报, 2013, 34(4): 553-557. |
| [11] | 高 钧, 卢守四. 人参皂苷Re促进胰高血糖素样肽-1分泌的研究[J]. 中国药物与临床, 2011, 11(12): 1383-1385. |
| [12] | 胡翠华, 徐华丽, 于晓风, 等. 人参二醇组皂苷对实验性2型糖尿病大鼠血糖及血脂代谢的影响[J]. 吉林大学学报: 医学版, 2006, 32(6): 1004-1008. |
| [13] | 吴红金, 刘宇娜. 人参皂甙Rg1抑制60Co照射诱导心肌细胞凋亡[J]. 医学综述, 2008, 14(21): 3332-3334. |
| [14] | 吴红金, 刘宇娜. 人参皂甙Re对60Co照射诱导心肌细胞凋亡的保护作用[J]. 中西医结合心脑血管病杂志, 2008, 6(8): 923-924. |
| [15] | 张凌志, 邸 菁, 柏树令. 人参皂苷预防大鼠心肌肥大的评价[J]. 中国药理学通报, 2008, 24(2): 233-236. |
| [16] | 李晓宇, 李 晶, 王一博, 等. 人参皂苷对酒精性肝损伤的保护作用研究[J]. 药物评价研究, 2015, 38(5): 512-515. |
| [17] | 李成鹏, 张梦思, 刘 俊, 等. 人参皂苷Rg1延缓脑衰老机制研究[J]. 中国中药杂志, 2014, 39(22): 4442-4447. |
| [18] | 周 玥, 王建伟, 姜 蓉, 等. 人参皂苷Rg1在造血干/祖细胞连续移植中对抗细胞衰老的作用研究[J]. 中国中药杂志, 2013, 38(17): 2848-2853. |
| [19] | 李 闯, 王 义, 张美萍, 等. 人参不同部位皂苷成分的HPLC测定[J]. 吉林中医药, 2010, 30(4): 347-349. |
| [20] | 唐伟卓, 赵余庆. 原人参三醇及其衍生物的药学及其生物活性的研究进展[J]. 人参研究, 2010, 16(3): 20-26. |
| [21] | Quan H Y, Yuan H D, Jung M S, et al. Ginsenoside Re lowers blood glucose and lipid levels via activation of AMP-activated protein kinase in HepG2 cells and high-fat diet fed mice[J]. Inter J Mol Med, 2012, 29(1): 73-80. |
| [22] | Liu L, Liu X D, Liu C, et al. Increased glucagon-like peptide-1 secretion may be involved in ntidiabetic effects of ginsenosides[J]. J Endocrinol, 2013, 217(2): 185-196. |
| [23] | 赵余庆, 袁昌鲁, 傅玉琴. 人参茎叶中微量三萜化合物的化学研究[J]. 药学学报, 1990, 25(4): 299-301. |
| [24] | 王 丹, 柴瑞华, 赵余庆. 人参果总皂苷水解产物中稀有活性皂苷元化学研究[J]. 中国现代中药, 2008, 10(1): 12-14. |
| [25] | Vuksana V, Sievenpipera J L. Herbal remedies in the management of diabetes: Lessons learned from the study of ginseng[J]. Nutr Metab Cardiovasc Dis, 2005, 15: 149-161. |
 2016, Vol. 47
2016, Vol. 47


