2. 安顺学院 贵州省教育厅功能材料与资源化学特色重点实验室, 贵州 安顺 561000
2. Special and Key Laboratory of Functional Materials and Resource Chemistry of Guizhou Provincial Education Department, Anshun University, Anshun 561000, China
白英Solanum lyratum Thunb.是茄科(Solanaceae)茄属Solanum L. 植物,多年生蔓性草本植物,又名毛风藤、白毛藤、毛秀才、毛葫芦。白英全草及根干燥后入药,具有解毒消肿、清热利湿、祛风化痰及抗癌等功效,目前,白英已成为常用抗癌中药,用于治疗宫颈癌[1]、肝癌[2]等癌症。薯蓣皂苷元(diosgenin)是白英中的重要药用成分,是合成甾体激素类药物最理想的基础原料,同时也具有治疗心血管疾病[3]、抗癌[4]、抗炎[5]、调节血脂[6]、抗老化[7]等效果。但大量采挖白英以获得薯蓣皂苷元不符合可持续发展战略。利用发根农杆菌诱导药用植物产生毛状根,进行大量离体培养,从而高效地获得次生代谢产物[8],是药用植物资源可持续利用的有效途径之一。目前,对白英的毛状根诱导还未见报道。本实验利用发根农杆菌C58C1转化白英产生毛状根,建立白英毛状根诱导体系,为高效获得薯蓣皂苷元提供新的途径。
1 材料与仪器样品采自西南大学校园,经邓洪平教授鉴定为白英Solanum lyratum Thunb.植株。发根农杆菌C58C1由本实验室保存,C58C1是根癌农杆菌经过“Disarmed”改造后,保留Helper质粒,导入pRiA4质粒,改造后的C58C1失去使植物长冠瘤组织的能力,成为发根农杆菌。
岛津LC-20AD自动进样高效液相色谱仪,IKA旋转蒸发仪,薯蓣皂苷元对照品(批号512-04-9)购于成都曼彻斯特生物科技有限公司,质量分数大于99.99%。
2 方法 2.1 野生型白英无菌苗的获得 2.1.1 种子萌发取白英种子用40℃水浸泡1 h,自来水常温浸泡24 h解除休眠。75%乙醇消毒30 s,无菌水冲洗3次,升汞消毒10 min,无菌水冲洗4次,接种于MS培养基中25℃暗培养至萌发[9]。
2.1.2 外植体消毒取白英4~5 cm长的顶芽,用洗衣粉水清洗30 min,流水冲洗2 h。在超净工作台上,用75%乙醇浸泡30 s,无菌水冲洗2次,0.1% HgCl溶液浸泡8 min,无菌水冲洗3次,每次5 min。用无菌吸水纸吸去顶芽表面的水分后,接种于MS固体培养基中,14 d后观察污染情况,若未污染则说明消毒彻底,可作为无菌苗进行遗传转化。
2.2 菌种的活化从−80℃超低温冰箱中取出保存的菌株C58C1 200 μL,加入25 mL附加40 mg/L 利福平的YEB液体培养基中,200 r/min,27℃快速震荡培养24 h,复苏菌体。在50 mL附加40 mg/L利福平的YEP液体培养基中加入100 μL上述复苏菌液,200 r/min振荡培养至A600值为0.3左右,加入乙酰丁香酮(AS)至100 μmol/L,相同条件下继续振荡培养至A600值为 0.5左右。将A600值为0.5的菌液分装于10 mL离心管内,4℃、4 000 r/min离心10 min,弃上清液,菌体用等体积的附加100 μmol/L AS的MS液体培养基悬浮培养,继续活化30 min左右后可作为浸染液用于转化。
2.3 白英毛状根的诱导将白英无菌苗叶片切成0.5~1 cm2的小块,用无菌针扎出一些伤口,放入已活化好的菌液中浸泡5~20 d,吸干多余菌液,接种于附加了100 μmol/L AS的MS固体培养基中,27℃黑暗共培养3~6 d,至叶片周围有菌圈出现时,取出叶片,用无菌水洗涤1次,无菌吸水纸吸干后转入附加500 mol/L头孢噻肟钠(Cef)的MS培养基上进行光照除菌培养,每7天更换1次培养基,直至长出毛状根。
2.4 毛状根的培养剪取生长迅速、分枝多的毛状根尖端3~4 cm,在YEB琼脂培养基上暗培养7 d,以确定在植物组织中没有残留农杆菌。除菌彻底后,剪取分枝多的毛状根根尖3~4 cm,接种于含150 mL 1/2 MS液体培养基的250 mL锥形瓶中,110 r/min,27℃摇床暗培养。每10天左右更换1次培养基,培养30 d左右收获毛状根进行分子检测后,选取分支较多且性状稳定的阳性毛状根克隆进行扩大培养。培养45 d时收获毛状根进行薯蓣皂苷元的测定。
2.5 毛状根再生植株的获得利用Ri质粒诱导产生的毛状根易产生再生植株,且多数毛状根诱导再生植株需在培养基中添加激素。但有些植物可不经愈伤组织阶段直接出芽。如烟草毛状根[10]在无激素的培养基上可直接产生大量不定芽。本实验试图验证白英毛状根是否可在无任何外源激素的1/2MS液体培养基中直接出芽,产生再生植株。将10组不同的白英毛状根单克隆分别接种于1/2MS液体培养基中黑暗摇床培养,定时观察记录是否有不定芽长出。
2.6 白英毛状根rolB基因的PCR检测分别取不同单克隆系的毛状根,用试剂盒法提取DNA。采用PCR扩增法以f-VirD1/r-VirD1为引物检测毛状根中VirD1基因,以f-rolb/r-rolb为引物检测rolB基因。f-VirD1为5’-ATGTCGCAAGGAC-GTAAGCCC-3’;r-VirD为5’-GGAGTCTTTCAGC-ATGGAGCA-3’。f-rolb为5’-GCTCTTGCAGTGCT-AGATTT-3’,r-rolb为5’-GAAGGTGCAAGCTACC-TCTC-3’。PCR反应体系为25 μL,依次加入DNA模板1 μL,正、反引物各0.5 μL,dd H2O 10.5 μL,GoTaq® Green Master Mix 12.5 μL。取发根农杆菌活菌液1 μL作为阳性对照,同时进行PCR反应。PCR扩增条件:94℃预变性5 min;94℃变性45 s;55℃退火20 s;72℃延伸30 s;30个循环后72℃延伸10 min。扩增产物于120 V,90 mA下进行0.1%琼脂糖凝胶电泳,然后于凝胶成像系统中保存拍照。
2.7 白英中薯蓣皂苷元的提取取6个在液体培养基中振荡培养45 d的不同白英毛状根单克隆进行薯蓣皂苷元测定。提取方法为超声提取法[11]。将野生型白英根、茎、叶及毛状根60℃烘干至恒定质量,充分研磨后过40目筛,精密称定各单克隆毛状根粉末0.2 g,置于25 mL具塞锥形瓶中,加入95%乙醇10 mL,超声30 min,静止放冷,抽滤,重复操作1次,合并滤液,旋转蒸发乙醇至干。加浓盐酸10 mL,置沸水浴中水解2 h,冷却后用NaOH溶液调节pH至中性,用石油醚(60~90℃)萃取3次,每次50 mL,分别萃取30 min。合并3次所得石油醚,旋转蒸发仪50℃减压蒸干,残渣用甲醇定容至10 mL,0.45 μm微孔滤膜滤过即得。
2.8 薯蓣皂苷元的HPLC测定 2.8.1 色谱条件[12]Symmetry-C18色谱柱(150 mm×4.6 mm,5 μm);流动相为乙腈-三重蒸馏水(93∶7);体积流量为1.0 mL/min;检测波长为210 nm;柱温30℃,进样量为20 μL。
2.8.2 薯蓣皂苷元标准曲线的绘制精确称取薯蓣皂苷元对照品3 mg,用甲醇配制成1 mg/mL的对照品溶液母液,用甲醇稀释,配制为0.1、0.25、0.5、0.75、1 mg/mL的对照品溶液。在210 nm波长下检测薯蓣皂苷元对照品,记录出峰时间和峰面积。以峰面积为纵坐标(Y),以样品质量浓度为横坐标(X),得到薯蓣皂苷元标准曲线的线性回归方程为Y=4 200.1 X-51 232,R2=0.999 9。线性范围为0.1~1.0 mg/mL。
3 结果与分析 3.1 毛状根的诱导 3.1.1 菌液浸染时间对毛状根诱导率的影响外植体在菌液中浸染10 d时,诱导率最高,为83.33%,叶片存活率最高,为93%。浸染时间过长会导致叶片死亡,浸染时间过短则诱导率过低。结果见表 1。
|
|
表 1 菌液浸染时间对毛状根诱导率的影响 Table 1 Effect of different bacteria inoculation time on induction rate of hairy roots |
在诱导毛状根的过程中,外植体要在菌液浸染后与发根农杆菌共培养一段时间,使发根农杆菌的Ri质粒能够转移到植物基因组中,所以共培养的时间对提高转化率是非常重要的。共培养2 d时,外植体周围无菌落长出,进行除菌后培养发根率仅为23.33%。共培养时间为6 d时,外植体上以及外植体周围的培养基上有较多的菌落产生,发根农杆菌大量繁殖对外植体产生了毒害作用,外植体多数死亡。共培养时间为4 d时,外植体周围有少量菌落产生,诱导率最高。在共培养的4 d里,Ri质粒较好地完成了整合和转移,而快速繁殖的发根农杆菌并没有对外植体产生较大的毒害作用,说明发根农杆菌诱导白英毛状根外植体与农杆菌最佳共培养时间为4 d(表 2)。
|
|
表 2 共培养时间对毛状根诱导率的影响 Table 2 Effect of different co-culture time on induction rate of hairy roots |
当Cef的质量浓度低于500 mg/L时,难以达到较好的除菌效果,培养基上有菌落长出且Cef质量浓度越低菌落越多。当抗生素的质量浓度为500 mg/L时除菌效果最好,无菌落长出且诱导率高。当抗生素的质量浓度大于500 mg/L时,外植体褐化,诱导率变低(表 3)。说明Cef的质量浓度为500 mg/L时既能起到良好的抑菌效果,又对毛状根的生长影响较小。
|
|
表 3 抗生素质量浓度对毛状根诱导率的影响 Table 3 Effect of different concentration of antibiotic on induction rate of hairy roots |
白英外植体与C58C1共培养4 d后,光照培养10 d,叶片伤口处开始长出毛状根。诱导产生的毛状根为白色,多分枝,多根毛,无向地性。待毛状根长至3~4 cm时切下,转入附加Cef的MS固体培养基中除菌培养,毛状根生长速度加快。待完全除菌后,切下毛状根3~4 cm处多分枝的根尖段,转入无激素的1/2 MS液体培养基中摇床暗培养,毛状根生长迅速。液体震荡培养45 d时,毛状根生物量明显增多,并出现褐化(图 1),说明毛状根中次生代谢产物已经大量积累,可以收获并进行次生代谢产物量的测定。
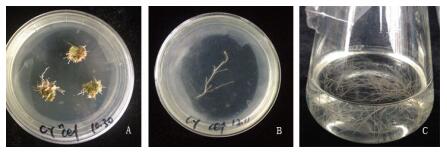 |
A-发根农杆菌诱导外植体产生的毛状根 B-毛状根单克隆 C-液体培养的毛状根 A-hairy roots inducted by A. rhizogenes B-hairy root monoclonal C-hairy roots in liquid medium 图 1 白英毛状根的获得 Fig.1 Hairyroots of S. lyratum |
液体培养15 d左右,毛状根上产生不定芽,将不定芽移至MS固体培养基中光照培养,得到白英毛状根再生植株。再生植株的根无向地性、根毛多、生长旺盛,具有明显毛状根的特性。再生植株长出侧根后,会由侧根处再生出幼苗。由毛状根产生的白英再生植株叶片较野生型白英更加稠密,茎的木质化程度较弱,生长速度明显高于野生型白英(图 2)。
 |
A-液体培养产生的不定芽 B-MS培养基上生长的再生植株 C-生长30 d的再生植株 D-野生型白英无菌苗 A-adventitious bud produced in liquid medium B-regenerated plants growing in MS medium C-regenerated plants grown for 30 d D-aseptic seedling of wild type S. lyratum 图 2 白英毛状根再生植株 Fig.2 Hairy roots regenerated plants of S. lyratum |
以白英野生型无菌苗基因组作为阴性对照,以发根农杆菌C58C1菌液作为阳性对照进行PCR扩增来检测白英毛状根系中的VirD基因和rolB基因。共检测了6个毛状根单克隆系及5个毛状根再生植株,其中均检测到rolB基因的存在(图 3和图 4),而VirD基因未出现阳性。此结果表明,发根农杆菌C58C1中的Ri质粒的T-DNA已被成功整合到白英的基因中,且这6个单克隆系均未被农杆菌污染。
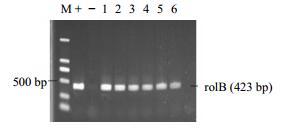 |
M-Marker “+”-阳性对照C58C1菌株 “−”阴性对照野生白英1~6-不同白英毛状根单克隆 M-Marker “+”-C58C1 strain for positive control;“−”-wild type of S. lyratum for negative control 1—6-diferent monoclonal hairy roots of S. lyratum 图 3 白英部分毛状根rolB基因的PCR检测 Fig.3 PCR detection of rolB gene in hairy roots of S. lyratum |
 |
M-Marker “+”-阳性对照C58C1菌株 “−”阴性对照野生白英1~5-不同毛状根再生植株 M-Marker “+”-C58C1 strain for positive control “−”-wild type of S. lyratum for negative control 1—5-diferent hairy rootsin regenerated plants of S. lyratum 图 4 白英部分毛状根再生植株rolB基因的PCR检测 Fig.4 PCR detection of rolB gene in hairy roots regenerated plants of S. lyratum |
取6个培养45 d次生代谢产物充分积累的白英毛状根单克隆系(M1~M6)进行HPLC检测。
同时检测生长了80 d的白英野生型无菌苗根、茎、叶中薯蓣皂苷元的量。检测结果表明,野生型白英无菌苗的叶片中薯蓣皂苷元量最高,为1.742 mg/g(表 4)。生长45 d的白英毛状根中薯蓣皂苷元的量明显高于生长80 d的野生型白英无菌苗。毛状根单克隆系M6中薯蓣皂苷元量最高,为5.280 mg/g,是野生型白英叶片的3.031倍,其每克毛状根中的薯蓣皂苷元的积累效率是白英叶片的5.571倍(表 4)。实验结果表明,通过建立白英毛状根诱导体系,获得的毛状根单克隆系中薯蓣皂苷元的量和积累效率都高于野生型白英,为通过培养毛状根高效率获得薯蓣皂苷元建立了基础。
|
|
表 4 白英植株及毛状根中薯蓣皂苷元的测定 (x±s,n=3) Table 4 Determination of diosgenin in hairy roots and plants of S. lyratum (x±s,n=3) |
白英毛状根的诱导过程中发现,白英叶片较软,易损伤,故浸染和洗涤过程中不能震荡。浸染10 d的转化效果最好,且叶片成活率最高,浸染时间过长或洗涤次数过多都会引起叶片受损死亡。
薯蓣皂苷元是薯蓣皂苷的配基,在植物中主要以薯蓣皂苷的形式与纤维素结合存在于细胞壁中[13, 14],因而需要用酸水解法将薯蓣皂苷元与植物细胞壁分离。实验对比了超声提取法[11]和双向酸水解法,结果表明应用超声处理后再进行酸水解来提取薯蓣皂苷元,提取效率较双向酸水解法更高,提纯效果较好,HPLC检测时峰的分离度较好,无杂峰影响。经对比发现,提取过程中pH的调节非常重要,pH过酸会导致HPLC检测时有杂峰干扰。
本实验成功诱导出白英毛状根,建立了白英毛状根诱导体系,得到了优良毛状根单克隆系。通过对野生型白英根、茎、叶经水解产生的薯蓣皂苷元量的测定,结果表明,诱导得到的毛状根薯蓣皂苷元量及日积累效率均显著高于野生型白英。说明白英毛状根离体培养是一个可以高效获得薯蓣皂苷元的途径。实验得到了M2和M6 2个高产薯蓣皂苷元的毛状根单克隆系,这为进一步利用毛状根诱导遗传稳定的高产薯蓣皂苷元的再生植株奠定了基础。毛状根液体培养过程中获得了再生植株。与野生型白英植株相比,再生植株叶片稠密,茎较粗壮、茎间距缩短,木质化程度减弱,须根发达,少数再生植株有叶片起皱现象。由毛状根直接产生的再生植株遗传稳定性较好,成活率高,但获得不定芽数量较少,耗时长。所以如何利用毛状根短时间内再生大量遗传稳定的植株将是下一步需要研究的方向。
| [1] | 吴婉莹, 高志刚, 李石谷. 白英和欧白英的化学成分与药理活性[J]. 国外医药:植物药分册, 2001, 16(6):245-247. |
| [2] | 单长民, 胡娟娟, 杜冠华. 白英提取物诱导人肝癌BBL-7404细胞凋亡作用[J]. 中国临床药理学与治疗学, 2001, 6(3):200-203. |
| [3] | Liu K, Zhao W, Gao X, et al. Diosgenin ameliorates palmitate-induced endothelial dysfunction and insulin resistance via blocking IKKβ and IRS-1 pathways[J]. Atherosclerosis, 2012, 223(2):350-358. |
| [4] | Gao L L, Li F R, Jiao P, et al. Paris chinnesis dioscin induces G2/M cell cycle arrest and apoptosis in human gastric cancer SGC-7901 cells[J]. World J Gastroenterol, 2011, 39(17):4389-4395. |
| [5] | Jung D H, Park H J, Byun H E, et al. Diosgenin inhibits macrophage-derived inflammatory mediators through downregulation of CK2, JNK, NF-κB and AP-1 activation[J]. Int Immunopharmacol, 2010, 10(9):1047-1054. |
| [6] | Son I S, Kim J H, Sohn H Y, et al. Antioxidative and hypolipidemic effects of diosgenin, a steroidal saponin of yam(Dioscorea spp.) on high-cholesterol fed rats[J]. Biosci Biotechnol Biochem, 2007, 71(12):3063-3071. |
| [7] | Tada Y, Kanda N, Haratake A, et al. Novel effects of diosgenin on skin aging[J]. Steroids, 2009, 74(6):504-511. |
| [8] | Hamill J D, Parr A J, Rhodes M J C. New routes to plant secondary products[J]. Biol Technol, 1987, 5(4):800-804. |
| [9] | 张鸿, 张显强, 罗正伟, 等. 曼陀罗种子萌发及植株再生[J]. 中草药, 2012, 43(12):2499-2502. |
| [10] | 侯丽丽, 施和平, 余武, 等. 烟草毛状根多倍体诱导及植株再生[J]. 生物工程学报, 2014, 30(4):581-594. |
| [11] | 周浓, 郭吉芬, 杨丽云, 等. HPLC检测不同采收时期滇重楼中薯蓣皂苷元的含量[J]. 中国实验方剂学杂志, 2010, 16(18):54-56. |
| [12] | 林世和, 易艳东, 肖宏, 等. 白英不同药用部位不同生长期薯蓣皂苷元含量分布规律的研究[J]. 中国药房, 2012, 23(27):2544-2545. |
| [13] | 杨红英, 孙长山, 马龄, 等. RP-HPLC-ELSD法同时测定白英中蜀羊泉次碱、薯蓣皂苷元和氢化勒帕茄次碱[J]. 中草药, 2010, 41(3):481-483. |
| [14] | 宋发军. 甾体药物源植物薯蓣属植物中薯蓣皂苷元的研究及生产状况[J]. 中成药, 2003, 25(3):232-234. |
 2016, Vol. 47
2016, Vol. 47


