2. 浙江省医学科学院 浙江省实验动物与安全性研究重点实验室, 浙江 杭州 310013
2. Zhejiang Key Laboratory of Experimental Animal and Safety Evaluation, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China
流行性感冒(流感)是由流感病毒感染引起的常见呼吸道急性传染病,在全球曾发生多次大流行,造成数百万人死亡[1]。由于流感病毒的变异性强,特异针对性的化学药品极易产生耐药性和副作用,难以满足临床防治需求。而中药抗病毒疗效显著,不良反应少,具有多组分、多靶点作用特点,对防治流感具有独特优势[2]。
石荠苧Mosla scabra (Thunb.)C.Y.Wu etH.W.Li为唇形科(Labiatae)植物,为江浙地区常用中草药,在我国分布广泛、资源丰富,具有清热解毒、理气化痰的功效,主治流行时疫、痰湿内蕴、疮毒和慢性支气管炎等症。前期研究发现石荠苧水提物以及从石荠苧中分离得到的黄酮类化合物均具有较好的抗流感病毒效果[3,4,5]。
微小核糖核酸(microRNAs,miRNAs)是近年来发现的一类由20~24个核苷酸组成的非编码RNA,其可通过与靶基因的mRNA互补结合,在转录后水平调节mRNA的翻译,来抑制靶基因的表达,参与人体代谢、免疫、肿瘤等生理病理进程[6]。Choi等[7]的研究发现,小鼠感染流感病毒后,体内miRNAs的表达平衡会遭到破坏;而以miRNA为治疗靶点,使之重新恢复正常平衡,则可降低流感病毒造成的小鼠死亡率。miRNAs的正常表达,影响着流感疾病的发展过程;而抗流感药物是否通过调整miRNAs的正常表达起到抗流感作用的研究未见报道。本研究通过高通量测序法,观察和验证石荠苧总黄酮对流感病毒感染模型小鼠肺组织中miRNAs表达丰度的影响;基于miRNAs角度,通过生物信息学方法,探讨石荠苧总黄酮所能涉及的信号通路,进而阐明石荠苧总黄酮抗流感病毒性肺炎的可能机制,为新药研发提供依据。
1 材料 1.1 实验动物和病毒株雄性ICR小鼠,清洁级,体质量18~22 g,由浙江省实验动物中心提供,实验动物生产许可证号SCXK(浙)2014-0001。
甲型流感病毒小鼠肺适应株A/PR/8/34(H1N1),由浙江省疾病预防控制中心病毒所提供;10日龄SPF级鸡胚,由浙江省农业科学院提供。实验在浙江省医学科学院ABSL2生物安全实验室进行。
1.2 药品与试剂石荠苧全草采自浙江省临安市西天目山,经浙江中医药大学中药资源教研室张水利教授鉴定为石荠苧Mosla scabra (Thunb.)C.Y.Wu et H.W.Li干燥全草。石荠苧总黄酮由浙江省医学科学院药物所提取制备,并进行质控[8]。RNA质检试剂盒(Agilent,美国);动物RNA纯化试剂盒(LC Science,美国);Trizolreagent(Invitrogen,美国);高通量测序试剂盒(Illumina,美国)。白细胞介素-6(IL-6)、γ干扰素(IFN-γ)试剂盒(上海拜沃生化科技有限公司)。
1.3 实验仪器ClassII Type/A/B2生物安全柜(Beker,美国);Hiseq 2500高通量测序仪(Illumina,美国);Bioanalyzer 2100生物分析仪(Agilent,美国);Qubit 2.0核酸定量仪(Life technologies,美国);荧光定量PCR仪、ChemiDocXRS+化学发光凝胶成像系统(BIO-RAD,美国)。
2 方法 2.1 病毒增殖取5枚10日龄鸡胚,照检,在气室与胚胎面交界处避开血管做一标记。用75%酒精消毒标记及周围,并在标记处用钻蛋机小心钻一小孔。用注射器吸取0.15 mL流感病毒液,45度角刺入壳膜少许注入病毒液,用石蜡封口,置37 ℃恒温箱孵育72 h。收获前将鸡胚置4 ℃冰箱过夜,使鸡胚死亡,血液凝固。取出鸡胚,用无菌镊子撕破鸡胚气室蛋壳,移液管吸取鸡胚尿囊液置于冻存管分装,备用。
2.2 实验分组和造模90只ICR小鼠,按体质量从中随机分出30只作为对照组,将剩余60只小鼠采用乙醚轻度麻醉,以10倍LD50流感病毒滴鼻感染小鼠,每只20 μL。小鼠出现体质量减轻、活动减少、耸毛等感染状态即说明造模成功。将造模成功后的小鼠,按体质量随机分为模型组和石荠苧总黄酮给药组,每组30只。
2.3 给药取石荠苧总黄酮冻干粉,以10%聚山梨酯-80溶液溶解,配制成溶液。石荠苧总黄酮组每次按照150 mg/kg(按提取物中总黄酮量换算,相当于临床成人常用剂量)给药,对照组和模型组给予等体积的10%聚山梨酯-80溶液,各组于造模前预先ig给药3 d,造模后继续给药5 d至实验结束。
2.4 样本采集和处理各组小鼠于造模第1、3、5天,给药后2 h,随机取10只小鼠摘眼球放血处死(处死前12 h禁食不禁水)。留取各组小鼠血液,分离血清,检测细胞因子IL-6、IFN-γ水平。处死小鼠迅速解剖,摘取小鼠肺组织,生理盐水冲洗,吸干表面水分,称质量,计算肺指数,即肺质量与体质量比值。
同上述条件,取造模第5天的小鼠肺组织样品,置-80 ℃保存备用。
2.5 miRNAs的高通量测序、筛选及验证按照RNA提取试剂盒说明,提取造模第5天的小鼠肺组织总RNA,凝胶电泳纯化长度为18~30 nt的sRNA,经cDNA合成、PCR扩增后,依据Illumina高通量测序试剂盒的要求操作,进行高通量测序分析[9]。根据测序结果分析处理,滤去非目标序列,对照组、石荠苧总黄酮组分别与模型组进行比较,筛选Absolute Fold change[log2(A组/B组)]为2.0倍以上的miRNAs;并采用实时荧光定量PCR技术[10],检测各组小鼠肺组织中差异表达miRNAs的丰度。
2.6 靶基因预测及分析采用miranda、mirbase和targetscan3个数据库对Absolute Fold change超过2.0倍的miRNAs的靶基因进行预测,最终取预测结果的交集作为目标miRNAs的靶基因;采用cytoscape软件,结合以上信息,构建网络关系图;应用kyoto encyclopedia of genes and genomes(KEGG)对靶基因进行信号通路分析。
2.7 Westernblotting检测小鼠肺组织相关蛋白的表达取各组小鼠肺组织样本适量,加入蛋白提取试剂,4 ℃匀浆,冰浴裂解30 min,12000 r/min离心10 min,收集上清,即为肺组织总蛋白。采用考马斯亮蓝法测定蛋白浓度。取50μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜,室温孵育1 h,加一抗4 ℃过夜,TBS溶液洗膜3次,再加入HRP标记的二抗及HRP标记的抗生物素抗体,室温孵育膜1 h,TBS溶液洗膜3次;洗完膜稍干后,加入AB显影液,在化学发光成像仪上显影,计算目的蛋白与内参蛋白β-actin条带灰度的比值。
2.8 数据处理实验数据以x±s表示,采用SPSS 17.0统计分析软件进行统计学处理,进行单因素方差分析,多重比较采用LSD法;方差不齐采用非参数秩和检验。
3 结果 3.1 小鼠肺指数及细胞因子测定结果各组小鼠肺指数测定结果见表 1,在接种流感病毒第1天,可见各组肺指数差异不大,无显著性变化;感染后第3天,模型组与对照组相比,肺指数明显升高,差异显著(P<0.01);感染后第5天,模型组肺指数显著高于对照组(P<0.01),石荠苧总黄酮组肺指数显著低于模型组(P<0.05);说明石荠苧总黄酮对流感病毒所致小鼠肺指数增加具有一定抑制作用。小鼠血清中各时间点细胞因子IL-6和IFN-γ水平结果见图 1,小鼠感染后第1天,各组细胞因子水平无显著差异;感染第3天,模型组与对照组相比,IL-6和IFN-γ水平显著升高(P<0.05),石荠苧总黄酮组与模型组相比,IL-6水平显著降低(P<0.05),IFN-γ水平显著升高(P<0.05);感染后第5天,模型组IL-6和IFN-γ水平显著高于对照组(P<0.01),同时,石荠苧总黄酮组与模型组相比,IL-6和IFN-γ水平均得到抑制,具有显著差异(P<0.05、0.01);说明石荠苧总黄酮能够抑制流感病毒所致的小鼠血清IL-6水平升高,调节IFN-γ的水平。
| 表 1 石荠苧总黄酮对流感病毒感染小鼠肺指数的影响 Table 1 Effects of FMS on lung index of mice infectedwith influenza virus H1N1 |
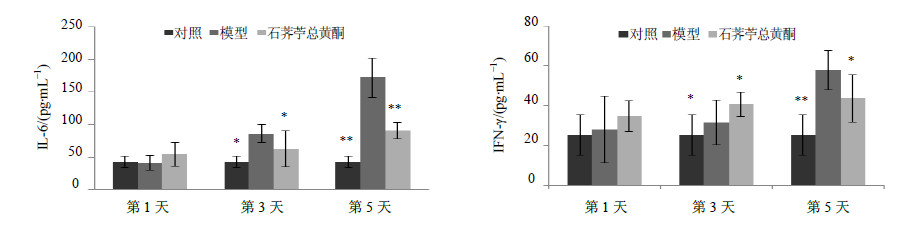 | 图 1 石荠苧总黄酮对流感病毒感染小鼠血清中IL-6和IFN-γ水平的影响(x± s , n = 10)Fig.1 Effects of FMS on cytokine levels of IL-6 and IFN-γ in serumof mice infected with influenza virus H1N1(x± s , n = 10) |
感染流感病毒后,小鼠肺组织中miRNAs表达变化同时满足log2(模型组/对照组)和log2(模型组/石荠苧总黄酮组)同为正值或同为负值,且绝对值大于2.0的差异miRNAs有35种,几个关键miRNAs表达情况见表 2。其中有12种miRNAs表达下调,且给予石荠苧总黄酮后,这些差异miRNAs的表达得到提升;有23种miRNAs的表达在感染流感病毒后升高,给予石荠苧总黄酮后,可以下调这些miRNAs的表达。说明石荠苧总黄酮对感染小鼠肺组织内miRNAs的表达,具有一定调整作用。
| 表 2 小鼠肺组织几个关键miRNAs表达差异情况 Table 2 Key difference of miRNAs expression in lung tissue |
通过miranda、mirbase和targetscan 3个数据库对筛选出的差异miRNAs进行靶基因预测,得到3个数据库预测靶基因重叠部分的452个靶基因。
通过cytoscape软件绘制信号通路的miRNAs-gene调控网络图,如图 2所示,以网络调控图中miRNAs所调控的基因数目,对调控网络中miRNAs进行等级(degree)评价,调控基因数目越多,等级越高。由图 2可知,在调控网络图中,miRNA-449a-5p、miRNA-369-3p、miRNA-465-5p为核心miRNAs。
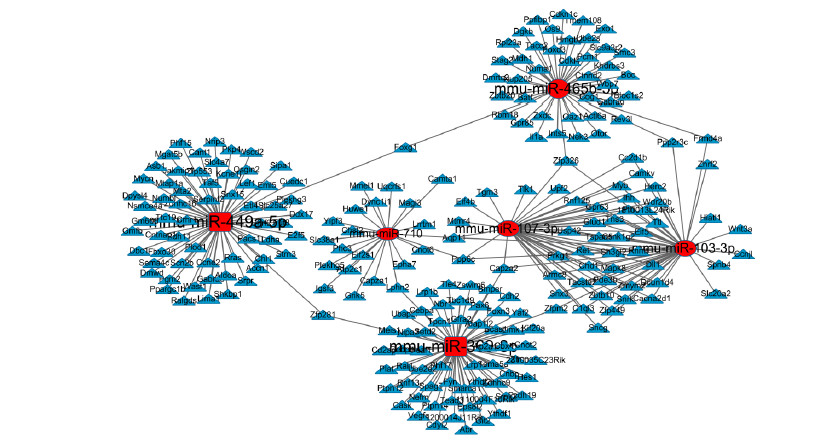 | 图 2 差异miRNAs-gene网络调控图Fig.2 Network diagram of differences of miRNAs-gene |
KEGG是经典的生化代谢路径数据库之一,包含19个高度相关的数据库[11];通过KEGG通路分析富集评分,可构建相关基因的信号通路图。通过DAVID程序对上述差异miRNAs进行KEGG通路分析,预测靶基因富集的生物学通路[12],发现上述差异miRNAs主要参与JAK-STAT通路、TLR3信号通路、趋化因子等炎症相关信号通路(图 3)。其中,有背景标记的基因为数据库预测得到的石荠苧总黄酮诱导miRNAs可能作用的靶基因。
 | 图 3 石荠苧总黄酮抗流感效应的miRNAs/TLR3调控通路Fig.3 miRNAs/TLR3 signal pathway of FMS with anti-influenza efficiency |
根据KEGG通路分析结果,采用Western blotting法,对靶基因的表达情况进行验证,结果见图 4。与对照组相比,模型组中可见蛋白TLR3、STAT3、p65的表达显著增加(P<0.05、0.01);而石荠苧总黄酮组的相关蛋白表达与模型组相比有降低的趋势,蛋白表达水平接近对照组。与对照组相比,PDCD4的表达在模型组中有所降低(P<0.05),给予石荠苧总黄酮治疗后,可见其表达水平升高,证明石荠苧总黄酮诱导产生的miRNAs影响预测靶基因的蛋白表达。
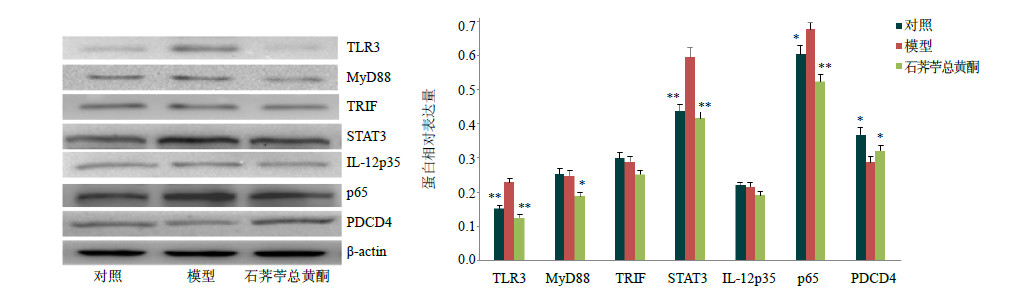 | 图 4 各组小鼠肺组织TLR3通路相关因子的蛋白表达情况 (x± s , n = 10)Fig.4 Protein expression of related factors in TLR3 pathway in lung tissues of mice in each group (x± s , n = 10) |
现代医学研究表明,流感病毒侵入呼吸道后,在黏膜上皮细胞内复制、感染,刺激组织细胞产生免疫应答,释放免疫因子,而过度的宿主免疫反应,却引起了一系列的肺部病理性炎症损伤[13],这也是流感病毒感染导致死亡的重要原因。中药在抗流感方面有其独特优势,因其不仅能直接作用于病毒,抑制其增殖,更重要的是能够调节宿主免疫反应,减轻炎症病理损伤,大大减少流感病毒性肺炎的发生[14]。黄酮类化合物是中药比较常见的有效成分之一,已有文献报道[15],黄酮类化合物具有抗炎、调节免疫活性,且其抗炎、调节免疫的活性主要表现在对炎症因子的调节上[16]。前期研究[17]发现石荠苧总黄酮可通过下调小鼠炎症信号,抑制脂多糖诱导的急性肺损伤。本研究也证实,石荠苧总黄酮可有效抑制流感病毒引起的小鼠肺水肿,减轻流感病毒引起的炎症损伤。
miRNAs在疾病的发生和发展过程中扮演着重要角色,与肺内炎性反应、肺癌、肺纤维化等肺部疾病的发生和发展密切关联[18]。本研究以小鼠构建流感病毒感染模型,通过高通量测序,发现流感病毒确能引起小鼠肺内miRNAs的异常表达,而给予石荠苧总黄酮治疗后,能够改善miRNAs异常表达的情况。Wang等[19]研究表明,miRNAs或其靶基因参与调控了鸡对禽流感病毒感染的反应。近年来的研究证实,miRNAs可通过靶向免疫系统中关键信号传导分子的表达,参与调控机体的免疫应答[20]。将筛选出的差异miRNAs进行靶基因预测,并进行KEGG通路分析,发现其主要参与JAK-STAT通路、TLR3信号通路、趋化因子等炎症相关信号通路;继而蛋白免疫印迹的结果证实,石荠苧总黄酮可有效抑制相关炎症信号通路关键蛋白的表达。因此,推测石荠苧总黄酮有可能通过调节流感病毒感染小鼠体内miRNAs的表达,而调控机体的免疫应答反应,减少宿主免疫引起的肺损伤,进而发挥抗流感病毒性肺炎的作用。
| [1] | Butler D. Caution urged for mutant flu work[J]. Nature, 2011, 481(7382):417-418. |
| [2] | 李湘潋, 刘叔文, 杨洁. 茶黄素衍生物抗甲型流感病毒的作用研究[J]. 中草药, 2013, 44(7):2437-2441. |
| [3] | 余陈欢, 俞文英, 钟宇森, 等. 石荠苧属植物化学成分及药理活性研究概况[J]. 中华中医药学刊, 2013, 31(8):1700-1704. |
| [4] | Wu Q F, Yu C H, Yan Y L, et al. Antiviral flavonoids from Mosla scabra[J]. Fitoterapia, 2010, 81(5):429-433. |
| [5] | Yu C H, Yan Y L, Wu Q F, et al. Anti-influenza virus effects of the aqueous extract from Mosla scabra[J]. J Ethnopharmacol, 2010, 127(2):280-285. |
| [6] | Schirle N T, Sheu-Gruttadauria J, MacRae I J. Structural basis for microRNA targeting[J]. Science, 2014, 346(6209):608-613. |
| [7] | Choi E J, Kim H B, Baek Y H, et al. Differential microRNA expression following infection with a mouse-adapted, highly virulent avian H5N2 virus[J]. BMC Microbiol, 2014, 14(1):252. |
| [8] | 余陈欢, 藏家娜, 方杰, 等. 石荠苧总黄酮的大孔树脂吸附纯化及其体外抑菌活性研究[J]. 中华中医药学刊, 2014, 32(7):723-726. |
| [9] | Hammond S, Swanberg J C, Polson S W, et al. Profiling conserved microRNA expression in recombinant CHO cell lines using illumina sequencing[J]. Biotechnol Bioengin, 2012, 109(6):1371-1375. |
| [10] | 许长娣, 梅娟娟, 李丹, 等. microRNA在卵清蛋白诱导的支气管哮喘小鼠模型中的表达[J]. 实用儿科临床杂志, 2012, 27(21):1655-1657. |
| [11] | Sultana K Z, Bhattacharjee A, Jamil H. Querying KEGG pathways in logic[J]. Inter J Data Min Bioinf, 2014, 9(1):1-21. |
| [12] | 方杰, 胡毅翔, 应华忠, 等. 米碎花药效微小核糖核酸的鉴定及其靶基因功能分析[J]. 中草药, 2015, 46(1):80-85. |
| [13] | Kok W L, Denny L, Benam K, et al. Invariant NKT cells reduce accumulation of inflammatory monocytes in the lungs and decrease immune-pathology during severe influenza A virus infection[J]. J Leuk Biol, 2012, 91(3):357-368. |
| [14] | 王羽侬, 金叶智, 董莹莹, 等. 黄芩及其成分抗流感病毒感染的实验研究进展[J]. 现代生物医学进展, 2014, 14(27):5365-5369. |
| [15] | González R, Ballester I, López-Posadas R, et al. Effects of flavonoids and other polyphenols on inflammation[J]. Crit Rev Food Sci Nut, 2011, 51(4):331-362. |
| [16] | 刘维, 孙淳, 吴沅皞. 黄酮类中药单体成分治疗类风湿性关节炎作用机制研究进展[J]. 中草药, 2014, 45(19):2878-2882. |
| [17] | Chen J, Wang J B, Yu C H, et al. Total flavonoids of Mosla scabra leaves attenuates lipopolysaccharide-induced acute lung injury via down-regulation of inflammatory signaling in mice[J]. J Ethnopharmacol, 2013, 148(3):835-841. |
| [18] | 王晓曈, 谢婷, 李翼飞, 等. MicroRNA与肺部疾病[J]. 国际病理科学与临床杂志, 2011, 31(5):457-460. |
| [19] | Wang Y, Brahmakshatriya V, Lupiani B, et al. Integrated analysis of microRNA expression and mRNA transcriptome in lungs of avian influenza virus infected broilers[J]. BMC Genomics, 2012(13):278-292. |
| [20] | 朱清源, 戈宝学. microRNA与免疫调控[J]. 现代免疫学, 2011, 31(2):89-92. |
 2016, Vol. 47
2016, Vol. 47


