2. 江苏省中医药研究院 中药代谢组研究室, 江苏 南京 210028
2. Department of Metabolomics, Jiangsu Province Academy of Traditional Chinese Medicine, Nanjing 210028, China
膏方是一种将中药饮片长时间提取,去渣取汁,再经较长时间的蒸发浓缩后,加糖或蜂蜜制成的半流体状剂型[1]。膏方的较长时间提取多依据古书记载,或是数千年实践经验的总结,并未有详实的科学依据,现代研究中也未有关于提取和浓缩时间的系统研究报道。给膏方长时间提取和浓缩赋予科学的诠释,对膏方的继承和创新具有重要意义。
琼玉膏最早记载于宋•洪遵《洪氏集验方》,由地黄(生)Rehmanniae Radix、茯苓Poria和人参Ginseng Radix et Rhizoma以质量比7∶2∶1组成,具有填精补髓、血化为筋、万神俱足、五脏盈溢的作用。现代中医临床将琼玉膏用于肺癌化疗的辅助治疗[2, 3]。传统琼玉膏提取和浓缩时间可达7 h之久,但如此长时间提取、浓缩对琼玉膏的品质有何影响未见报道。
本实验前期研究表明,琼玉膏的主要成分包括环烯醚萜苷、苯乙醇苷、糠醛衍生物、三萜酸和人参皂苷等[4, 5],文献报道这些成分具有降血糖、保肝、抗贫血、抗肿瘤、免疫调节等活性[6, 7, 8]。本研究拟以琼玉膏中5-羟甲基糠醛[5-hydroxymethyl furfural(5-HMF)]、梓醇(catalpol)、密力特苷(melittoside)、毛蕊花糖苷(acetoside)、人参皂苷Re(ginsenoside Re,Re)、人参皂苷Rb1(ginsenoside Rb1,Rb1)、人参皂苷20(S)-Rg3[ginsenoside 20(S)-Rg3,20(S)-Rg3]、人参皂苷Rg1(ginsenoside Rg1,Rg1)、人参皂苷Ro(ginsenoside Ro,Ro)、茯苓酸(pachymic acid)10种代表性生物活性成分为指标,采用前期建立的HPLC-TQ-MS法[5],测定不同提取、浓缩时间琼玉膏样品中这10种代表性生物活性成分的质量分数变化,探讨提取、浓缩时间对琼玉膏内在品质的影响规律和相关机制,为琼玉膏现代生产工艺和质量控制研究提供科学依据。
1 仪器与材料Waters 2695高效液相色谱仪,Micromass Quattro-MicroTM三重四级杆质谱仪,美国Waters公司;Mettler十万分之一和百万分之一电子天平,瑞士Mettler公司;Milli-Q型纯水器,美国Millipore公司;500 mL可调温电热套,南通市通州申通电热器厂。
甲醇、乙腈为色谱纯,水为超纯水,其他试剂为分析纯。对照品5-HMF(批号140919)、梓醇(批号201004)、毛蕊花糖苷(批号141120),购自四川维克奇生物科技有限公司;对照品Re(批号MUST-11041201)、Rb1(批号MUST-11042801)、20(S)-Rg3(批号MUST-11041211)、Rg1(批号MUST-11041201)、Ro(批号MUST-12010503),茯苓酸(批号MUST-14110412),购自成都曼思特生物科技有限公司;对照品密力特苷,由丹麦科技大学Soren Rosendal Jensen教授所赠;以上对照品经HPLC测定质量分数均≥98%。
地黄(生)(编号JSPACM-26-04,批号1412049)、茯苓(编号JSPACM-33-01,批号1410124)、人参(编号JSPACM-03-98,批号1412090),购自四川新荷花中药饮片股份有限公司,经江苏省中医药研究院李松林研究员依据《中国药典》2015年版鉴定,分别为玄参科植物地黄Rehmannia glutinosa Libosch. 的干燥块根饮片,多孔菌科真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核饮片,五加科植物人参Panax ginseng C. A. Mey. 的干燥根和根茎饮片。药材标本现保存于江苏省中医药研究院中药质量和代谢组研究室。
2 方法与结果 2.1 混合对照品溶液的制备分别精密称定各对照品,用甲醇配制得对照品储备液(5-HMF 1.11 mg/mL、梓醇1.43 mg/mL、密力特苷1.21 mg/mL、毛蕊花糖苷1.36 mg/mL、Re 1.24 mg/mL、Rb1 1.07 mg/mL、20(S)-Rg3 1.04 mg/mL、Rg1 1.11 mg/mL、Ro 1.57 mg/mL、茯苓酸1.92 μg/mL)。分别吸取对照品储备液各40 μL,加800 μL纯水稀释,得到10个成分质量浓度分别为37.00、47.67、40.33、45.33、41.33、35.67、34.67、37.00、52.33、0.06 μg/mL的混合对照品工作液,4 ℃冷藏,待分析。
2.2 不同提取时间琼玉膏样品的制备按处方精密称取地黄(生)14.00 g、茯苓4.00 g、人参2.00 g,共27份,分9组(G1~G9),每组平行3份,先加200 mL纯水浸渍0.5 h,再分别回流提取1、2、3、4、5、6、7、8、9 h,提取1次,趁热滤过得27份琼玉膏水提液,冷却,分别吸取水提液1 mL,加3 mL甲醇,静置过夜,取上清液离心,各取500 μL滤液,加625 μL纯水稀释,过0.22 μm微孔滤膜,4 ℃冷藏,待分析。
2.3 不同浓缩时间琼玉膏样品的制备量取5 h琼玉膏水提液300 mL,于水浴分别浓缩1、2、3、4、5 h,每个时间点重复3份样品,放入干燥器中冷却0.5 h,分别称取一定量琼玉膏,按比例加水稀释,取稀释后的溶液1 mL,按“2.2”项样品处理方法进行前处理,4 ℃冷藏,待分析。
2.4 色谱-质谱条件 2.4.1 色谱条件参照本实验室前期建立的定量测定方法[5]。Agilent Poroshell 120EC-C18色谱柱(100 mm×3.0 mm,2.7 μm,美国Agilent公司),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱:0~10 min,3% B;10~20 min,3%~28% B;20~25 min,28%~30% B;25~35 min,30%~33% B;35~50 min,33%~40% B;50~68 min,40%~90% B;68~75 min,90% B;体积流量0.4 mL/min,柱温35 ℃,自动进样器温度10 ℃,进样量10 μL。
2.4.2 质谱条件Micromass Quattro-MicroTM三重四级杆质谱仪(美国Waters公司),电喷雾电离(ESI),选择离子扫描模式(SIR),基于分析物的保留时间和离子化模式选择7个时间段和8个通道,在单一的色谱上运行,相应的电离模式,选择的监测离子和每个分析物锥电压参照文献报道[5]。毛细管电压设为3 kV,去溶剂化气体的体积流量为400 L/h,温度为400 ℃,锥孔气体体积流量40 L/h,离子源温度110 ℃。
2.5 提取和浓缩时间对琼玉膏成分质量分数的影响混合对照品和琼玉膏样品色谱图见图 1。采用随行对照品外标法定量。提取和浓缩时间对5-HMF、梓醇、密力特苷、毛蕊花糖苷、Re、Rb1、20(S)-Rg3、Rg1、Ro、茯苓酸各成分量及总量的影响见表 1、2。由表 1可知,随提取时间的延长,10种成分的总量呈降低、升高和再降低的趋势,在1、5 h时各有1个峰值。随浓缩时间延长,10种成分的总量呈减少趋势(表 2)。但随提取和浓缩时间的延长,各成分量的变化趋势又有各自的特点。
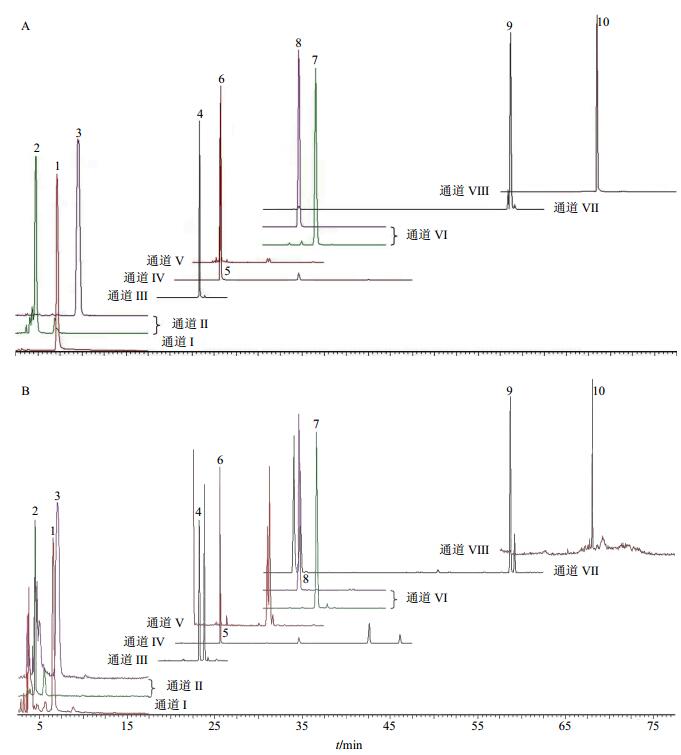 |
1-5-HMF 2-梓醇 3-密力特苷 4-毛蕊花糖苷 5-Re 6-Rg1 7-Ro 8-Rb1 9-20(S)-Rg3 10-茯苓酸 1-5-HMF 2-catalpol 3-melittoside 4-acetoside 5-Re 6-Rg1 7-Ro 8-Rb1 9-20(S)-Rg3 10-pachymic acid 图 1 对照品 (A) 和琼玉膏样品 (B) 选择离子监测色谱图Fig. 1 SIM chromatograms of reference substances (A) and QYG sample (B) |
对不同提取和浓缩时间琼玉膏样品中各成分量分析还发现,不同时间点重复制备样品分析结果的误差变化较大。为了便于直观分析,将各时间点10种成分量的标准差(SD)值累加(表 1、2)。由表 1可知,随提取时间的延长,琼玉膏中各成分量的SD总和呈下降趋势,说明随提取时间的延长,琼玉膏品质的一致性提高,可见,水提取可以提升中药制剂的品质一致性。由表 2可知,随浓缩时间延长,总SD先减小后增大,说明浓缩一定时间,琼玉膏品质趋于一致,但浓缩时间太长,其品质一致性反而下降。
| 表 1 不同提取时间琼玉膏样品中10种主要成分量及SD值比较 (x±s,n =3) Table 1 Comparison on content and SD of 10 major components in QYP extracted with different durations (x±s,n =3) |
| 表 2 不同浓缩时间琼玉膏样品中10种主要成分量及SD值比较(x±s,n =3) Table 2 Comparison on content and SD of 10 major components in QYP concentrated in different durations (x±s,n =3) |
由表 1知,5-HMF量随提取和浓缩时间的延长不断升高。文献报道食品或中药中的己糖会发生热降解反应和美拉德反应生成5-HMF[9]。5-HMF具有抗氧化作用,对肝损伤、缺氧损伤及血管内皮细胞均具有一定的保护作用[10, 11, 12]。琼玉膏长时间提取浓缩5-HMF量增加,可能有利于增加其疗效。
随着提取时间延长,梓醇和密力特苷的量先升后降;但随着浓缩时间延长2个化合物量则持续降低。梓醇和密力特苷属环烯醚萜苷类,此类成分遇热不稳定[13]。提取过程中此类成分同时存在溶出和降解反应,提取初始,溶出大于降解,但随着时间的延长,降解大于溶出,因此总体显示其量先增后降的趋势。
提取和浓缩过程中毛蕊花糖苷的量变化不稳定,推测可能是在提取和浓缩过程中毛蕊花糖苷溶出并水解,溶出和水解始终未达到平衡状态。随着提取时间的延长,Re和Rb1的量呈先减少后增加,再减少的趋势。文献报道,人参中的人参皂苷Ma-Re和Ma-Rb1在加热过程中很容易水解,生成Re和Rb1[14],而Re可水解生成人参皂苷20(S)-Rg2、20(S)-Rh1[15, 16],Rb1可水解生成人参皂苷Rd、20(S)-Rg3[8, 9, 10, 11, 12, 13, 14, 15, 16, 17]等。提取初始,Re和Rb1降解的速度比其生成和溶出的速度快,因此总量下降,随着提取时间的延长,由人参皂苷Ma-Re和Ma-Rb1生成Re和Rb1的速度和溶出比降解的速度快,则总量呈上升趋势。随着人参皂苷Ma-Re和Ma-Rb1降解成Re和Rb1反应的完成,而Re和Rb1仍继续降解,则总量又出现减少的趋势。
20(S)-Rg3随提取时间延长其量先增加后降低。根据文献可知[8],人参皂苷Rb1、Rb2和Rd水解均可生成20(S)-Rg3,20(S)-Rg3进一步脱水生成人参皂苷Rk1和Rg5,人参皂苷Rk1和Rg5可继续发生加成反应生成20(R)-Rg3。开始时20(S)-Rg3的量增加是由于人参皂苷Rb1、Rb2和Rd水解生成20(S)-Rg3的速度大于其降解的速度,之后其量降低是由于生成20(S)-Rg3反应变慢,而20(S)-Rg3进一步反应生成人参皂苷Rk1、Rg5和20(R)-Rg3,使20(S)-Rg3不断减少。20(S)-Rg3是一种理想的免疫调节剂[18],提取时间长短导致其量变化,可能导致复方疗效发生改变。
Rg1随提取时间延长其量显著降低。文献报道人参皂苷Ma-Rg1可水解生成Rg1[14],而Rg1进一步降解生成人参皂苷20(S)-Rh1[17]。推测在提取过程中,Rg1降解的速度始终大于其生成和溶出的速度,所以其量一直降低。
Ro随提取时间延长其量有减少趋势,其主要原因是20位糖苷键水解[16, 17]。
琼玉膏5 h水提液经不同时间的浓缩,由表 2知,人参皂苷的质量浓度变化趋势与经5~9 h提取时质量浓度变化相似,推测具体化学反应与提取时相似。
随提取和浓缩时间的延长,茯苓酸的量先增加后降低,质量浓度增加也是由于溶出,质量浓度降低说明茯苓酸随受热时间延长可能不稳定[19]。
3.2 影响品质一致性机制分析中药材所含的小分子化学成分多属于次生代谢产物,不同化合物都处于生物合成的各个阶段。药材采收时,由于个体差异,每个药材的次生代谢状态可能是不同的,即所含各化合物(次生代谢产物)的相对质量分数也是不一样的,因此药材品质的一致性相对较差。当药材水提取时,各类化合物发生溶出和降解转化,随着提取时间的延长,溶出和降解转化达到相对平衡,因此制剂的品质一致性得到提升。但浓缩时间太长,煎膏变稠,受热的一致性得不到保障,因此成分发生转化的程度可能不同,因此煎膏的品质一致性反而下降。
综上,提取和浓缩可显著影响琼玉膏活性成分的质量分数和品质一致性,其原因可能是提取和浓缩过程中,其所含活性成分在不断溶出的同时还发生了水解、脱水和加成等化学反应,当提取和浓缩达到一定时间时,活性成分的溶出和降解等反应可以趋于平衡。质量的一致性是保证药品疗效稳定的基础,提高品质的一致性可能是膏方较长时间提取浓缩的科学内涵之一。提取和浓缩导致琼玉膏活性成分量和均一性的变化是否真正影响其整体活性有待进一步研究。
| [1] | 许霞. 宋以前方剂剂型的历史研究[D]. 北京:中国中医科学院, 2010. |
| [2] | 陈孝银, 沈强. 琼玉膏对肺腺癌细胞珠GLC-82的细胞周期及凋亡的影响[J]. 中成药, 2000, 22(10):712-714. |
| [3] | 陈孝银, 沈卓群. 琼玉膏对化疗实验肺癌小鼠nm23及PCNA基因蛋白表达的影响[J]. 安徽中医学院学报, 2000, 19(2):47-49. |
| [4] | Xu J D, Li S L, Yan R, et al. Ultra-high performance liquid chromatography coupled with photo-diode array and quadrupole/time-of-flight mass spectrometry based chemical profiling approach to evaluate the influence of preparation methods on the holistic quality of Qiong-Yu-Gao, a traditional complex herbal medicine[J]. J Chromatogr A, 2013, 1304:154-168. |
| [5] | Xu J D, Wu J, Zhou S S, et al. High performance liquid chromatography-electrospray ionization-mass spectrometry with programmed ionization mode switching and time segment scanning approach for quantifying multi-components in traditional complex herbal medicines, Qiong-Yu-Gao as an example[J]. J Pharm Biomed Anal, 2015, 112:139-146. |
| [6] | Xu J, Wu J, Zhu L Y, et al. Simultaneous determination of iridoid glycosides, phenethylalcohol glycosides and furfural derivatives in Rehmanniae Radix by high performance liquid chromatography coupled with triple-quadrupole mass spectrometry[J]. Food Chem, 2012, 135(4):2277-2286. |
| [7] | Gao A H, Zhang L, Chen X, et al. Inhibition of ovarian cancer proliferation and invasion by pachymic acid[J]. Int J Clin Exp Pathol, 2015, 8(2):2235-2241. |
| [8] | Li S L, Lai S F, Song J Z, et al. Decocting-induced chemical transformations and global quality of Du-Shen-Tang, the decoction of ginseng evaluated by UPLC-Q-TOF-MS/MS based chemical profiling approach[J]. J Pharm Biomed Anal, 2010, 53(4):946-957. |
| [9] | 周逸群, 贺福元, 杨岩涛, 等. 美拉德反应研究现状及对中药炮制和制剂工艺研究方法的影响[J]. 中草药, 2014, 45(1):125-130. |
| [10] | Li W, Qu X N, Han Y, et al. Ameliorative effects of 5-hydroxymethyl-2-furfural(5-HMF) from Schisandra chinensis on alcoholic liver oxidative injury in mice[J]. Int J Mol Sci, 2015, 16(2):2446-2457. |
| [11] | Ya B, Zhang L, Zhang L, et al. 5-hydroxymethyl-2-furfural prolongs survival and inhibits oxidative stress in a mouse model of forebrain ischemia[J]. Neural Regen Res, 2012, 7(22):1722-1728. |
| [12] | Li M M, Wu L Y, Zhao T, et al. The protective role of 5-HMF against hypoxic injury[J]. Cell Stress Chaperones, 2011, 16(3):267-273. |
| [13] | Li S L, Song J Z, Qiao C F, et al. A novel strategy to rapidly explore potential chemical markers for the discrimination between raw and processed Radix Rehmanniae by UHPLC-TOFMS with multivariate statistical analysis[J]. J Pharm Biomed Anal, 2010, 51(4):812-823. |
| [14] | 张淼, 秦昆明, 蔡宝昌, 等. 人参炮制过程中化学成分变化及机制研究[J]. 中国中药杂志, 2014, 39(19):3701-3706. |
| [15] | Bae E A, Shin J E, Kim D H, et al. Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect[J]. Biol Pharm Bull, 2005, 28(10):1903-1908. |
| [16] | 肖盛元, 罗国安. 红参加工过程中人参皂苷化学反应HPLC/MS/MS研究[J]. 中草药, 2005, 36(1):40-43. |
| [17] | 李向高, 富力, 鲁歧, 等. 红参炮制加工中的皂苷水解反应及其产物的研究[J]. 吉林农业大学学报, 2000, 22(2):1-9. |
| [18] | Wei X J, Chen J, Su F, et al. Stereospecificity of ginsenoside Rg3 in promotion of the immune response to ovalbumin in mice[J]. Int Immunol, 2012, 24(7):465-471. |
| [19] | 徐雷, 刘常丽, 刘合刚, 等. 不同温度贮藏条件下茯苓品质变化研究[J]. 北方园艺, 2014(22):170-173. |
 2016, Vol. 47
2016, Vol. 47


