当归Radix Angelica Sinensis为大宗常用中药材,《中国药典》2010年版一部收载的当归来源为伞形科(Apiaceae)当归Angelica sinensis (Oliv.) Diels的干燥根[1]。甘肃为栽培当归的道地产区,其中以“岷归”最为著名,年栽培面积和总产量都占全国的90%以上,主要远销韩国、日本、越南、非洲等地。随着药材用量的日益增加,大力发展人工栽培成为满足当归需求的主要途径之一[2]。但近年来由于连作导致病虫害严重,严重影响保护地当归的生长,有毒农药残留严重超标,药材品质日益下降,而熟地育苗模式也由于病虫害严重等因素制约而无法推广,因此研究新型的绿色种植模式是防止有毒农药对药材威胁及提高其产量的一个主要方向。大蒜Allium sativum L. 作为一种很好的前茬作物,对许多作物种子萌发,幼苗生长和病虫害防治等方面都具有显著的化感效应[3]。如大蒜根系分泌物对莴苣种子发芽和幼苗生长的影响除发芽指数随着浓度的升高而降低外,其他各指标的变化规律均呈现出低浓度促进高质量浓度抑制的趋势;大蒜浸提液中的化感物质对不同品种的菜豆种子发芽率的抑制率都在20%以下[4, 5]。在当归产区有当归和大蒜等作物间套作来缓解当归连作障碍的探索,当归/大蒜对减缓当归连作障碍有一定作用,但其机制还无深入研究[6]。本研究利用大蒜离体蒜苗模拟大蒜化感条件,研究其对当归根提取物模拟的连作胁迫下当归种子萌发特性的影响及其规律,旨在探索大蒜地上部分产生的挥发性物质对当归种子,尤其对处于连作胁迫下的当归种子发芽是否存在有益的化感效应,本研究结果可为当归大蒜间作种植模式缓解当归连作障碍提供一定的理论依据。
1 材料与方法 1.1 供试材料供试作物蒜苗从菜市场购买,剪成5 cm左右小段备用;样品采自其道地产区甘肃岷县茶埠乡,经甘肃农业大学陈垣教授鉴定为当归Angelica sinensis (Oliv.) Diels的种子,为伞形科植物当归的种子。选取当年籽粒饱满、色泽粉白、大小均一的当归种子,去翼后备用。
1.2 试验设计本研究利用当归根系浸提液模拟当归连作胁迫环境,用离体蒜苗模拟大蒜挥发物质的化感作用环境,研究不同质量浓度大蒜挥发物质对连作胁迫下当归种子发芽能力的影响。试验采用2因素完全随机区组设计,设置离体蒜苗质量和当归根浸提液浓度2个因素,其中当归根系浸提液质量浓度分别为0、5、10、15 mg/mL 4个水平,以模拟当归连作不同胁迫水平;蒜苗挥发物质的浓度通过加入容器内的蒜苗质量控制,设0、50、100、200 g 4个水平,试验共16个处理,每处理3次重复。
1.3 试验方法及测定指标 1.3.1 发芽试验当归种子先用蒸馏水浸种4 h,然后用次氯酸钠处理10 min,最后用不同质量浓度的当归根系浸提液浸种1 h,在室温避光条件下进行发芽试验[7, 8]。发芽试验使用带有活塞的玻璃干燥器,利用乳胶管将玻璃容器与外界空气接通,底部放置新鲜的蒜苗,干燥器隔层放置培养皿,利用纸上发芽法,在培养皿(直径9 cm)内铺入双层滤纸,用移液管吸取10 mL蒸馏水于培养皿内,将处理好的当归种子按50粒每皿摆放,试验期间每2 d更换一次蒜苗,每天打开乳胶管夹通气2 h。
1.3.2 当归根系浸提液的制备称取过2号筛的当归根系粗粉25 g,采用双提法。即先用蒸馏法提出挥发性成分,再将药渣在常压下加热回流提取3次,加水量分别为药材质量的10、6、6倍,提取时间依次为2、0.5、0.5 h,每次提取液用4层纱布加100目筛分别滤过,离心(3 000 r/min,15 min),合并滤液,浓缩,再将浓缩液与挥发性成分混合,并定容至100 mL,即得当归根系提取液(每毫升样品液相当于原药材0.25 g),实验时再稀释成不同的质量浓度。
1.3.3 测定指标及方法从种子置床24 h后每隔24 h观察种子萌发情况(以胚芽突破种皮作为标准),记录正常发芽种子数和霉变种子数,直到发芽结束。种子试验测定方法按GB/T3543.4-1995《农作物种子检验规程 发芽试验》标准规定执行[9]。
发芽势=规定时间内发芽种子数/种子总数,以7 d后的发芽种子数为标准计算
发芽率=终期发芽种子数/种子总数,以12 d后的发芽种子数为标准计算
发芽指数=∑Gt/Dt,其中,Gt指各日净发芽数,Dt为相应的发芽日数;
活力指数=GI×S,其中,GI为发芽指数,S为相应时期内胚芽长度
霉变率=霉变种子数/种子总数,以10 d后的霉变种子数为标准进行计算
胚芽长度的测定是将培养皿里发芽种子的胚根、幼芽从种子结合部切下后测定其长度计算平均值。α-淀粉酶活性按3,5-二硝基水杨酸法测定[10]。
1.4 数据分析与统计方法数据采用Excel 2007和SPSS 19.0进行统计分析。化感效应指数采用Williamson等[11]的方法进行。当T≥C时,化感效应指数=1-C/T;当T<C时,化感效应指数=T/C-1。其中,C为对照值,T为处理值(化感效应指数>0为促进作用,化感效应指数<0为抑制作用,绝对值大小与作用强度一致)。
2 结果与分析 2.1 离体蒜苗挥发物质对模拟连作胁迫下当归种子发芽特性的影响当归根浸提液及离体蒜苗挥发物质均对当归种子发芽具有一定的影响。其中当归根浸提液对当归种子的萌发具有明显的抑制作用,且当归根浸提液质量浓度越大,其抑制作用越强,当浸提液质量浓度为15 mg/mL时,当归种子的发芽率、发芽势、发芽指数和活力指数的平均值分别较对照(CK)下降了15.59%、30.00%、41.92%和75.92%(图 1-A)。在未用当归根浸提液浸种的处理中,离体蒜苗挥发物质对当归种子发芽能力的影响基本表现为低质量(50 g)促进而高质量时(100~200 g)抑制的趋势(图 1-B)。由化感效应指数可以看出,其发芽率、发芽势、发芽指数的化感效应指数分别为0.02、0.04、0.08,这均表明低浓度离体蒜苗挥发物质对未用当归根浸提液处理的当归种子的萌发存在一定的化感促进效应,但其促进效应并不显著(表 1)。在蒜苗质量高于50 g时,随着蒜苗质量的增加表现出显著的化感抑制作用,当供体蒜苗的鲜质量为200 g时,当归种子的发芽率、发芽势和活力指数与对照相比分别下降7.09%、12.20%和20.02%,其发芽率、发芽势、发芽指数和活力指数的化感效应指数分别为-0.12,-0.07,-0.20和-0.49,均低于对照和其他处理(表 1),表明高质量浓度蒜苗挥发物质抑制了当归种子的萌发。
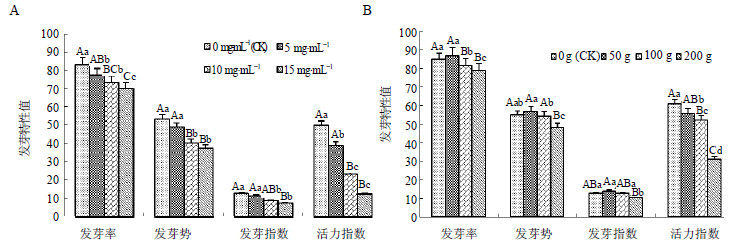 |
小写和大写英文字母分别表示同一指标5%和1%水平的差异显著性,下同 The normal and capital letters indicate the difference in 5% and 1% level respectively at same items. The same as below 图 1 当归根浸提液 (A) 和离体蒜苗挥发物质 (B) 对当归种子发芽特性的影响Fig.1 Effect of extract from Angelica Sinensis Radix (A) and volatile from isolated garlic sprouts (B) on germination of A. sinensis seeds |
| 表 1 当归种子发芽指标的化感效应指数 Table 1 Allelopathic index of A.sinensis seeds germination indexs |
离体蒜苗挥发物质对模拟连作胁迫下的当归种子发芽表现为一定的化感促进作用。当供体蒜苗质量为50~100 g时,当归种子的发芽率、发芽势、发芽指数和活力指数较对照提高,差异达到极显著水平(P<0.01),当供体蒜苗质量为200 g时,促进作用不明显(P<0.05),但未出现抑制作用。在当归根浸提液质量浓度为15 mg/mL时,用100 g离体蒜苗处理的当归种子发芽率、发芽势和发芽指数分别较无蒜苗处理的对照(CK3)增加15.11%、20.39%和57.80%,用200 g离体蒜苗处理的当归种子其发芽率、发芽势和发芽指数较对照(CK3)分别增加6.80%、9.25%和18.01%(表 2)。分别以无离体蒜苗挥发物质的处理为对照(CK、CK1、CK2、CK3),表现为在未用当归浸提液的处理中,当归种子发芽指标的化感效应指数在高质量浓度离体蒜苗处理中为负值,随着当归浸提液质量浓度的增加,化感效应指数有增加的趋势(表 2)。对于用当归根浸提液处理的当归种子,与同当归浸提液浓度水平下的无蒜苗处理相比较,供体蒜苗所产生的挥发性物质对由当归浸提液的抑制作用具有一定的缓解作用。即一定量的蒜苗挥发物质可缓解连作对当归种子萌发的抑制作用。
| 表 2 当归种子发芽指标的化感效应指数 Table 2 Allelopathic index of A. sinensis seeds germination indexs |
当归根浸提液对当归胚芽生长具有一定的抑制作用,而蒜苗挥发物质则表现为低质量促进而高质量抑制。在未用当归浸提液处理中,随着当归蒜苗质量的增加,胚芽长度依次减小,当蒜苗鲜质量为200 g时,与对照相比,当归胚芽长度降低了36.19%,差异达到极显著水平(P<0.01)。而用高质量当归根浸提液或高质量离体蒜苗处理后,当归胚芽发青甚至坏死。用5 mg/mL和10 mg/mL的当归浸提液的分别处理中,与同水平下未加离体蒜苗的处理相比,蒜苗挥发物质对当归胚芽的生长具有促进作用,当蒜苗鲜质量为200 g时,胚芽长度较对照增加了46.00%和25.66%,在用15 mg/mL的当归浸提液的处理中,高质量蒜苗挥发物质(蒜苗鲜质量200 g)对当归胚芽的生长又表现出显著的抑制作用(P<0.05)(图 2-A)。整体来看,蒜苗挥发物质对浸提液的抑制作用具有一定的延缓作用。从胚芽的长势来看,未用当归根系浸提液处理,离体蒜苗挥发物质浓度较低的处理当归胚芽长势较好,而高质量蒜苗挥发物质处理下当归胚芽生长受阻,这可能是高质量蒜苗挥发物质的加入,减少了种子发芽所需的氧分量,影响了胚芽生长的呼吸强度,从而抑制了体内的各种生物酶活性,同时也减缓了胚根对微量元素的吸收等,进而影响了当归胚芽的生长。
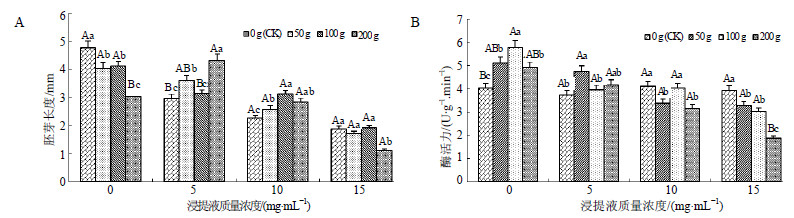 | 图 2 离体蒜苗挥发物质对当归种子胚芽长度 (A) 和α-淀粉酶活性 (B) 的影响Fig.2 Effect of volatile from isolated garlic sprouts on embryo length (A) and α-amylase activity (B) of A. sinensis seeds |
α-淀粉酶活性是衡量种子萌发的一个重要的生理指标,不同质量的蒜苗挥发物质对模拟连作胁迫下当归种子萌发时的α-淀粉酶活性具有一定的化感效应。在未用当归浸提液的处理中,随着供体蒜苗质量的增加,受体当归种子的α-淀粉酶活性呈上升趋势,在供体蒜苗质量为100 g时,α-淀粉酶活性最大,在蒜苗质量大于100 g时,当归种子的α-淀粉酶活性又开始下降。而随着当归浸提液浓度不断增大,当归种子的α-淀粉酶活性都有不同程度的降低。在浸提液质量浓度为15 mg/mL的水平下,蒜苗质量为200 g时的当归种子的α-淀粉酶活性与对照相比下降了52.15%,而在浸提液质量浓度为5 mg/mL的水平下,用200 g蒜苗处理的当归种子的α-淀粉酶活性与对照相比增加了11.44%(图 2-B)。这表明离体蒜苗挥发物质对当归种子中α-淀粉酶活性的影响较为敏感,在供体蒜苗质量较少时,受体内的保护酶系统启动,抵御外界胁迫;当蒜苗挥发物质浓度增大到一定值,或用高质量浓度的当归浸提液处理时,外界的胁迫已超出其自身的调节能力,受体当归种子的萌发被抑制,使得自身代谢减慢,酶活性降低。
2.4 离体蒜苗挥发物质对连作胁迫下当归种子霉变率的影响根浸提液的质量浓度的增大而增大,当浸提液质量浓度为15 mg/mL时,当归种子的霉变率比对照增加了150%。而在无当归根浸提液的处理中,随着蒜苗质量的增加,当归种子的霉变率也呈增大的趋势,当蒜苗质量为200 g,当归种子的霉变率比对照增加了100%。考虑互作效应,在10 mg/mL当归根浸提液+50 g蒜苗和15 mg/mL当归根浸提液+50 g蒜苗的处理中,当归种子霉变率显著较同模拟连作胁迫水平下未加蒜苗的处理低,说明50 g蒜苗可在一定程度上缓解由当归根提取物导致的霉变。从种子外观来看,随着蒜苗质量和当归浸提液质量浓度的增大,胚芽发霉变坏,产生连片的菌落,真菌数量增加,引起种子的病变。这些都表明当归根的浸提液具有生长抑制作用,低质量浓度时抑制作用弱或不具有抑制作用,而随浓度升高抑制作用随之增加。
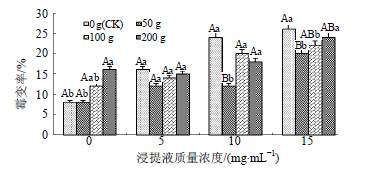 | 图 3 离体蒜苗挥发物质对当归种子霉变率的影响Fig.3 Effect of volatile from isolated garlic sprouts on A. sinensis seeds rot rate |
对于不同的蔬菜类作物,大蒜挥发物质对其的化感效应不同[12, 13]。本研究通过室内模拟试验,用不同浓度的当归根系浸提液模拟连作水平,通过不同质量浓度的蒜苗挥发物质来研究当归种子的萌发特性。结果表明,当归根浸提液及离体蒜苗挥发物质均对当归种子萌发具有一定的影响。其中当归根浸提液对当归种子的萌发具有明显的抑制作用,且当归根浸提液质量浓度越大,其抑制作用越强,这是当归自毒作用所致[14, 15, 16, 17]。离体蒜苗挥发物质对于当归种子的萌发具有一定的化感作用,且不同质量浓度的蒜苗挥发物质对于当归种子的萌发化感效应不同。对于未用当归根系浸提液处理的当归种子,离体蒜苗挥发物质对当归种子发芽能力的影响基本表现为低质量(50 g)促进而高质量(100~200 g)抑制的趋势。当供体蒜苗质量为50 g时,当归种子的发芽率、发芽势、发芽指数和α-淀粉酶活性表现为化感促进作用,随着供体蒜苗质量的增加,化感抑制作用明显加强,当蒜苗质量增加到200 g时,当归种子的萌发抑制作用表现突出,达到极显著水平(P<0.01)。对于用当归根系浸提液处理的当归种子,离体蒜苗挥发物质对当归种子发芽特性的影响表现为促进作用。当供体蒜苗质量为50~100 g时,离体蒜苗挥发物质对当归种子发芽能力促进作用极为显著(P<0.01),当供体蒜苗质量为200 g时,促进作用减弱。综上可知供体蒜苗挥发物质对当归浸提液产生的当归种子发芽抑制作用具有一定的缓解作用,即一定质量的蒜苗挥发物质可减小因连作障碍对当归种子萌发的影响。
许多挥发物质能够抑制或促进邻近植物的生长发育,因而挥发性的化感物质也是普遍存在的,而植物化感活性物质对种子萌发的影响或为促进效应或为抑制作用或又表现为双重的浓度效应,这取决于不同的受试作物,而受试作物种子能否萌发与其所接触化感物质的浓度密切相关[18, 19]。化感活性物质作用后,种子萌发过程中种子发芽率的降低在很大程度上是因为种子活力的降低而导致的,而种子呼吸作用的减弱又是降低种子活力的重要原因,呼吸作用能为胚的迅速生长提供大量的能量和物质基础,呼吸作用的减弱必然降低种子的萌发率;化感物质对细胞膜的伤害可能是化感物质多种效应的起始点,细胞膜结构功能的改变必然会影响植物对水分和矿质元素的吸收,以及蛋白质的合成和酶功能的改变,而种子萌发时的代谢强度与细胞质膜的完整性密切相关[20]。当归种子经高质量浓度化感活性物质作用后萌发率降低甚至不能萌发的原因很可能是各种保护酶的活性受到抑制,造成了膜的功能的丧失,引起种子萌发生理的紊乱,从而对当归种子的萌发表现出化感效应。而低浓度的化感活性物质激发了当归种子酶系统,加速了其生理代谢,促进了种子的萌发和幼芽的生长。
目前,大蒜与药用植物间化感作用的探究甚少,因此大蒜与当归化感作用的研究有很大的现实意义,但由于化感作用、连作障碍和自毒作用都具有隐蔽性和多态性,化感物质种类繁多且作用机制不尽相同等因素都给作物化感作用和连作障碍的研究增加了难度[21, 22, 23]。在本研究中主要采用室内模拟实验,用当归根浸提液模拟当归连作胁迫,用新鲜离体蒜苗模拟化感条件,研究离体蒜苗对连作胁迫下当归种子萌发特性的影响,从该研究的结果中可以看出,离体蒜苗可在一定程度上缓解当归连作障碍产生的发芽抑制。但由于离体蒜苗和当归根浸提液均不能综合模拟蒜苗化感物质和当归连作障碍因素,因此,大蒜挥发物质组分及其对当归连作障碍的缓解作用机制还有待田间试验进一步深入研究。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 高文远, 秦恩强. 当归药材道地性的RAPD分析[J]. 中草药, 2006, 37(10):926-929. |
| [3] | 周艳丽, 王艳, 李金英, 等. 大蒜根系分泌物的化感作用[J]. 应用生态学报. 2011, 22(5):1368-1372. |
| [4] | 周艳丽, 程智慧, 孟焕文. 大蒜根系水浸液及根系分泌物的化感作用评价[J]. 西北农林科技大学学报:自然科学版, 2007, 35(10):87-92. |
| [5] | 张志勇, 汤菊香, 卫秀英. 大蒜浸提液中化感物质对菜豆种子萌发的影响[J]. 安徽农业科学, 2009, 37(3):949-950. |
| [6] | 王田涛, 王琦, 王惠珍, 等. 连作条件下间作模式对当归生长特性和产量的影响[J]. 草业学报, 2013, 22(4):54-61. |
| [7] | 王楠, 蔺海明, 武延安. 当归种子活力[J]. 兰州大学学报:自然科学版, 2008, 44(3):56-59. |
| [8] | 旺军. 当归种子的萌发特性研究[J]. 种子, 2003(2):21-22. |
| [9] | 农作物种子检验规程发芽试验[S]. GB/T3543. 4-1995. |
| [10] | 赵世杰. 植物生理学实验指导[M]. 北京:中国农业科学技术出版社, 2002. |
| [11] | Williamson G B, Richardson D. Bioassays for allelopathy:mesauring treatment responses with independent controls[J]. J Chem Ecol, 1988, 14(1):181-187. |
| [12] | 金瑞, 程智慧. 离体蒜苗挥发物质的化感作用及其成分分析[J]. 西北植物报, 2007, 27(11):2286-2291. |
| [13] | 佟飞, 程智慧, 金瑞. 大蒜植株水浸液醇溶成分的化感作用[J]. 西北农林科技大学学报:自然科学版, 2007, 35(6):120-124. |
| [14] | 张新慧, 郎多勇, 张恩和. 当归根际土壤水浸液的自毒作用研究及化感物质的鉴定[J]. 中草药, 2010, 41(12):2063-2066. |
| [15] | Zhang X H, Zhang E H, Fu X Y, et al. Autotoxic effects of Angelica sinensis (Oliv.) Diels[J]. Allelopathy J, 2010, 26(1):1-12. |
| [16] | 朱慧, 马瑞君, 吴双桃, 等. 当归根际土对其种子萌发和幼苗生长的影响[J]. 生态学杂志, 2009, 28(5):833-838. |
| [17] | 马瑞君, 惠继瑞, 朱慧, 等. 当归营养期的化感作用[J]. 中国生态农业学报, 2008, 16(6):1483-1488. |
| [18] | 赵杨景. 植物化感作用在药用植物栽培中的重要性和应用前景[J]. 中草药, 2000, 31(8):1-4. |
| [19] | 董章杭, 林文雄. 作物化感作用研究现状及前景展望[J]. 中国生态农业学报, 2001, 9(1):80-83. |
| [20] | 宋亮, 詹开文, 王进闯. 化感活性物质影响种子萌发作用机理的研究进展[J]. 世界科技研究与发展, 2006, 28(4):52-55. |
| [21] | 吕卫光, 张春兰. 化感物质抑制连作黄瓜生长的作用机制[J]. 中国农业科学, 2002, 35(1):106-109. |
| [22] | Manoel B D A, Roseane C D S, Liziane M L, et al. Allelopathy, an alternative tool to improve cropping systems. A review[J]. Agro Sustain Devel, 2011, 31:379-395. |
| [23] | Zhang Y, Gu M, Xia X, et al. Alleviation of autotoxin-induced growth inhibition and respiration by sucrose in Cucumis sativus[J]. Allelopathy J, 2010, 25(1):147-154. |
 2016, Vol. 47
2016, Vol. 47

