2. 南昌大学抚州医学院, 江西 抚州 344000
2. Fuzhou Medical College of Nanchang University, Fuzhou 344000, China
乳腺癌是女性最常见的癌症之一。虽然临床上有多种化学合成药物如他莫昔芬、雷洛昔芬、托瑞米芬等已被广泛用于乳腺癌患者的治疗[1],但是由于这些药物具有毒性大、容易耐药等问题,临床效果不理想,目前临床上仍然亟需高效、低毒、特异性的乳腺癌治疗药物。
桦褐孔菌Inonotus obliquus(Fr.)Pila又名白桦茸,生于白桦、银桦、榆树、赤杨等的树皮下或活立木的树皮下或砍伐后树木的枯干上。现代植物化学研究发现,桦褐孔菌中的主要化学成分为三萜类、甾体、多酚、多糖等[2,3]。近年国内外学者研究发现桦褐孔菌提取物具有多种生物学活性,包括抗衰老、降血糖、降血压、抗肿瘤等,特别是其抗肿瘤活性受到很大的关注[4],且并未表现出明显的生理毒性[5]。但是具体作用机制尚不清楚。本研究以人乳腺癌细胞系为研究对象,研究桦褐孔菌中量最多的三萜类化合物——桦褐孔菌醇对乳腺癌MCF-7细胞增殖与凋亡的影响,拟揭示其抗乳腺癌的作用机制。
1 材料 1.1 真菌原料桦褐孔菌采自黑龙江省牡丹江市镜泊湖火山口桦树的树干,由江西省科学院生物资源研究所金志农研究员鉴定为Inonotus obliquus(Fr.)Pila子实体
1.2 细胞与试剂人乳腺癌细胞系MCF-7细胞购于中国科学院典型培养物保藏委员会细胞库;RPMI 1640培养液购自北京四季青生物材料研究所;噻唑蓝(MTT)试剂盒购于北京索莱宝生物科技有限公司;胎牛血清购自Invitrogen公司;AnnexinV/PI细胞凋亡检测试剂盒购于Bender公司;细胞浆蛋白抽提试剂盒购于上海碧云天生物技术有限公司;其他试剂(分析纯)购于北京试剂厂。
1.3 实验仪器UV-3600Plus分光光度计(岛津企业管理有限公司);DYY-6D三恒电泳仪(北京市六一仪器厂);YQX-II厌氧培养箱(上海跃进医疗器械有限公司);BD FACSCanto II流式细胞仪(上海碧迪医疗器械有限公司);DW-86L30超低温冰箱(杭州艾普仪器设备有限公司);METTLER XS205微量分析天平(南京皓海科学仪器仪表有限公司);HNY-200B台式全温度恒温高速培养摇床(北京傲松欣实验室设备有限公司);Eppendorf-5424小型高速离心机(北京东南仪诚实验室设备有限公司);MLS-3751L高压蒸汽灭菌锅(松下健康医疗器械株式会社);Milli-Q超纯水系统(美国Millipore公司)。
2 方法 2.1 桦褐孔菌醇的制备桦褐孔菌子实体经加热回流提取法制备桦褐孔菌醇。取40 g桦褐孔菌子实体,加95%乙醇3.0L加热回流提取3次,每次30 min,合并提取液后滤过除渣,制成桦褐孔菌粗提物溶液,减压浓缩至干。再通过硅胶柱色谱,以石油醚-丙酮为洗脱剂梯度洗脱,分段收集,再经过重结晶,得到纯品桦褐孔菌醇(质量分数99%,HPLC),以二甲基亚砜(DMSO)溶解,用RPMI 1640培养液稀释至所需浓度。
2.2 细胞培养将MCF-7细胞培养于RPMI 1640培养液(含10%胎牛血清、100U/mL青霉素、100 μg/mL链霉素)中,置于37 ℃、5% CO2、饱和湿度的细胞培养箱内,取对数生长期细胞用于实验。
2.3 细胞增殖抑制实验取1×105/mL对数生长期的MCF-7细胞,分别接种于96孔板(200 μL/孔),细胞贴壁后每孔加入终浓度为0、25、50、100 μmol/L的桦褐孔菌醇。各浓度均设5个复孔,分别继续培养24、48、72 h,以同体积RPMI 1640培养液为空白对照。于各组实验结束前4 h加入MTT试剂20 μL/孔,继续孵育4 h,吸弃上清,加入DMSO 150 μL/孔,摇床上振荡10 min,待结晶完全溶解后酶标仪上检测570 nm处的吸光度(A)值,计算细胞存活率。
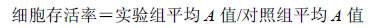
将对数生长期的MCF-7细胞,以1×106/mL浓度接种于6孔培养板内,待细胞贴壁后分别加入终浓度为0、25、50、100 μmol/L的桦褐孔菌醇培养液,培养48 h后,收集细胞,离心固定后加入Annexin V-FITC和PI,室温避光染色。筛网滤过后送流式细胞仪进行细胞凋亡的检测。
2.5 Westernblotting法检测蛋白表达量的变化细胞分别以50 μmol/L的桦褐孔菌醇处理12、24、48 h后收集细胞,参照试剂盒说明书进行细胞浆蛋白抽提操作,提取细胞总蛋白并测定浓度,蛋白样品加入1/5体积的5×上样缓冲液,沸水煮沸5 min,根据蛋白浓度以20 μg/孔上样,进行SDS-聚丙烯酰胺凝胶电泳,然后电转至PVDF膜上,室温封闭1 h,分别加入1∶1 000稀释的半胱氨酸蛋白酶3(Caspase-3)和ADP-核糖聚合酶(PARP)蛋白,4 ℃过夜。β-actin作为内参,TBST洗膜3次,加入1∶1 000稀释的辣根酶标记的兔抗山羊IgG,室温孵育2 h,同样洗膜3次,ECL发光液显色,观察各条带深浅变化。
2.6 统计学方法应用SPSS19.0统计软件进行处理。计量资料用x±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
3 结果 3.1 对乳腺癌细胞活力的影响如图 1所示,桦褐孔菌醇分别处理24、48、72 h,在25~100 μmol/L均可不同程度抑制MCF-7细胞活力,且随着桦褐孔菌醇浓度的升高和处理时间的延长,抑制细胞活力的作用也逐渐增强,呈浓度和时间依赖效应。
 |
与对照组比较:*P<0.05**P<0.01 *P <0.05 **P < 0.01 vs control group 图 1 桦褐孔菌醇对MCF-7细胞活力的影响 (x± s, n= 5) Fig.1 Effect of inotodiol on cell viability of MCF-7 cells (x± s , n = 5) |
流式细胞仪检测结果显示,桦褐孔菌醇能诱导MCF-7细胞凋亡。如图 2所示,桦褐孔菌醇(终浓度分别为25、50、100 μmol/L)处理MCF-7细胞48 h后,细胞凋亡(早期凋亡+晚期凋亡)率分别为28.62%、39.45%、53.18%,明显高于对照组凋亡率(3.21%),且其作用具有明显剂量依赖性。
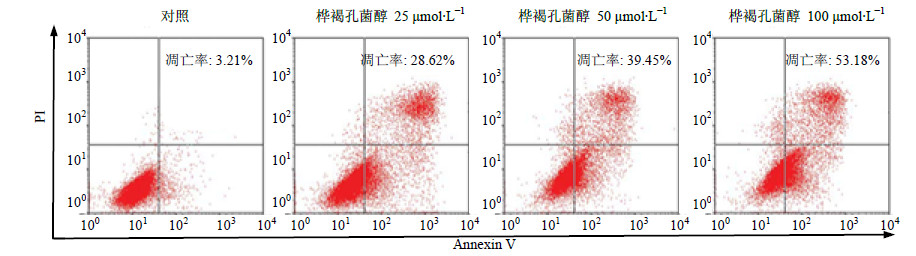 | 图 2 桦褐孔菌醇对MCF-7细胞凋亡的影响Fig.2 Effect of inotodiol on cell apoptosis of MCF-7 cells |
通过Westernblotting测定,发现未用桦褐孔菌醇处理的MCF-7细胞中cleavedCaspase-3和cleaved PARP几乎没有表达。桦褐孔菌醇(50 μmol/L)处理MCF-7细胞12、24、48 h后,MCF-7细胞cleaved Caspase-3、cleavedPARP表达量浓度依赖地增加(图 3)。
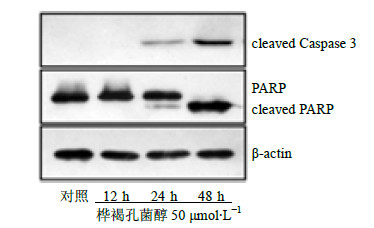 | 图 3 桦褐孔菌醇对MCF-7细胞中cleaved Caspase-3和cleaved PARP蛋白表达的影响Fig.3 Effects of inotodiol on protein expression of cleaved Caspase-3 and PARP in MCF-7 cells |
全球乳腺癌患者发病率一直呈上升趋势。中国虽不是乳腺癌的高发国家,但近年乳腺癌发病率的增长速度很快。全国肿瘤登记地区乳腺癌发病率已经位居女性恶性肿瘤的第1位。乳腺癌患者最佳治疗手段的选择依然面临很大的挑战[6]。天然药物(包括中医药和民族医药)是用来防治疾病的有力武器,与化学药品相比,天然药物除了有着来源广泛、价格低廉和毒副作用低等优点外,在减轻癌症患者临床症状,提高生存质量,提高免疫力,增强放、化疗敏感性,减轻放、化疗不良反应等很多方面都具有优势。近年来中药及其有效部位或成分抗癌研究工作取得了一系列的成果,已成为肿瘤医学的研究热点之一[7]。
近年来,从真菌的药用植物次生代谢产物中已分离出许多活性较高的生物活性物质,这表明药用植物内生真菌已成为药物开发的重要资源。目前,从植物内生菌尤其是药用植物细菌中发现了很多具有开发前景的抗肿瘤活性成分,这为寻找高活性的抗肿瘤化合物具有重要意义。
桦褐孔菌主要分布于俄罗斯、芬兰、波兰、日本北海道等地区和我国黑龙江与吉林一带。在民间,桦褐孔菌应用于防止癌细胞转移、复发,增强免疫能力,配合恶性肿瘤患者的放疗、化疗,增强病人的耐受性,减轻毒副作用[4,8,9],但是具体的作用机制尚不明确。本研究选择人乳腺癌细胞为研究对象,检测桦褐孔菌中的代表性化合物桦褐孔菌醇的抗肿瘤作用,旨在揭示桦褐孔菌在乳腺癌治疗中的作用机制。通过MTT实验,发现桦褐孔菌醇可显著降低MCF-7细胞活力(呈时间及剂量依赖性)。进而通过流式细胞术发现桦褐孔菌醇可以诱导MCF-7细胞凋亡。
Caspase家族蛋白的激活在细胞凋亡过程中起关键性作用,被认为是诱发凋亡的直接效应物[10]。已发现的Caspase家族有10余种,其中Caspase-3是该家族的重要成员,是细胞凋亡过程中的关键酶。PARP是Caspase的切割底物,在DNA损伤修复与细胞凋亡中发挥着重要作用[11]。本研究通过Western blotting实验发现,桦褐孔菌醇呈时间依赖性地增加MCF-7细胞中Caspase-3的活性形式cleaved Caspase 3和cleaved PARP的表达量。提示桦褐孔菌醇可能是通过增强细胞Caspase活性从而促进细胞凋亡。
综上所述,桦褐孔菌醇具有抗肿瘤作用。本研究为临床应用药用真菌制品治疗乳腺癌患者提供了一定的参考,也为更合理使用桦褐孔菌及其制剂提供了新的依据。
| [1] | Makki J. Diversity of breast carcinoma:histological subtypes and clinical relevance[J]. Clin Med Insights Pathol, 2015, 8(1):23-31. |
| [2] | Zhao F Q, Mai Q Q, Ma J H, et al. Triterpenoids from Inonotus obliquus and their antitumor activities[J]. Fitoterapia, 2015, 101(1):34-40. |
| [3] | 张仕瑾, 谢运飞, 谭玉柱, 等. 桦褐孔菌三萜类化学成分研究[J]. 中草药, 2015, 46(16):2355-2360. |
| [4] | Ma L, Chen H, Dong P, et al. Anti-inflammatory and anticancer activities of extracts and compounds from the mushroom Inonotus obliquus[J]. Food Chem, 2013, 139(1/4):503-508. |
| [5] | 束庆玉, 杨开, 郭安琪, 等. 桦褐孔菌水提物的安全性评价研究[J]. 药物评价研究, 2014, 37(3):238-245. |
| [6] | Zhou Z R, Mei X, Chen X X, et al. Systematic review and meta-analysis comparing hypofractionated with conventional fraction radiotherapy in treatment of early breast cancer[J]. Surg Oncol, 2015, 24(3):200-211. |
| [7] | Ye L, Jia Y N, Ji K, et al. Traditional Chinese medicine in the prevention and treatment of cancer and cancer metastasis[J]. Oncol Lett, 2015, 10(3):1240-1250. |
| [8] | Chen Y Y, Huang Y R, Cui Z M, et al. Purification, characterization and biological activity of a novel polysaccharide from Inonotus obliquus[J]. Int J Biol Macromol, 2015, 79(1):587-594. |
| [9] | Nagajyothi P C, Sreekanth T V M, Lee J I, et al. Mycosynthesis:antibacterial, antioxidant and antiproliferative activities of silver nanoparticles synthesized from Inonotus obliquus (Chaga mushroom) extract[J]. J Phytochem Phytobiol B, 2014, 130(1):299-304. |
| [10] | Chen H, Yang X, Feng Z, et al. Prognostic value of Caspase-3 expression in cancers of digestive tract:a meta-analysis and systematic review[J]. Int J Clin Exp Med, 2015, 8(7):10225-10234. |
| [11] | O'Connor M J. Targeting the DNA damage response in cancer[J]. Mol Cell, 2015, 60(4):547-560. |
 2016, Vol. 47
2016, Vol. 47

