人参Panax ginseng C. A. Meyer为五加科人参属多年生宿根草本植物,人参的肉质根为著名强壮滋补药,主要有效成分为人参皂苷和人参多糖[1],适用于调整血压、恢复心脏功能、神经衰弱及身体虚弱等症,也有降血压、祛痰、健胃、利尿、神经兴奋等功效,是我国珍贵中药材,药用历史悠久。主要分布于东北的吉林、辽宁、黑龙江等地[2]。近年来,随着人们生活水平的提高和保健意识的增强,人参需求量不断上升,与传统伐林栽参相比,农田栽参(非林地)一方面由于对森林资源与生态环境的保护作用[3],另一方面在于其易于管理和农田栽参技术的不断成熟[4]而被广泛应用。但是在农田管理过程中,农药、化肥、地膜、畜禽粪便和污泥堆肥产品等农用物质的不合理施用将导致农田土壤镉(Cd)量显著增加[5],农田栽参从某种程度上加重了人参Cd污染的风险。据统计我国中药材中重金属Cd的超标率为26.35%,是污染我国中药最为严重的重金属之一[6]。Cd不是植物生长的必需元素,Cd胁迫诱导植物产生过量活性氧,影响植物体内抗氧化酶活性[7],影响植物正常生长发育。本研究利用人参筒栽试验模拟土壤Cd污染,系统比较分析不同质量分数Cd胁迫下人参生长与生理特性的变化规律,为加深理解Cd对人参的伤害机制与制定农田栽参土壤环境质量标准提供理论依据,为确保人参药用食用安全提供技术支撑。
1 材料和方法 1.1 材料样品为二年生健康的人参幼苗,购买于吉林省抚松县,经吉林农业大学中药材学院杨世海教授鉴定为人参Panax ginseng C. A. Meyer。
1.2 试验设计采用筒栽土培方式于2014年5月初进行。试验用土选择未经其他污染的阔叶林下土壤,待土壤自然风干后,过5 mm筛,备用。土壤的基本理化性质为有机质51.20 g/kg,全氮2.53 g/kg,全磷0.55 g/kg,全钾20.02 g/kg,pH值8.65,Cd 0.123 mg/kg。根据土壤环境质量标准,Cd添加量共设5个处理水平,分别为0、0.3、1.0、2.0、4.0 mg/kg(以纯Cd2+计),Cd采用CdCl2•5H2O,各处理重复3次。试验用筒选择内径30 cm、高度45 cm的塑料桶,每桶装土约18 kg。将CdCl2•5H2O用水溶解后,分别加入土壤中拌匀,静置半个月后使用,使土壤各组分的Cd达到平衡,期间定期补水使土壤含水量维持在田间最大持水量的50%左右。人参种植采用移栽方式进行,选取生长良好、一致的幼苗,每株标记质量(W1),每筒栽种人参3株。将种植好的人参筒置于遮阴棚内(PVC蓝色塑料薄膜覆盖黑色遮阴网,透光率为30%),埋入土中,筒上边缘与地面齐平,模拟人参栽培地区的温湿度和光照条件,定期补水,保持70%左右的田间持水量。
1.3 人参生长量和叶绿素的测定于人参红果期(2015年8月初)取样,将各处理植株从筒中挖出,迅速带回实验室,植株生物量测定采用称质量法,先用自来水反复冲洗干净,最后用无菌水冲洗,吸水纸吸干表面水分,称取鲜质量(W2)。计算相对生长率。
相对生长率=(W2-W1)/W1
同样,在人参红果期选择晴朗天气上午(9︰00~10︰00),采用SPAD-502测定仪测定人参叶片的叶绿素量,10片叶测定后取平均值记为1次重复。
1.4 生理指标的测定丙二醛(MDA)按照硫代巴比妥酸法测定[8],超氧化物歧化酶(SOD)活性采用NBT还原法测定[8],过氧化物酶(POD)活性采用愈创木酚比色法测定[8],过氧化氢酶(CAT)活性采用紫外吸收法测定[8]。
1.5 数据处理所有数据均采用Excel 2007和SPSS 17.0软件制图表和统计学分析。
2 结果与分析 2.1 不同质量分数Cd胁迫下人参生物量变化由表 1可知,Cd胁迫对人参生长产生显著影响,人参相对生长率随着Cd胁迫质量分数的增加呈现逐渐降低的趋势。在0.3、1.0 mg/kg Cd处理下,人参相对生长率分别是1.88%和1.67%。而人参在2.0和4.0 mg/kg较高Cd处理下的相对生长率分别是1.43%和0.75%,对照组分别是其的1.5倍和2.8倍,差异均达到显著水平。经回归分析,人参相对生长率与Cd量之间呈显著负线性相关(Y=−0.323 X+2.037,P<0.05)。
|
|
表 1 Cd胁迫对人参生物量的影响 (x±s,n = 6) Table 1 Effect of Cd stress on growth of ginseng (x±s,n = 6) |
形态观察发现,Cd质量分数为0.3 mg/kg时,人参植株生长表现与对照组的情况相似,长势较好;随Cd质量分数的增加,可见植株矮小,叶片萎缩,结果率低等现象愈发严重,生长受到明显抑制。
2.2 不同质量分数Cd胁迫下人参叶片叶色值(SPAD)的变化Cd胁迫下人参叶片SPAD值的变化见图 1,人参叶片SPAD值的变化范围在29.4~33.0。与对照相比,0.3 mg/kg Cd处理下的人参叶片SPAD值较对照降低7.28%。当Cd达到1.0 mg/kg时,叶片SPAD值降低显著,较对照降低10.9%,之后随着Cd的处理水平的升高,在Cd处理质量分数为2.0、4.0 mg/kg时人参叶片SPAD值较对照分别降低了10.2%和10.0%。

|
图 1 Cd胁迫对人参叶片SPAD值的影响 Fig. 1 Effect of Cd stress on SPAD value of ginseng leaves |
植物体内的SOD能有效地将超氧负离子转变成H2O2,避免超氧自由基对膜的伤害,其活性与植物抗逆性有密切关系[9]。由图 2可以看出,随Cd处理水平的升高,人参根部SOD活性呈现先升高后降低的变化趋势,在Cd量为2 mg/kg时达到峰值,比对照高87.5%。人参茎与叶部SOD活性的变化表现为先升高,中间保持平稳,后下降,茎与叶部SOD活性分别在Cd处理质量分数为2.0 mg/kg和1.0 mg/kg时达到峰值,比对照增加41.5%和30.6%。可见,Cd处理水平低于2 mg/kg时,人参根、茎和叶部SOD的活性均高于对照,Cd胁迫提高了人参各器官SOD的活性,增强了人参清除超氧负离子的能力。在同一处理下,人参根、茎和叶的SOD量均表现为根>叶>茎,表明清除超氧负离子的能力为根>叶>茎。
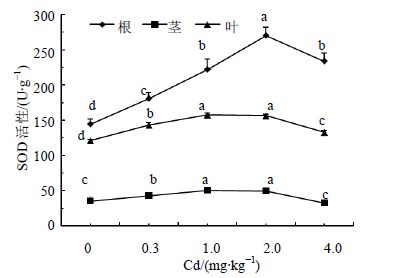
|
图 2 Cd胁迫对人参SOD活性的影响 Fig. 2 Effect of Cd stress on SOD activity of ginseng |
POD的活性能够反映植物对H2O2等活性氧的清除能力。由图 3可以看出,Cd胁迫下,人参茎叶POD活性上升缓慢,在Cd为1.0 mg/kg时到达峰值,茎和叶分别比对照增加20%和36%,差异显著(P<0.05),当Cd处理质量分数超过1.0 mg/kg时,人参茎叶POD活性持续下降,达到最低点时茎和叶分别比对照降低了45.4%和25.6%;根部POD活性在Cd为2.0 mg/kg时为2 063 U/(g·min)达到峰值,是对照的1.5倍,之后在Cd为4.0 mg/kg时根的POD活性下降至1 477 U/(g·min),高出对照10.2%。在同一处理下,人参根、茎和叶的SOD量均表现为根>叶>茎。
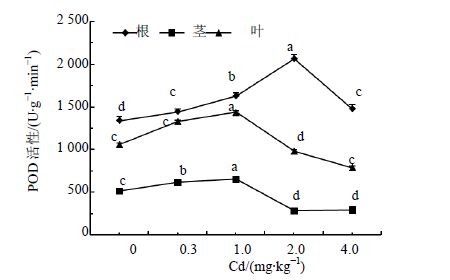
|
图 3 Cd胁迫对人参POD活性的影响 Fig. 3 Effect of Cd stress on POD activity of ginseng |
CAT具有分解H2O2的功能,能够提高植物抗环境胁迫能力[10]。由图 4可以看出,人参不同部位的CAT活性在Cd处理后有不同程度的增加,与对照相比,根部CAT活性显著增加,在4 mg/kg处理水平时达到最高,比对照增加116%。人参茎部CAT活性随着Cd处理质量分数的增加呈先升高后降低的变化趋势,在2.0 mg/kg时达到峰值,为对照的1.88倍。质量分数增加至4 mg/kg时,人参茎CAT活性为对照的1.76倍。人参叶部CAT活性略高于对照,差异未达到显著水平(P>0.05)。整体来看,Cd在0~1.0 mg/kg时,CAT活性以叶部最高,茎部居中,根部最低;当Cd在2.0~4.0 mg/kg时,CAT活性高低表现为茎>叶>根,表明人参各器官的CAT活性变化与土壤Cd质量分数密切相关。
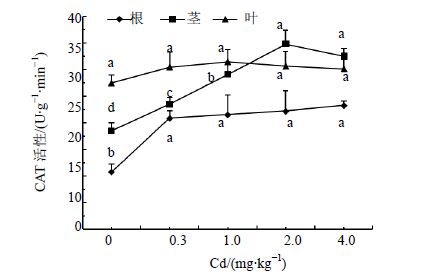
|
图 4 Cd胁迫对人参CAT活性的影响 Fig. 4 Effect of Cd stress on CAT activity of ginseng |
MDA是膜脂过氧化的主要产物,它具有很强的细胞毒性,对膜和细胞中的许多生物功能分子如蛋白质,核酸和酶等均有很强的破坏作用,并参与破坏生物膜的结构与功能。由图 5可以看出,在同一处理质量分数下,人参不同器官中MDA量表现为叶>茎>根。从不同Cd处理水平对人参各器官MDA量的影响来看,随着Cd处理质量分数的增加,人参各部位MDA的量均呈升高的趋势,在Cd处理质量分数为4.0 mg/kg时根和叶MDA量升到最高,分别比对照增加35.3%和164%,茎部MDA量在Cd处理质量分数为2.0 mg/kg时升到最高,比对照增加89.2%;整体分析,当Cd处理质量分数大于1.0 mg/kg时,人参各部位MDA量明显增加,膜脂过氧化损伤严重。经回归分析,人参根部与叶部MDA量与Cd添加质量分数之间分别呈极显著与显著的正线性相关(Y=0.001 X+0.004,P<0.01;Y=0.003 X+0.036,P<0.05)。
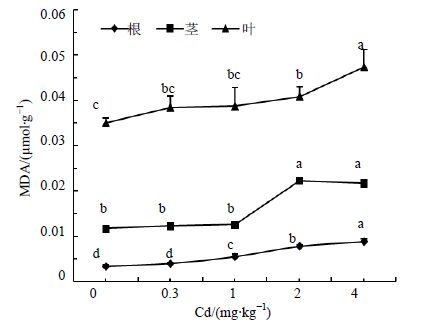
|
图 5 Cd胁迫对人参MDA量的影响 Fig. 5 Effect of Cd stress on content of MDA in ginseng |
相对生长率的变化是植物对Cd胁迫的综合体现,本实验中人参相对生长率随着Cd胁迫质量分数的增加呈现逐渐降低的趋势,经回归分析,人参相对生长率与Cd质量分数之间呈显著负线性相关,表明过量的Cd影响到了人参的正常新陈代谢,导致人参的生长受到抑制,这与张银秋等[11]对万寿菊的研究结果相一致。植物的叶绿素量变化规律可用叶片的SPAD值来表达,叶绿素量的高低可直接反映人参叶片功能活性的强弱[12]。Cd处理下,人参叶片SPAD值降低,当Cd处理水平达到1.0 mg/kg时叶片SPAD值显著低于对照,其可能原因是Cd被植物吸收后将改变叶绿素合成酶的正常构型[13],从而影响叶绿素的合成。
在正常条件下,细胞活性氧的产生与清除处于动态平衡状态[14]。过量的活性氧对细胞膜系统、脂类、蛋白质和核酸等生物大分子具有强烈破坏作用[15],从而影响植物体内抗氧化酶活性。SOD、POD、CAT等抗氧化酶组成了植物体内主要的活性氧清除酶系统,具有保护细胞抵御活性氧伤害的作用[16]。其中,SOD在保护酶系中处于核心地位,它的催化作用使超氧负离子转化为H2O2,CAT和POD的共同作用可清除植物中产生的过量H2O2,最终达到稳定保护膜结构的作用[17]。在低质量分数Cd胁迫下,人参SOD、POD和CAT这3种酶均有所升高,作为植物的自卫反应,保护酶活性的升高有利于清除细胞内的活性氧,随Cd施入量的增加这3种酶活性呈下降趋势,可能是高质量分数的Cd胁迫超过了人参自身防御反应的阈值,使保护酶的合成或结构受到影响,活性受到抑制,从而使植物体内活性氧的产生和清除系统失衡,并利于细胞活性氧的产生,导致人参的生理代谢紊乱、细胞内多种功能受到破坏。
Cd胁迫诱发的过多活性氧伤害生物膜过程中,最重要的脂质过氧化产物是MDA,其量高低能够反映细胞膜脂过氧化作用的强弱[18]。本实验中,Cd胁迫下人参各器官中MDA量增加,在相同Cd质量分数胁迫下,人参MDA量表现为叶>茎>根;在不同Cd质量分数胁迫下,人参根部与叶部MDA量与Cd添加质量分数之间分别呈极显著与显著的正线性相关,人参茎部MDA量在Cd处理质量分数>2.0 mg/kg时显著增加。说明在Cd毒害人参过程中导致植物体内产生大量活性氧、自由基,引发膜脂过氧化作用,损伤膜的正常结构和功能,这与刘周莉等[19]和赵杨迪等[20]的研究结果一致。
综上所述,植物受到重金属Cd胁迫,可增强抗氧化酶活性等生理生化反应来缓解Cd胁迫带来的伤害,人参具有适应一定Cd(≤1.0 mg/kg)的能力。然而,Cd>1.0 mg/kg时,人参MDA量明显增加,出现严重氧化损伤,植物生长受阻,生物量下降。本研究可为进一步探讨人参对Cd污染的防御机制以及筛选对Cd污染抗性强的人参品种提供参考。
| [1] | 黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1):164-166. |
| [2] | 谢彩香, 索风梅, 贾光林, 等. 人参皂苷与生态因子的相关性[J]. 生态学报, 2011, 31(24):7551-7563. |
| [3] | 梁尧, 李刚, 曹庆军, 等. 人参产地土壤重金属污染现状及其修复技术的研究进展[J]. 中药材, 2013, 36(10):1709-1713. |
| [4] | 刘雅坤. 农田栽参种子处理及播种技术[J]. 农业开发与装备, 2014(12):121. |
| [5] | 樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22(10):1727-1736. |
| [6] | 赵连华, 杨银慧, 胡一晨, 等. 我国中药材中重金属污染现状分析及对策研究[J]. 中草药, 2014, 45(9):1199-1206. |
| [7] | 李丽锋, 卢佳, 苏芳莉. 镉胁迫对芦苇叶片SOD、POD活性影响及动力学分析[J]. 沈阳农业大学学报, 2014, 45(3):326-330. |
| [8] | 张治安, 陈展宇. 植物生理学实验技术[M]. 长春:吉林大学出版社, 2008. |
| [9] | Daud M K, He Q L, Lei M, et al. Ultrastructural, metabolic and proteomic changes in leaves of upland cotton in response to cadmium stress[J]. Chemosphere, 2015(120):309-320. |
| [10] | 黄小芳, 李勇, 易茜茜, 等. 五种化感物质对人参根系酶活性的影响[J]. 中草药, 2010, 41(1):117-121. |
| [11] | 张银秋, 台培东, 李培军, 等. 镉胁迫对万寿菊生长及生理生态特征的影响[J]. 环境工程学报, 2011, 5(1):195-199. |
| [12] | Liang Q H, Huang W H, Jarvis P. Use of a SPAD meter to measure leaf chlorophyll concentration in Arbidopsis thaliana[J]. Photosynth Res, 2011, 107:209-213. |
| [13] | 张鑫, 李昆伟, 陈康健, 等. 镉胁迫对丹参生长及有效成分积累的影响研究[J]. 植物科学学报, 2013, 31(6):583-589. |
| [14] | 周丽, 郎多勇, 张文晋, 等. NaCl胁迫对银柴胡生长及生理生化特性的影响[J]. 中草药, 2014, 45(19):2829-2833. |
| [15] | Jiao L L, Li B, Wang M Z, et al. Antioxidant activities of the oligosaccharides from the roots, flowers and leaves of Panax ginseng C. A. Meyer[J]. Carbohydrate Polymers, 2014, 106:293-298. |
| [16] | 李刚, 段留生, 王保民, 等. 植物生长物质HKL-4对甘草叶片活性氧代谢及PSII光化学效率调控的研究[J]. 中国中药杂志, 2006, 31(20):1674-1677. |
| [17] | 郑秀芳, 王桔红, 汪小东, 等. NaCl胁迫对披针叶黄华愈伤组织生理特性的影响[J]. 中草药, 2013, 44(21):3048-3052. |
| [18] | 刘爱荣, 张远兵, 陈登科. 盐处理对盐芥(Thellungiella halophila)生长和抗氧化酶活性的影响[J]. 植物研究, 2006, 26(2):216-220. |
| [19] | 刘周莉, 何兴元, 陈玮. 镉胁迫对金银花生理生态特征的影响[J]. 应用生态学报, 2009, 20(1):40-44. |
| [20] | 赵杨迪, 潘远智, 刘碧英. 玉竹对土壤Cd、Pb的吸收和耐性研究[J]. 农业环境科学学报, 2010, 29(11):2087-2093. |
 2016, Vol. 47
2016, Vol. 47


