天麻素是兰科天麻属植物天麻Gastrodia elata Bl. 的主要有效成分,具有镇静、镇痛、抗癫痫等多种药理作用,广泛应用于偏头痛、晕眩等脑部疾病的治疗[1, 2, 3, 4, 5]。天麻素为水溶性药物,由于血脑屏障(BBB)的存在,常规途径给药后脑内药物浓度低,严重影响天麻素在脑部神经中枢的作用。相关文献报道[6, 7],天麻素可经鼻吸收,且在脑组织中分布高于静脉给药。天麻素在鼻腔内的释药量与鼻黏膜黏附性相关,可因其黏附性显著增加[8]。天然高分子聚合物淀粉具有良好的生物黏附特性,遇到鼻黏液时可高度膨胀,形成凝胶体系,黏附在鼻黏膜表面,可以延长药物的滞留时间[9, 10]。此外,淀粉的生物相容性与生物降解性非常优良,对鼻黏膜无毒性。
为解决普通剂型释药快、药物鼻黏膜滞留时间短、给药频繁及给药剂量大等问题,本实验以淀粉为黏附材料,采用复乳化交联法研制了天麻素淀粉微球。通过对比天麻素及天麻素淀粉微球对鼻黏膜的黏附力及其在鼻腔内的释药特性来评价天麻素淀粉微球处方与工艺的科学性、可行性,为天麻素鼻用淀粉微球的后续开发提供理论依据。
1 仪器与材料安捷伦1200高效液相色谱仪,美国Agilent公司;XS105 Dual Range型分析天平,瑞士Mettler- Toledo仪器有限公司;JA2003N型电子天平,上海精密科学仪器科技有限公司;RCZ-6C2型药物溶出度仪,上海黄海药检仪器有限公司;DZF6050型真空干燥箱,上海精宏实验设备有限公司;85-2A数显恒温测速磁力搅拌器,金坛市城东新瑞仪器厂;SHZ-82恒温振荡器,常州国华电器有限公司;Motic B2 Series System Microscope,中国MOTIC公司;USB工业相机B-300,像素:3.0 Megapixel;光学尺寸:1/2;S-3000N扫描电子显微镜,日本HITACHI公司;Milli-Q Biocel纯水机,美国Millipore公司。
天麻素对照品,批号110807-200205,质量分数96.8%,中国食品药品检定研究院;天麻素原料药,批号0601-2012-05009,质量分数98.7%,浙江诚意有限公司;可溶性淀粉,批号23445,阿拉丁试剂有限公司;液体石蜡(批号20120227)、Span 80(批号20121023)、NaOH(批号20130627)、环氧氯丙烷(批号20111018)、无水乙醇(批号20120922)、醋酸乙酯(批号20120702),成都市科龙化工试剂厂;丙酮,批号20120315,杭州化学试剂有限公司;活性炭,批号F20041027,国药集团化学试剂有限公司;水为超纯水。
中华大蟾蜍Bufo bufo gargarizans Cantor,体质量30~40 g,由浙江中医药大学实验动物中心提供。
2 方法与结果 2.1 淀粉微球制备方法 2.1.1 天麻素淀粉微球称取淀粉适量,溶于0.1 g/mL的NaOH溶液配成淀粉溶液,静置30 min除去气泡,作为初乳的“外相”。将天麻素分散于醋酸乙酯中作初乳的“内相”。将内相滴入外相中得水包油型(O/W)初乳。将初乳加入含乳化剂的油相中,乳化20 min,再加入交联剂,交联一定时间后,离心,倾去上层油相,下层微球分别以醋酸乙酯、无水乙醇、丙酮各洗涤数次,减压干燥,得天麻素淀粉微球。
2.1.2 空白淀粉微球称取3.5 g乳化剂Span 80于150 mL烧杯中,加入液体石蜡100 mL,40 ℃水浴磁力搅拌,混合均匀,作为油相。称取3.5 g可溶性淀粉,溶于10 mL 0.1 g/mL的NaOH溶液静置30 min至溶液澄清,作为水相。在1 000 r/min搅拌速率下,将水相均匀缓慢的加入油相,制成W/O型乳液。乳化20 min至乳滴分散均匀,加入环氧氯丙烷4 mL,固化反应3 h,倾去油相,下层微球分别以醋酸乙酯、无水乙醇、丙酮各洗涤数次,减压干燥,得空白淀粉微球。
2.2 天麻素淀粉微球中天麻素HPLC定量测定方法的建立 2.2.1 天麻素对照品溶液的配制取天麻素对照品约12 mg,精密称定,置25 mL量瓶中,以适量甲醇-水(1∶1)溶解,稀释至刻度,即得天麻素对照品溶液,4 ℃保存备用。
2.2.2 天麻素淀粉微球溶液的制备取天麻素淀粉微球约100 mg,精密称定,置于10 mL量瓶中,用pH 6.8的PBS配制的淀粉酶溶液(mg/mL)溶解,稀释至刻度,60 ℃水浴加热,1 000 r/min搅拌1 h。天麻素淀粉微球水解完全,静置至室温,甲醇-水(1∶1)稀释,过0.45 μm微孔滤膜,取续滤液,即得天麻素淀粉微球溶液。
2.2.3 空白淀粉微球溶液的制备取空白淀粉微球约100 mg,精密称定,置于10 mL量瓶中,用pH 6.8的PBS配制的淀粉酶溶液(mg/mL)溶解,稀释至刻度,60 ℃水浴加热,1 000 r/min搅拌1 h。空白淀粉微球水解完全,静置至室温,甲醇-水(1∶1)稀释,过0.45 μm微孔滤膜,取续滤液,即得空白淀粉微球溶液。
2.2.4 色谱条件色谱柱为Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(3∶97);体积流量1.0 mL/min;检测波长220 nm;柱温30 ℃;进样量10 μL。
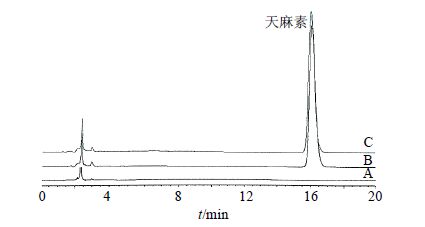
2.2.5 专属性试验按上述“2.2.1”“2.2.2”“2.2.3”项方法分别配制天麻素对照品溶液、空白淀粉微球溶液和天麻素淀粉微球溶液,在“2.2.4”项色谱条件下进样测定。天麻素对照品溶液、空白淀粉微球溶液和天麻素淀粉微球溶液的色谱图见图 1,天麻素峰保留时间约16.2 min,在所选择的色谱条件下,空白淀粉微球不干扰天麻素微球的测定。
|
图 1 空白淀粉微球 (A)、天麻素对照品(B) 和天麻素淀粉微球 (C) 的HPLC色谱图 Fig. 1 HPLC of blank starch microspheres (A),gastrodin reference substance (B),and gastrodin starch microspheres (C) |
精密移取一定体积的天麻素对照品储备液,用甲醇-水(1∶1)配制一系列天麻素对照品溶液,质量浓度分别为0.02、0.05、0.10、0.15、0.20、0.25、0.30 mg/mL,过0.45 μm微孔滤膜,取续滤液,在上述“2.2.4”项色谱条件下进样测定。以天麻素峰面积积分值(Y)对天麻素对照品溶液的质量浓度(X)进行线性回归,得回归方程Y=18 097 X-31.358,r=0.999 7,结果表明,天麻素质量浓度在0.02~0.30 mg/mL与峰面积呈良好的线性相关性。
2.2.7 重复性试验称取天麻素淀粉微球适量,6份,精密称定,按上述“2.2.2”项方法配制天麻素淀粉微球溶液,在“2.2.4”项色谱条件下进样测定,计算微球中天麻素的量及RSD。结果RSD为1.00%,重复性符合要求。
2.2.8 加样回收率试验称取已测定天麻素量的天麻素淀粉微球适量,共9份,精密称定,置于10 mL量瓶中,于每份样品中分别加入一定量的精密称定的天麻素对照品,按上述“2.2.2”项方法配制高、中、低(样品中天麻素量的120%、100%、80%)3种质量浓度供试品溶液,在“2.2.4”项色谱条件下进样测定,计算回收率及RSD值。结果天麻素平均回收率为98.97%,RSD为1.76%,天麻素淀粉微球的回收率符合要求。
2.3 评价指标 2.3.1 外观形态取适量干燥的天麻素淀粉微球,于扫描电镜下观察其外观形态。
2.3.2 粒径及粒径分布将天麻素淀粉微球均匀分散于纯水中,滴于载玻片上,用带标尺的显微镜测定粒径及粒径分布。
2.3.3 载药量和包封率按“2.2.2”项方法制备天麻素淀粉微球溶液,在“2.2.4”项色谱条件下进样测定,求得微球中天麻素的量并计算其载药量和包封率。
载药量=m/M1
包封率=m/M2
m为微球中天麻素质量,M1为天麻素淀粉微球质量,M2为天麻素投药量
2.4 天麻素淀粉微球处方与制备工艺单因素考察 2.4.1 药辅比的选择按“2.1.1”项下制备方法分别制备天麻素与淀粉质量比为0.2∶3.5、0.6∶3.5、1.0∶3.5、1.5∶3.5、2.0∶3.5、3.0∶3.5的天麻素淀粉微球,测定其载药量和包封率,结果载药量分别为1.62%、5.00%、7.00%、9.63%、11.4%、14.09%,包封率分别为39.65%、 46.84%、38.18%、38.49%、29.22%、33.31%。可知,随着药辅比的增大,微球的载药量升高,但包封率整体呈下降趋势。
2.4.2 淀粉质量分数的选择配制质量分数分别为25%、35%、45%的淀粉溶液,按“2.1.1”项下制备方法分别制备天麻素淀粉微球,测定其载药量和包封率,结果载药量分别为11.51%、11.07%、12.25%,包封率分别为32.62%、32.55%、44.54%。可知,淀粉质量分数对载药量影响不大,包封率随淀粉质量分数增加而升高。
2.4.3 油水比的选择按“2.1.1”项下制备方法分别制备油水比为8∶1、10∶1、12∶1的天麻素淀粉微球,测定其载药量和包封率,结果载药量分别为11.72%、11.57%、10.03%,包封率分别为37.29%、38.74%、33.65%。可知,油水比对载药量和包封率均无显著影响。
2.4.4 乳化剂Span80用量的选择 在100 mL油相中分别加入乳化剂2.5、3.5、4.5 g,配制质量分数为2.5%、3.5%、4.5%的Span 80溶液。按“2.1.1”项下制备方法分别制备天麻素淀粉微球,测定其载药量和包封率,结果载药量分别为9.94%、11.32%、8.48%,包封率为26.59%、35.65%、28.09%。可知,Span 80的用量为3.5 g最好。
2.4.5 交联剂环氧氯丙烷(ECH)用量的选择按“2.1.1”项下制备方法,每3.5 g淀粉中分别加入4、5、6 mL ECH制备天麻素淀粉微球,测定其载药量和包封率,结果载药量分别为11.32%、10.93%、10.50%,包封率为35.65%、32.36%、33.70%。可知,淀粉为3.5 g时,ECH用量选用4 mL较好。
2.4.6 制备温度的选择分别在30、40、45、50 ℃条件下制备天麻素淀粉微球,测定微球的载药量和包封率,结果载药量分别为10.68%、11.32%、10.48%、12.08%,包封率分别为32.59%、35.65%、35.58%、37.08%。可知,温度对于载药量和包封率的影响并不明显。但50 ℃时制备的微球呈略焦黄色,所以40 ℃最适宜。
2.4.7 搅拌速率的选择分别在600、1 000、1 400 r/min搅拌速率下制备天麻素淀粉微球,测定微球的载药量和包封率,结果载药量分别为9.42%、11.32%、8.72%,包封率分别为28.76%、35.65%、27.59%。可知,搅拌速率选用1 000 r/min最适宜。
2.5 均匀设计法优化天麻素淀粉微球的处方工艺 2.5.1 试验设计及结果在单因素考察的基础上,选择对天麻素淀粉微球影响最显著的3个因素药辅比(X1)、淀粉质量分数(X2)、油水比(X3)为研究对象,以微球平均粒径(Y1)、载药量(Y2)、包封率(Y3)为评价指标。按均匀设计表U8(85) 进行实验设计,见表 1。
|
|
表 1 处方工艺优化均匀设计表 Table 1 Uniform design of prescription process optimization |
将表 1的实验结果用SPSS 19.0软件处理,分别以3个指标进行2次多项式逐步回归分析,得回归方程:Y1=26.186+9.052 X1,r=0.820,P=0.015;Y2=−0.052+5.107 X1,r=0.993,P=0.000;Y3=16.099+0.458 X2,r=0.865,P=0.009。回归方程结合单因素考察结果,优化后的处方工艺如下:天麻素2.0 g,淀粉4.5 g,液体石蜡100.0 mL,Span 80用量3.5 g,ECH 5.1 mL,制备温度40 ℃,搅拌速率1 000 r/min。
2.5.2 处方验证根据优化后的处方工艺条件,按“2.1.1”项下制备方法,制备3批天麻素淀粉微球,分别测定3批微球的平均粒径、载药量和包封率进行处方验证,结果见表 2。结果表明该处方工艺稳定,制备的天麻素淀粉微球符合鼻腔给药的要求。
|
|
表 2 天麻素淀粉微球处方验证结果 Table 2 Prescription verification of gastrodin starch microspheres |
取蟾蜍12只,用探针破坏脊髓后,用大头针将其仰卧固定于蛙板上,止血钳牵拉使口腔张开,上腭黏膜充分暴露。将适量活性炭炭粒(研磨后过200目筛)置于两眼窝前缘间的黏膜上,通过黏膜上纤毛的摆动,观察到炭粒逐渐向食管口方向移动,用秒表记录炭粒移动至食道口处(约1 cm)所需的时间,每只蟾蜍平行测定6次,每次测定后,放下止血钳,闭合蟾蜍口腔10 min,使黏膜湿润恢复,测定结果取均值作为该蟾蜍的黏膜滞留时间,计算基础纤毛清除速率;测定完毕后,用生理盐水冲洗黏膜表面,吸干多余的生理盐水,闭合蟾蜍口腔,30 min后,暴露口腔,在黏膜上放置载药微球,同法记录黏膜滞留时间,计算纤毛的清除速率,以此来评价微球的黏膜黏附力[11]。结果发现炭粒组与天麻素淀粉微球组的黏膜滞留时间分别为(176.92± 23.25)、(944.33±68.29)s(n=12),纤毛清 除速率分别为(0.34±0.05)、(0.06±0.01)mm/min(n=12)。经理论折算,天麻素淀粉微球在人体鼻腔内的滞留时间约为3 h,无黏附性粉末在人鼻黏膜的滞留时间仅为20~30 min。天麻素淀粉微球的黏膜滞留时间明显延长,纤毛的清除速率减小,天麻素淀粉微球具有良好的黏膜黏附性。
2.7 天麻素淀粉微球体外释药特性的考察取天麻素原料药约25 mg及天麻素淀粉微球约250 mg,各3份,精密称定,分别装于透析袋中,用2 mL生理盐水分散,透析袋两端扎紧,系于溶出仪搅拌桨上。溶出杯中加入释放介质生理盐水100 mL,(37.0±0.1)℃恒温水浴,100 r/min搅拌,分别在0.25、0.5、0.75、1.0、1.5、2.0、3.0、4.0、6.0 h取样1 mL,同时补充生理盐水1 mL,甲醇-水(1∶1)稀释后(天麻素原料药5倍稀释,微球10倍稀释),0.45 μm有机滤膜滤过,在“2.2.4”项色谱条件下进样测定。根据随行标准曲线求得每个取样时间点释放介质中天麻素的量,计算累积释药率(Q)并绘制天麻素原料药及天麻素淀粉微球的体外释药曲线,见图 2。结果显示,天麻素原料药30 min Q达60%以上,2 h时基本完全释放;天麻素淀粉微球2 h释放80%,3 h释放90%以上,具有一定的缓释作用。

|
图 2 天麻素原料药及天麻素淀粉微球的体外释放曲线 Fig. 2 Release curves of gastrodin API and gastrodin starch microspere in vitro |
将天麻素淀粉微球的体外释药结果分别用零级释放模型、一级释放模型、Higuchi模型、Ritger- pappas模型、Weibull模型等进行拟合。结果天麻素淀粉微球的体外释放拟合均最接近Weibull模型,见表 3。由Weibull方程求得天麻素淀粉微球的t50(释放50%所需时间)为40.08 min及t90(释放90%所需时间)为245.73 min。由表中结果可知,天麻素淀粉微球具有一定的缓释作用,能满足鼻腔给药要求。
|
|
表 3 天麻素淀粉微球体外溶出模型拟合结果 Table 3 In vitro dissolution model fitting results of gastrodin starch microsphere |
以甲醇-水(3∶97)为流动相,分别用甲醇-水(1∶1)与流动相作溶剂溶解天麻素,HPLC测定,比较发现以甲醇-水(1∶1)为溶剂时,天麻素峰对称因子好,且柱效高,因而确定用其作为天麻素的溶剂。
目前常用的处方优化实验方法有正交设计、均匀设计等,正交设计因其“整齐可比,均匀分散”而被广泛应用,但正交设计仅对已有因素的已有水平进行判断,只能确定主要因素,却不能定量地描述因素对指标的影响程度。均匀设计舍弃了正交设计的“整齐可比”的特性,而让试验点在实验范围内均匀分散,大大减少了实验次数,且实验结果可借助计算机处理,通过回归方程得出理论的最佳实验条件[12]。所以本实验选用均匀设计法来优化天麻素淀粉微球的处方工艺。
鼻黏膜给药微球的粒径对药物在鼻腔中分布影响较大。当粒径小于10 μm时,微球会随气流进入支气管,而当粒径很大时,微球主要分布在外鼻腔非纤毛区,药物吸收差。因此,鼻黏膜给药微球的粒径最好在40~60 μm,本实验制备的空白淀粉微球平均粒径为47.69 μm,符合要求。
鼻黏膜黏附性实验结果显示,天麻素淀粉微球在蟾蜍黏膜的滞留时间为944.33 s,约为无黏附性粉末滞留时间的5倍,相当于人体鼻腔的滞留时间约为3 h,说明天麻素淀粉微球具有良好的黏膜黏附力,能延长天麻素在鼻腔内的滞留时间。
体外释药特性试验中,由于释放介质体积较小,整个释放过程介质的损失对天麻素定量测定造成了较大的影响,因此在测定过程中进行体积校正以减少实验误差。天麻素原料药30 min累积释药达60%以上,2 h时基本完全释放,而天麻素淀粉微球2 h释放80%,3 h释放90%以上,说明其具有一定的缓释作用。
结合体外释药曲线及体外释药模型拟合结果,天麻素淀粉微球的释药过程可分为3个阶段,突释阶段:药物释放非常迅速,这一阶段释放的主要是吸附在微球表面的药物;缓慢释放阶段:微球的分子链被降解,其中吸附的药物缓慢而均匀地释放;平衡缓释阶段:这一阶段,微球内的药物与微球附近释放介质内的药物达到吸附-解吸平衡,随着微球附近的药物向介质本体的扩散,以及微球在介质中的溶胀、解体,有少量的药物从微球向外释放。
结合天麻素淀粉微球的黏膜黏附性与体外释药实验结果可知,天麻素淀粉微球在鼻腔滞留3 h期间基本释药完全,有效解决鼻黏膜滞留时间短、释药快等问题,有望提高天麻素的生物利用度。
| [1] | 龚其海, 石京山, 杨丹莉, 等. 天麻素在中枢神经系统的药理作用及其机制[J]. 中国新药与临床杂志, 2011, 30(3):176-179. |
| [2] | 刘慧兰, 曹克刚, 高永红, 等. 天麻素预防大鼠偏头痛发作的功效评价及其作用机制研究[J]. 中国中医药信息杂志, 2008, 15(2):32-33. |
| [3] | 乔爱敏, 栗俞程, 刘珍伶, 等. 天麻素对高糖诱导的人脐静脉内皮细胞氧化应激的影响[J]. 中草药, 2013, 44(15):2118-2123. |
| [4] | 杨汀, 樊光辉. 天麻素治疗神经系统疾病机制研究进展[J]. 华南国防医学杂志, 2013, 27(2):131-132. |
| [5] | 张乐多, 龚晓健, 胡苗苗, 等. 天麻素抗血管性痴呆作用及其机理[J]. 中国天然药物, 2008, 6(2):130-134. |
| [6] | 蔡铮, 侯世祥, 杨兆祥, 等. 天麻素鼻用原位凝胶脑靶向性研究[J]. 四川大学学报, 2008, 39(3):438-440. |
| [7] | Cai Z, Song S R, Sun F, et al. Formulation and evaluation of in situ gelling system for intranasal administration of gastrodin[J]. AAPS Pharm Sci Tech, 2011, 12(4):1102-1109. |
| [8] | 蔡铮, 侯世祥, 宋相容, 等. 天麻素离子敏感鼻用原位凝胶体外释药研究[J]. 中国中药杂志, 2008, 33(7):760-762. |
| [9] | 唐倩, 袁拥华, 谢庆娟. 生物黏附传递系统进展概况[J]. 现代医药卫生, 2007, 23(23):3531-3533. |
| [10] | 罗洁琦, 沙先谊, 方晓玲. 三七总皂苷离子敏感型鼻用原位凝胶的制备[J]. 中草药, 2011, 42(7):1299-1304. |
| [11] | John W. Bioadhesion new possibilities for drug administration[J]. J Clin Pharmacokinet, 2001, 40(2):77-84. |
| [12] | 马路, 刘剑刚, 史大卓. 均匀设计在中医药研究中的应用[J]. 中国中西医结合杂志, 2005, 25(3):278-281. |
 2016, Vol. 47
2016, Vol. 47


