2. 天津药物研究院, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
粉萆薢为薯蓣科(Dioscoreaceae)植物粉背薯蓣Dioscorea hypoglauca Palibin的干燥根茎,主产于安徽、浙江、湖北、四川等地。粉萆薢味苦,性平,归肾、胃经,具有利湿去浊、祛风除痹等功效。临床用于膏淋、白浊、白带过多、风湿痹痛、关节不利、腰膝疼痛等[1]。研究报道,粉萆薢具有抗癌、抗炎、抗病原微生物、抗痛风、降血压和提高免疫力等功效[2, 3, 4, 5]。课题组前期报道了从粉萆薢70%乙醇提取部位分离得到16个化合物[6],其中有2个二芳基庚烷类化合物为首次从该植物中分离得到,推测粉萆薢中尚有多种二芳基庚烷类成分需分离鉴定。二芳基庚烷类化合物具有显著的抗肿瘤活性,尤其以姜科植物中姜黄素为代表,具有多效性和途径多样性特点,通过诱导癌细胞凋亡、阻滞癌细胞周期、调控蛋白因子和活性因子的活性等机制对头颈部鳞状细胞癌、前列腺癌和乳腺癌细胞等多种肿瘤细胞有明显抑制作用[7, 8, 9]。美国国立肿瘤研究所已将姜黄素列为第3代癌化学预防药[10]。
本实验对具有抗肿瘤活性的脂溶性成分二芳基庚烷类进行分离鉴定,得到了13个化合物,包括3个二芳基庚烷类和一些其他类化合物,分别为7-(4-羟基-3-甲氧基苯基)-1-(4-羟基苯基)-4,6-庚烷-3-酮(tsaokoarylone,1)、1,7-双-(4-羟基苯基)-1,4,6-庚三烯-3-酮 [1,7-bis (4-hydroxyphenyl)-1,4,6-heptabien- 3-one,2]、1,7-双-(4-羟基苯基)-4,6-庚二烯-3-酮 [1,7-bis (4-hydroxyphenyl)-4,6-heptatrien-3-one,3]、大黄素(emodin,4)、7-羟基-2,6-二甲氧基-1,4-菲醌(7-hydroxy-2,6-dimethoxy-1,4-phenanthrenequinone,5)、薯蓣皂苷元(diosgenin,6)、鲁可斯皂苷元(ruscogenin,7)、山柰酚(kaempferol,8)、(3S)-6,8-二羟基-3-苯基-3,4-二氢异香豆素(3S-6,8-dyhydroxy- 3-phenyl-3,4-dihydroisocoumarins,9)、5-羟甲基糠醛(5-hydroxymethylfurfural,10)、β-谷甾醇(β-sitosterol,11)、豆甾醇(stigmasterol,12)、二十六烷酸(hexacosanoic acid,13)。化合物4、5、7、8、12、13为首次从粉萆薢中分离得到,化合物1、10为首次从薯蓣属植物中分离得到。
1 仪器与材料Bruker Avance DRX-400型超导核磁共振仪、Bruker Avance DRX-500型超导核磁共振仪(德国Bruker公司);Varian Inova-600型核磁共振仪(美国Varian公司);TU-1810型紫外-可见分光光度计(北京普析通用仪器有限公司)。柱色谱硅胶(160~300目,青岛海洋化工厂);薄层色谱用硅胶H、硅胶G预制薄层板(20 cm×20 cm,青岛海洋化工厂);Sephadex LH-20(北京金欧雅科技发展有限公司)。其他试剂均为分析纯,北京化工厂产品。
粉萆薢药材购自河北光明饮片责任有限公司,产地浙江,经北京中医药大学中药鉴定系张贵君教授鉴定为薯蓣科植物粉背薯蓣Dioscorea hypoglauca Palibin的干燥根茎。
2 提取与分离取粉萆薢药材9 kg,10倍量95%乙醇回流提取3次,每次2 h,提取液减压浓缩至无醇味,加入一定量的水稀释溶解,转移至分液漏斗中,分别用石油醚、氯仿、醋酸乙酯依次萃取,各萃取液回收溶剂,减压干燥,得干浸膏石油醚部位(18.47 g)、氯仿部位(52.40 g)、醋酸乙酯部位(35.90 g)。取石油醚部位,经硅胶柱分离,石油醚-醋酸乙酯(100∶1→1∶3)梯度洗脱,合并后得组分Fr. 1~8。组分Fr. 3~7再反复经硅胶柱分离,得到化合物4(11 mg)、11(6 mg)、12(8 mg)、13(18 mg)。取氯仿部位,经硅胶柱分离,石油醚-醋酸乙酯(10∶1→1∶10)梯度洗脱,合并后得组分Fr. 9~16,Fr. 11~12再反复经硅胶、反相硅胶和凝胶柱分离,得到化合物1(16 mg)、2(20 mg)、3(18 mg)、5(10 mg)、9(15 mg)、10(7 mg)。取醋酸乙酯部位,经硅胶柱分离,二氯甲烷-甲醇(500∶1→1∶10)梯度洗脱,合并后得组分Fr. 17~18,再反复经正、反相硅胶和凝胶柱分离,得到化合物6(16 mg)、7(9 mg)、8(12 mg)。
3 结构鉴定化合物1:黄色无定形粉末,mp 51~53 ℃,10%硫酸-乙醇反应显粉红色,三氯化铁-铁氰化钾反应呈阳性。1H-NMR (500 MHz,CD3OD) δ: 2.82 (2H,m,H-1),2.89 (2H,m,H-2),6.20 (1H,d,J = 15.2 Hz,H-4),7.56 (1H,dd,J = 15.2,10.4 Hz,H-5),6.85 (1H,dd,J = 15.2,10.4 Hz,H-6),6.96 (1H,d,J = 15.6 Hz,H-7),7.03 (2H,d,J = 8.8 Hz,H-2′,6′),6.68 (2H,d,J = 8.8 Hz,H-3′,5′),3.33 (3H,s,H-3″),6.81 (1H,d,J = 8.4 Hz,H-5″),7.00 (1H,dd,J = 8.4,2.0 Hz,H-6″);13C-NMR (125 MHz,CD3OD) δ: 30.8 (C-1),43.0 (C-2),202.1 (C-3),128.8 (C-4),145.4 (C-5),124.2 (C-6),143.2 (C-7),132.6 (C-1′),129.8 (C-1″),110.4 (C-2″),148.4 (C-3″),148.5 (C-4″),116.3 (C-5″),122.5 (C-6″)。以上数据与文献报道基本一致[11],故鉴定化合物1为7-(4-羟基-3-甲氧基苯基)-1-(4-羟基苯基)-4,6-庚烷-3-酮,结构见图 1。
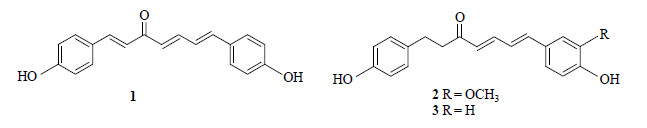 | 图 1 粉萆薢中分离得到3个二芳基庚烷类化合物的结构 Fig.1 Structures of three diarylheptonoids isolated from rhizome of D. hypoglaucae |
化合物2:橘黄色粉末(甲醇),10%硫酸-乙醇反应显紫色,三氯化铁-铁氰化钾反应呈阳性。1H-NMR (500 MHz,CD3OD) δ: 7.88 (1H,d,J = 16.0 Hz,H-1),6.98 (1H,d,J = 16.0 Hz,H-2),6.66 (1H,d,J = 15.0 Hz,H-4),7.67 (1H,m,H-5),6.93 (1H,m,H-6),6.95 (1H,d,J = 15.5 Hz,H-7),7.60 (2H,d,J = 8.5 Hz,H-2′,6′),6.84 (2H,d,J = 8.5 Hz,H-3′,5′),7.41 (2H,d,J = 8.5 Hz,H-2″,6″),6.80 (2H,d,J = 8.5 Hz,H-3″,5″);13C-NMR (125 MHz,CD3OD) δ: 145.0 (C-1),123.3 (C-2),191.7 (C-3),129.4 (C-4),146.0 (C-5),125.3 (C-6),143.6 (C-7),127.7 (C-1′),131.6 (C-2′,6′),116.8 (C-3′,5′),161.6 (C-4′),129.8 (C-1″),130.2 (C-2″,6″),116.9 (C-3″,5″),160.2 (C-4″)。以上数据与文献报道基本一致[12],故鉴定化合物2为1,7-双-(4-羟基苯基)-1,4,6-庚三烯-3-酮,结构见图 1。
化合物3:黄色无定形粉末(甲醇),10%硫酸-乙醇反应显橘黄色,三氯化铁-铁氰化钾反应呈阳性。1H-NMR (500 MHz,CD3OD) δ: 2.83 (2H,t,J = 7.4 Hz,H-1),2.77 (2H,t,J = 7.4 Hz,H-2),6.19 (1H,d,J = 15.5 Hz,H-4),7.30 (1H,dd,J = 15.5,10.8 Hz,H-5),6.74 (1H,dd,J = 15.5,10.8 Hz,H-6),6.90 (1H,d,J = 15.5 Hz,H-7),6.97 (2H,d,J = 8.5 Hz,H-2,6′),6.63 (2H,d,J = 8.5 Hz,H-3′,5′),7.33 (2H,d,J = 8.5 Hz,H-2″,6″),6.71 (2H,d,J = 8.5 Hz,H-3″,5″);13C-NMR (125 MHz,CD3OD) δ: 30.8 (C-1),43.2 (C-2),202.9 (C-3),129.2 (C-4),146.1 (C-5),124.9 (C-6),143.6 (C-7),133.3 (C-1′),130.5 (C-2′,6′),116.7 (C-3′,5′),156.6 (C-4′),129.2 (C-1″),130.5 (C-2″,6″),116.7 (C-3″,5″),160.1 (C-4″)。以上数据与文献报道基本一致[13],故鉴定化合物3为1,7-双- (4-羟基苯基)-4,6-庚二烯-3-酮,结构见图 1。
化合物4:橙黄色长针状结晶(丙酮中结晶为橙色,甲醇中结晶为黄色),mp 253~257 ℃。10%硫酸-乙醇溶液显粉红色。经与大黄素对照品薄层对照,分别在3个溶剂系统(氯仿-醋酸乙酯、石油醚- 醋酸乙酯、石油醚-丙酮)下Rf值和显色行为均相同,故鉴定化合物4为大黄素。
化合物5:棕红色针状结晶(氯仿),mp 266~267 ℃,10%硫酸-乙醇反应显棕红色,遇碱显紫红色,三氯化铁-铁氰化钾反应呈阳性。1H-NMR (500 MHz,CD3OD) δ: 6.06 (1H,s,H-3),9.01 (1H,s,H-5),3.88 (3H,s,H-6),7.15 (1H,s,H-8),7.67 (1H,d,J = 8.5 Hz,H-9),7.83 (1H,d,J = 8.5 Hz,H-10);13C-NMR (125 MHz,CD3OD) δ: 181.9 (C-1),159.0 (C-2),111.6 (C-3),189.8 (C-4),125.9 (C-4a),126.4 (C-4b),106.8 (C-5),152.8 (C-6),149.7 (C-7),110.6 (C-8),135.6 (C-8a),131.5 (C-9),121.0 (C-10),129.2 (C-10a),56.5 (2-OCH3),56.13 (6-OCH3)。以上数据与文献报道基本一致[14],故鉴定化合物5为7-羟基- 2,6-二甲氧基-1,4-菲醌。
化合物6:白色针状结晶(氯仿),mp 207~208 ℃,Libermann-Burchard反应显墨绿色。经与薯蓣皂苷元对照品薄层对照,在3个溶剂系统(氯仿-甲醇、氯仿-醋酸乙酯、二氯甲烷-甲醇)下Rf值和显色行为均相同,故鉴定化合物6为薯蓣皂苷元。
化合物7:白色片状结晶(含水乙醇),mp 193~195 ℃,Libermann-Burchard反应阳性,Molish反应阴性。1H-NMR (500 MHz,CDCl3) δ: 0.82 (3 H,s,H-18),1.04 (3 H,s,H-19),0.79 (3H,d,J = 6.9 Hz,H-27),0.96 (3 H,d,J = 6.0 Hz,H-21),3.30 (1H,m,H-1),3.45 (1H,m,H-3),5.54 (1H,d,J = 5.0 Hz,H-6);13C-NMR (125 MHz,CDCl3) δ: 78.9 (C-1),44.1 (C-2),68.9 (C-3),43.2 (C-4),140.1 (C-5),125.7 (C-6),33.0 (C-7),31.4 (C-8),52.1 (C-9),42.3 (C-10),23.9 (C-11),41.3 (C-12),41.0 (C-13),57.8 (C-14),32.9 (C-15),82.2 (C-16),63.9 (C-17),16.9 (C-18),13.8 (C-19),42.9 (C-20),14.8 (C-21),110.6 (C-22),29.9 (C-23),24.8 (C-24),32.4 (C-25),67.8 (C-26),17.4 (C-27)。以上数据与文献报道基本一致[15],故鉴定化合物7为鲁可斯皂苷元。
化合物8:黄色粉末(甲醇),mp 276~278 ℃,紫外灯下显示黄色荧光,HCl-Mg粉反应阳性,显淡紫红色,2% FeCl3反应阳性,产生墨绿色沉淀,Molish反应阴性。1H-NMR (500 Hz,CDCl3) δ: 8.10 (2H,dd,J = 2.0,8.0 Hz,H-2′,6′),6.90 (2H,dd,J = 2.0,8.0 Hz,H-3′,5′),6.40 (1H,d,J = 2.0 Hz,H-8),6.19 (1H,d,J = 2.0 Hz,H-6)。13C-NMR (125 MHz,CD3OD) δ: 148.2 (C-2),137.4 (C-3),177.4 (C-4),158.3 (C-5),99.3 (C-6),165.6 (C-7),94.5 (C-8),162.5 (C-9),104.4 (C-10),123.7 (C-1′),130.7 (C-2′,6′),160.5 (C-4′),116.3 (C-3′,5′)。以上数据与文献报道基本一致[16],故鉴定化合物8为山柰酚。
化合物9:无色针状结晶(甲醇),10%硫酸-乙醇反应显紫色,在紫外灯下有蓝绿色荧光。1H-NMR (500 MHz,CDCl3) δ: 5.54 (1H,dd,J = 12.0,3.0 Hz,H-3),3.1 (1H,dd,J = 16.5,12.5 Hz,H-4),3.04 (1H,dd,J = 16.5,3.0 Hz,H-4),6.22 (1H,brs,H-5),6.18 (1H,d,J = 1.5 Hz,H-7),7.44 (2H,d,J = 7.0 Hz,H-2′,6′),7.37 (2H,t,J = 7.0 Hz,H-3′,5′),7.32 (1H,t,J = 7.0 Hz,H-4′);13C-NMR (125 MHz,CDCl3) δ: 171.5 (C-2),81.9 (C-3),36.1 (C-4),107.9 (C-5),165.7 (C-6),102.3 (C-7),166.5 (C-8),101.7 (C-9),143.4 (C-10),140.1 (C-1′),127.3 (C-2′,6′),129.7 (C-3′,4′,5′)。以上数据与文献报道基本一致[17],故鉴定化合物9为 (3S)-6,8-二羟基-3-苯基-3,4-二氢异香豆素。
化合物10:黄色油状物(甲醇),mp 30~34 ℃,硫酸-甲醇显色为黑色,无荧光。TLC在3种溶剂系统展开,10%硫酸-乙醇显色为1个斑点。1H-NMR (500 MHz,CD3OD) δ: 9.52 (1H,s,CHO),7.30 (1H,d,J = 4.0 Hz,H-3),6.58 (1H,d,J = 4.0 Hz,H-4),4.79 (2H,s,H-6);13C-NMR (125 MHz,CD3OD) δ: 179.4 (C-1),153.8 (C-2),124.8 (C-3),111.1 (C-4),163.1 (C-5),57.5 (C-6)。以上数据与文献报道基本一致[18],故鉴定化合物10为5-羟甲基糠醛。
化合物11:白色针状结晶(氯仿),mp 139~142 ℃,10%硫酸-乙醇溶液显紫红色,Libermann- Burchard反应显蓝绿色。经与对照品β-谷甾醇薄层对照,在3个溶剂系统(石油醚-丙酮、环己烷-醋酸乙酯、石油醚-醋酸乙酯)下Rf值和显色行为均相同,故鉴定化合物11为β-谷甾醇。
化合物12:白色粉末(醋酸乙酯),mp 166~168 ℃,易溶于正己烷。10%的硫酸-乙醇溶液显紫色,Libermann-Burchard反应显蓝绿色,表明该化合物为甾体类化合物。经与豆甾醇对照品薄层对照,在3种溶剂系统(石油醚-丙酮、环己烷-醋酸乙酯、石油醚-醋酸乙酯)下Rf值和显色行为均相同,故鉴定化合物12为豆甾醇。
化合物13:白色粉末(石油醚),mp 87~88 ℃,溶于氯仿。10%的硫酸-乙醇溶液显紫色,溴酚蓝反应阳性。经与二十六烷酸对照品薄层对照,在3个溶剂系统(环己烷-醋酸乙酯、石油醚-丙酮、石油醚-醋酸乙酯)下Rf值和显色行为均相同,故鉴定化合物13为二十六烷酸。
| [1] | 中国药典 [S]. 一部. 2015. |
| [2] | Wang G H, Chen H F, Huang M H, et al. Methyl protodioscin induces G2/M cell cycle arrest and apoptosis in HepG2 liver cancer cells [J]. Cancer Lett, 2006, 241(1): 102-109. |
| [3] | Hu K, Yao X. The cytotoxicity of methyl protoneogracillin (NSC-698793) and gracillin (NSC-698787), two steroidal saponins from the rhizomes of Dioscorea collettii var. hypoglauca, against human cancer cells in vitro [J]. Phytother Res, 2003, 17(6): 620-626. |
| [4] | 陈光亮, 吕红霞, 王媛媛, 等. 萆薢牛膝总皂苷对尿酸钠诱导的大鼠急性痛风性关节炎的防治作用 [J]. 中药药理与临床, 2010, 26(1): 34-37. |
| [5] | 李培源, 卢汝梅, 苏 炜, 等. 萆薢总黄酮含量测定及其抗氧化活性研究 [J]. 时珍国医国药, 2015, 26(6): 1303-1304. |
| [6] | Gai M S, Xiao X, Ying Y B, et al. Chemical constituents of Dioscorea collettii var. hyplauca [J]. Chem Nat Compd, 2013, 49(5): 983-984. |
| [7] | Sivanantham B, Sethuraman S, Krishnan U M. Combinatorial effects of curcumin with an anti-neoplastic agent on head and neck squamous cell carcinoma (HNSCC) through the regulation of EGFR-ERK1/2 and apoptotic signaling pathways [J]. ACS Comb Sci, 2016, 18(1): 22-35. |
| [8] | Du Y, Long Q, Zhang L, et al. Curcumin inhibits cancer-associated fibroblast-driven prostate cancer invasion through MAOA/mTOR/HIF-1α signaling [J]. Int J Oncol, 2015, 47(6): 2064-2072. |
| [9] | Patel P B, Thakkar V R, Patel J S. Cellular effect of curcumin and vitral combination on breast cancer cells: induction of apoptosis and cell cycle arrest [J]. J Breast Cancer, 2015, 18(3): 225-234. |
| [10] | Kelloff G J, Crowell J A, Hawk E T, et al. Strategy and planning for ehemopreventive drug development: elinieal developmentplans II [J]. J Cell Biol Chem (Suppl), 1996, 63(26): 54-71. |
| [11] | Moon S S, Cho S C, Lee J Y, et al. Tsaokoarylone, a cytotoxic diarylheptanoid from Amomum tsao-ko fruits [J]. B Kor Chem Soc, 2005, 26(3): 447-450. |
| [12] | Nakayama R, Tamura Y, Yamanaka H, et al. Two curcuminoid pigments from Cukxjma domeszyca [J]. Phytochmistry, 1993, 33(2): 501-502. |
| [13] | Ali M S, Tezuka Y, Awale S, et al. Six new diarylheptanoids from the seeds of Alpinia blepharocalyx [J]. J Nat Prod, 2001, 64(3): 289-293. |
| [14] | Itharat A, Plubrukarn A, Kongsaeree P, et al. Dioscorealides and dioscoreanone, novel cytotoxic naphthofuranoxepins, and 1, 4-phenanthraquinone from Dioscorea membranacea Pierre [J]. Org Lett, 2003, 5(16): 2879-2882. |
| [15] | 刘 伟, 王著禄, 梁华清. 湖北山麦冬化学成分的研究 [J]. 药学学报, 1989, 24(10): 749-754. |
| [16] | 杨 全, 程轩轩, 郭楚楚, 等. 广金钱草种子的化学成分和DPPH自由基清除活性研究 [J]. 中草药, 2015, 46(17): 2517-2521. |
| [17] | Ito C, Mishina Y, Litaudon M, et al. Xanthone and dihydroisocoumarin from Montrouziera sphaeroidea [J]. Phytochemistry, 2000, 53(8): 1043-1046. |
| [18] | 段礼新. 中药复方三子养亲汤及其味药莱菔子物质基础研究 [D]. 沈阳: 沈阳药科大学, 2007. |
 2016, Vol. 47
2016, Vol. 47


