2. 南京中医药大学药学院, 江苏 南京 210023 ;
3. 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023
2. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China ;
3. Jiangsu Provincial Traditional Chinese Medicine High Efficient Drug Delivery System Engineering Technology Research Center, Nanjing 210023, China
人参Panax ginseng C. A. Meyer是我国传统名贵药材,具有大补元气、固脱、生津、安神和益智等作用[1]。研究表明人参皂苷是人参中主要的活性成分,根据化学结构可分为3类:原人参二醇型皂苷、原人参三醇型皂苷及齐墩果酸型皂苷[2]。人参皂苷Rg3为原人参二醇型皂苷,是人参中的稀有皂苷,具有多种药理学活性,如抗肿瘤、抑制血管生成、增强免疫功能、降血糖、抗炎等[3-5]。药动学研究表明人参皂苷Rg3的口服生物利用度较低,其中体内主要可被胃酸及肠道菌群水解为人参皂苷Rh2及原人参二醇,进而吸收入血,发挥其药效作用。研究表明人参皂苷Rg3的抗炎及抗肿瘤作用与其体内生成的人参皂苷Rh2密切相关[3, 6]。
正常情况下,肠道菌群与宿主相互依存、相互制约,维持一种动态的生态平衡,一旦受到内外环境变化的影响,敏感肠道菌就会被抑制,未被抑制的肠道菌就会快速繁殖引起菌群失调,形成破坏生理性、病理性组合的现象[7]。肠道菌群失调逐渐成为肿瘤、糖尿病、肥胖症等疾病的重要临床特征,研究表明肠菌紊乱失调可能引起经肠菌脱糖基代谢进而发挥药理活性的药物疗效发生改变,尤其是糖苷类成分(如人参皂苷)[2, 8-9]。本研究以人参皂苷Rg3作为模型药物,通过比较正常大鼠与肠道菌群失调模型大鼠体内人参皂苷Rg3及其脱糖基代谢产物人参皂苷Rh2的药动学差异,以期为皂苷类成分在菌群失调状态下的药动学研究以及人参皂苷Rg3的临床合理使用提供参考。
1 材料 1.1 药品与试剂人参皂苷Rg3、Rh2对照品(吉林大学有机化学教研室,质量分数>98%,批号201506-2);人参皂苷Rg1对照品(中国食品药品检定研究院,批号110703-201322);盐酸林可霉素(百灵威科技有限公司批号L0166-201408);甲醇、乙腈购自德国Merck公司;醋酸乙酯、正丁醇购自南京化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器Thermo快速液相色谱系统(美国Thermo公司);TSQ三重四极杆质谱仪(赛默飞世尔科技公司);SF-400A型电子天平(梅特勒-托利多仪器有限公司);微量高速冷冻离心机(美国Thermo Scientific公司);SpeedVac离心浓缩仪(美国Thermo Scientific公司);MilH-Q超纯水机(美国Millipore司)。
1.3 动物SD大鼠,12只,体质量200~220 g,雄性,由南通大学动物中心提供,合格证号SCXK-2008-0010。
2 方法 2.1 色谱条件色谱柱为BDS Hypersil C18(50 mm×2.1 mm,2.4 μm);流动相为乙腈-1 mmol/L甲酸铵水溶液(85:15),体积流量为0.30 mL/min;柱温40 ℃,进样量2 μL。
2.2 质谱条件离子源为ESI源;检测方式为负离子检测;电子能量为70 eV;ESI源温度为255 ℃;色谱质谱接口温度为300 ℃。各待测成分及内标检测参数见表 1。
|
|
表 1 人参皂苷Rg3、人参皂苷Rh2和人参皂苷Rg1的质谱检测参数 Table 1 MRM detecting parameters of ginsenosides Rg3, Rh2, and Rg1 |
2.3 对照品溶液与内标溶液的制备 2.3.1 人参皂苷储备液的制备
分别精密称取人参皂苷Rg3和Rh2对照品适量,加入甲醇定容于10 mL量瓶中,经逐步稀释成质量浓度为10.0、9.3 μg/mL的储备液,置于4 ℃避光保存。临用前,用甲醇依次按倍数将储备液稀释至所需浓度,即得。
2.3.2 内标储备液的制备精密称取人参皂苷Rg1对照品适量,加入甲醇溶解,配制成1 mg/mL的内标母液,置于4 ℃避光保存。临用前稀释成10 μg/mL的内标溶液,即得。
2.4 血浆样品处理方法取80 μL血浆样品置于1.5 mL EP管中,加入10 μg/mL人参皂苷Rg1内标溶液10 μL,涡旋30 s,再加入1 mL的醋酸乙酯,涡旋3 min,6 000 r/min离心5 min,取800 μL上清,于45 ℃离心浓缩仪中挥干,进样前加入80 μL流动相复溶,14 000 r/min离心10 min,取上清进样。
2.5 林可霉素诱导的菌群失调大鼠模型的建立及药动学研究将健康雄性SD大鼠随机分为2组,即对照组和菌群失调组,每组6只。菌群失调组大鼠每天ig给予盐酸林可霉素(5 000 mg/kg,溶于生理盐水中),每天1次,对照组每天ig等体积生理盐水,连续造模1周。给药前收集新鲜粪便,用于后续粪便含水量及β-葡萄糖苷酶活性测定。
造模第8天,进行药动学实验,实验前12 h禁食不禁水。对照组及模型组大鼠分别ig人参皂苷Rg3(20 mg/kg),分别于给药前及给药后0.25、0.5、0.75、1、1.5、2、4、6、8、12、24 h眼底静脉丛取血约200 μL,置于肝素化EP管中,3 000 r/min离心10 min,转移80 μL血浆于EP中,−20 ℃保存。临测前,按“2.4”项下方法处理血浆样品,LC-MS/MS测定血浆中人参皂苷Rg3及人参皂苷Rh2的质量浓度。
利用DAS 3.2.6软件对血药浓度数据进行分析,采用非房室模型方法计算统计矩参数,t检验比较组间差异。
2.6 β-葡萄糖苷酶活性测定取0.2 g大鼠新鲜粪便加入3.8 mL冰PBS溶液中充分混悬。4 ℃下200 r/min离心5 min,取上清即为待测菌液。β-葡萄糖苷酶活性测定采用的反应体系为0.4 mL的2 mmol/L对硝基苯基-β-D-吡喃葡萄糖苷,0.4 mL的PBS以及0.2 mL的菌液。在37 ℃条件下水浴,20 min后用1 mL 0.5 mol/L的NaOH中止反应,3 000×g离心10 min,在405 nm下测定产物对硝基苯酚吸光度值。用BCA蛋白浓度测定菌液中的蛋白浓度。酶活力单位(U/mg)定义为在上述条件下每分钟催化生成1 μmol产物对硝基苯酚所需的酶量为1个单位。
3 结果 3.1 方法学考察结果 3.1.1 专属性实验取大鼠空白血浆、大鼠空白血浆加入对照品和内标和正常大鼠口服20 mg/kg人参皂苷Rg3 6 h后的血浆样品,按“2.4”项下血浆样品处理方法处理样品,采用上述建立的LC-MS/MS分析方法检测。结果表明在“2.1”项色谱条件下,血浆中内源性杂质与待测成分人参皂苷Rg3、Rh2及内标人参皂苷Rg1均有较好的分离,内源性杂质不干扰上述待测组分的检测。人参皂苷Rg3、人参皂苷Rh2及内标的保留时间分别为1.81、2.53、1.24 min,结果表明该方法专属性良好,各成分的MRM色谱图见图 1。
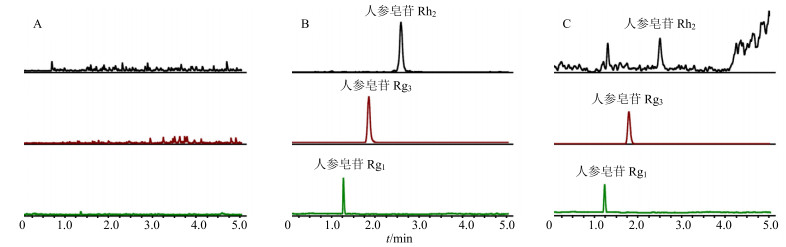
|
图 1 大鼠空白血浆(A)、空白血浆加入内标和混合对照品(B)和ig 20 mg/kg人参皂苷Rg3 6 h后的大鼠血浆样品(C)典型MRM色谱图 Fig.1 Typical MRM chromatograms of blank plasma of rats (A), blank plasma of rats + internal standard + mixed references substances (B), and plasma sample of rats after 6 h in ig administration with ginsenoside Rg320 mg/kg (C) |
3.1.2 标准曲线和定量限
将混合对照品的储备液按倍数稀释成不同质量浓度的混合对照品溶液。将8 μL不同质量浓度的混合对照品溶液加入EP管,挥干溶剂,加入大鼠空白血浆80 μL,振荡30 s,按“2.4”项下血浆样品处理方法处理样品,检测。用检测到的人参皂苷Rg3、Rh2与内标的峰面积之比(Y)与质量浓度(X)进行线性回归。待测化合物的定量限按信噪比S/N=10计算,人参皂苷Rg3的回归方程为Y=0.006 5 X-0.001 2,R2=0.999 4,线性范围为2.0~1 000.0 ng/mL,定量下限为2.00 ng/mL;人参皂苷Rh2回归方程为Y=0.004 9 X-0.000 8,R2=0.992 5,线性范围为1.86~930.0 ng/mL,定量下限为1.86 ng/mL。
3.1.3 精密度考察配制含不同质量浓度人参皂苷Rg3和Rh2的低、中、高3个质量浓度的质控样品,按“2.4”项下血浆样品处理方法处理样品,LC-MS/MS进行检测,结果进行方差分析,考察批内、批间精密度,结果见表 2。
|
|
表 2 人参皂苷Rg3、Rh2在大鼠血浆中批内和批间精密度 Table 2 Intra-batch and inter-batches accuracy of ginsenoside Rg3 and Rh2 in plasma of rats |
3.1.4 提取回收率与基质效应
以空白血浆配制含不同质量浓度人参皂苷Rg3和Rh2的低、中、高3个质量浓度(同表 2中质量浓度)的质控样品,按“2.4”项下血浆样品处理方法处理样品,LC-MS/MS进行检测,以测得人参皂苷Rg3和Rh2的质量浓度与配制质量浓度的比值,计算各人参皂苷低、中、高3个浓度质控样品的提取回收率,结果表明人参皂苷Rg3和Rh2的低、中、高3个浓度质控样品的提取回收率较为稳定,人参皂苷Rg3的提取回收率在62.48%~66.49%,人参皂苷Rh2的提取回收率在77.31%~78.52%。
取80 μL正常空白血浆,按“2.4”处理方法处理血浆样品,加入流动相及对照品,配制成与质控样品质量浓度相对应的样品,LC-MS/MS测得峰面积(A1)。用流动相配制含高、中、低质量浓度的对照品进样并分析得到峰面积(A2)。基质效应为A2/A1,结果表明人参皂苷Rg3的基质效应在91.48%~97.14%,人参皂苷Rh2的基质效应在98.78%~106.21%,均符合生物样品分析的要求。
3.1.5 稳定性考察取80 μL正常大鼠空白血浆加入不同质量浓度的混合对照品溶液配制成高、中、低3个质量浓度的质控样品,质控样品分别在4种条件下进行稳定性考察,包括室温下放置12 h、反复冻融3次、−20 ℃下放置4周、在4 ℃的自动进样器内放置24 h。按“2.4”项下血浆样品处理方法处理,LC-MS/MS进行检测。结果显示(表 3),各待测成分在上述条件下均能保持良好的稳定性。
|
|
表 3 人参皂苷Rg3、Rh2在大鼠血浆中的稳定性 Table 3 Stability of ginsenoside Rg3 and Rh2 in plasma of rats |
3.2 模型的确证
造模期间对照组、模型组大鼠体质量变化见图 2-A,结果表明林可霉素不影响大鼠体质量变化。造模第3天,模型组大鼠粪便含水量较对照组显著增加(P<0.01);造模第5、7天模型组的粪便含水量亦显著增加(P<0.01),结果见图 2-B。提示林可霉素导致明显的菌群失调,大鼠粪便含水量显著增加,动物出现一定程度的腹泻,提示造模成功。
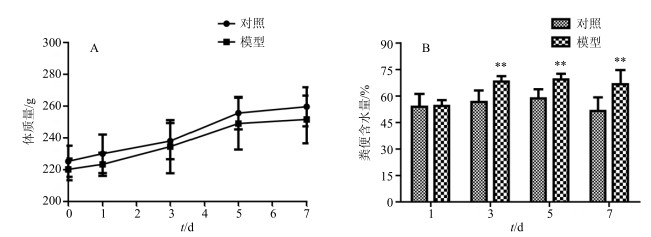
|
与对照组比较:**P<0.01,下图同 **P < 0.01 vs control group, following figures are same 图 2 对照组和模型组大鼠体质量(A)及粪便含水量(B)变化(x±s, n=6) Fig.2 Body weight changes (A) and fecal moisture contents (B) between control and gut microbiota dysbiosis rats (x±s, n=6) |
3.3 药动学实验结果 3.3.1 药-时曲线
对照组与模型组大鼠单剂量ig人参皂苷Rg3(20 mg/kg),检测到的人参皂苷Rg3、Rh2经计算得到的血药浓度-时间曲线见图 3。
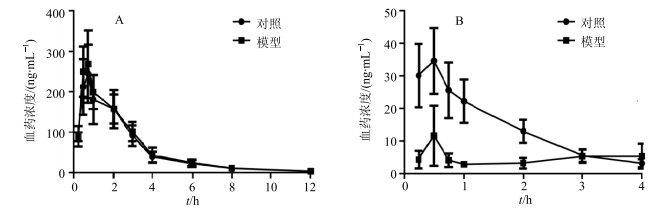
|
图 3 正常大鼠及菌群失调大鼠ig 20 mg/kg人参皂苷Rg3后人参皂苷Rg3(A)和人参皂苷Rh2(B)平均血药浓度-时间曲线(x±s, n=6) Fig.3 Plasma concentration-time curves of ginsenoside Rg3 (A) and ginsenoside Rh2(B) in control and gut microbiota dysbiosis rats following ig administration of ginsenoside Rg320 mg/kg (x±s, n=6) |
3.3.2 药动学参数
利用DAS 3.2.6软件和非房室模型方法对其药动学参数进行计算,釆用t检验统计差异。表 4为人参皂苷Rg3的主要药动学参数。药动学参数结果表明,模型组较对照组,人参皂苷Rg3大鼠体内的峰浓度(Cmax)、药时曲线下面积(AUC0~∞)有所升高,但不具有统计学差异。
|
|
表 4 正常大鼠及菌群失调大鼠ig 20 mg/kg人参皂苷Rg3后人参皂苷Rg3的药动学参数 Table 4 Main pharmacokinetic parameters of ginsenoside Rg3 in control and gut microbiota dysbiosis rats after ig administration of ginsenoside Rg3 20 mg/kg |
人参皂苷Rh2在对照组及模型组大鼠体内的药-时曲线如图 3-B所示,从图中可知,模型组大鼠体内人参皂苷Rh2血药浓度远低于对照组,对照组人参皂苷Rh2的Cmax为(34.59±10.11)ng/mL,模型组人参皂苷Rh2的Cmax为(13.22±7.84)ng/mL。此外模型组大鼠体内人参皂苷Rh2的AUC0~t[(98.57±46.74)h·μg/L]显著小于对照组AUC0~t[(436.83±126.80)h·μg/L]。提示菌群失调大鼠ig给予人参皂苷Rg3后,其活性代谢物人参皂苷Rh2的体内暴露量显著降低。
3.4 β-葡萄糖苷酶活性测定进一步检测对照组及模型组大鼠粪便中β-葡萄糖苷酶活性,图 4结果表明ig给予林可霉素1、3、7 d后,模型组大鼠粪便中β-葡萄糖苷酶活性显著降低。提示林可霉素抑制或杀灭肠道菌群,进而导致β-葡萄糖苷酶活性显著减低。
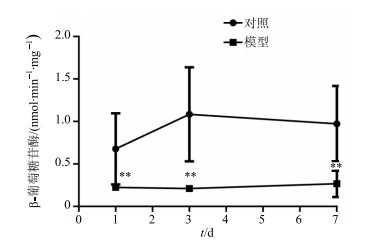
|
图 4 对照组和模型组大鼠粪便中β-葡萄糖苷酶活性比较(x±s, n=6) Fig.4 Fecal β-D-glucosidase activity in normal rats and model rats (x±s, n=6) |
4 讨论
肠道菌群失调是指机体受到饮食、药物、精神压力等因素的影响下,肠菌在种类、数量、比例、定位和生物特性上发生较大的变化。对于口服吸收药物,尤其是皂苷及黄酮苷类药物,菌群失调会影响药物在体内代谢处置,改变其药动学特性,进而影响其效应的发挥[8]。本实验选取人参稀有皂苷Rg3为模型药物,系统研究其在菌群失调大鼠体内的药动学。
本实验建立了同时测定生物样品中人参皂苷Rg3及其代谢产物人参皂苷Rh2的LC-MS/MS分析方法,经方法学考察,人参皂苷Rg3及人参皂苷Rh2在一定质量浓度范围内线性关系良好,精密度与准确度实验结果表明该法符合生物样品分析的要求,此外该法的稳定性、基质效应均符合要求,可用于人参皂苷Rg3及其脱糖基代谢产物人参皂苷Rh2在大鼠体内的药动学研究。
本实验用易导致肠道菌群失调的药物林可霉素ig给予1周,诱导菌群失调大鼠模型。给予林可霉素后,可见大鼠体表毛色粗糙,但对体质量未见影响。通过测定大鼠粪便含水量,可见模型组大鼠粪便含水量显著增加,此外部分动物出现较为严重的腹泻,提示菌群失调大鼠模型造模成功[10]。进一步测定大鼠粪便中β-葡萄糖苷酶活性,大鼠粪便中β-葡萄糖苷酶活性与对照组相比显著降低。提示ig林可霉素后,大鼠肠道菌群遭到严重破坏,而β-葡萄糖苷酶在介导人参皂苷Rg3的脱糖基代谢中发挥重要作用。通过药动学研究结果提示,血浆中人参皂苷Rg3的Cmax、AUC0~∞值都有所升高,但无显著性差异;对照组大鼠血浆中代谢产物人参皂苷Rh2的血药浓度显著高于模型组大鼠,此外对照组大鼠血浆中人参皂苷Rh2 AUC0~t显著高于模型组大鼠。提示人参皂苷Rg3的体内脱糖基代谢在菌群失调组大鼠被显著抑制,这与大鼠粪便中β-葡萄糖苷酶活性测定结果吻合。
由上述结果可知,在林可霉素诱导的菌群失调大鼠体内,大鼠粪便中β-葡萄糖苷酶活性降低,进而影响人参皂苷Rg3在肠道菌群中的脱糖基代谢,改变人参皂苷Rg3及其脱糖基代谢产物人参皂苷Rh2吸收入血后的药动学行为。
| [1] | Kang A, Hao H, Zheng X, et al. Peripheral anti-inflammatory effects explain the ginsenosides paradox between poor brain distribution and anti-depression efficacy[J]. J Neuroinflammation , 2011, 8 :100. DOI:10.1186/1742-2094-8-100 |
| [2] | Kang A, Zhang S J, Shan J J, et al. Gut microbiota-mediated deglycosylation of ginsenoside Rb-1 in rats:in vitro and in vivo insights from quantitative ultra-performance liquid chromatography-mass spectrometry analysis[J]. Anal Methods , 2015, 7 (15) :6173–6181. DOI:10.1039/C5AY01098E |
| [3] | Aziz F, Wang X, Liu J, et al. Ginsenoside Rg3 induces FUT4-mediated apoptosis in H. pylori CagA-treated gastric cancer cells by regulating SP1 and HSF1 expressions[J]. Toxicol In Vitro , 2016, 31 :158–166. DOI:10.1016/j.tiv.2015.09.025 |
| [4] | 赵琛, 苏光悦, 赵余庆. 人参皂苷及其衍生物抗结肠癌作用及机制的研究进展[J]. 中草药 , 2015, 46 (16) :2477–2483. |
| [5] | 吴胜斌, 王应灯. 人参皂苷Rg3对H2O2诱导人肾小球系膜细胞氧化应激损伤的保护作用及其机制研究[J]. 现代药物与临床 , 2015, 30 (12) :1437–1442. |
| [6] | 康安, 钱静, 单进军, 等. 人参总皂苷主要成分大鼠体内药动学研究[J]. 中草药 , 2015, 46 (20) :3045–3050. |
| [7] | Sharon G, Garg N, Debelius J, et al. Specialized metabolites from the microbiome in health and disease[J]. Cell Metab , 2014, 20 (5) :719–730. DOI:10.1016/j.cmet.2014.10.016 |
| [8] | Ruan J Q, Li S, Li Y P, et al. The presystemic interplay between gut microbiota and orally administered calycosin-7-O-β-D-glucoside[J]. Drug Metab Dispos , 2015, 43 (10) :1601–1611. DOI:10.1124/dmd.115.065094 |
| [9] | Jang S E, Jung I H, Joh E H, et al. Antibiotics attenuate anti-scratching behavioral effect of ginsenoside Re in mice[J]. J Ethnopharmacol , 2012, 142 (1) :105–112. DOI:10.1016/j.jep.2012.04.022 |
| [10] | 康安, 张圣洁, 单进军. 人参皂苷Rb1在林可霉素诱导的菌群失调大鼠体内的药代动力学研究[J]. 中国药科大学学报 , 2016, 47 (2) :182–187. |
 2016, Vol. 47
2016, Vol. 47


