锁阳Cynomorii Herba是锁阳科(Cynomoriaceae)锁阳属Cynomorium L. 植物锁阳Cynomorium songaricum Rupr. 的干燥肉质茎,多寄生于蒺藜科白刺属Nitraria L. 植物根部[1]。全株红棕色,无叶绿素,生长于干燥多沙地带,在新疆、甘肃、青海、内蒙古等地均有分布。《中国药典》2015年版记载,锁阳具有补阳气、益精血、润肠通便等功效。维吾尔药名为“也尔买地克”,系维吾尔医习用药材。此外,锁阳作为一种传统滋补类药材,民间将其作为长寿食品[2-3]。锁阳富含多种化学成分,现代药理研究表明,锁阳总糖具有抗氧化、提高免疫力、抗糖尿病、延缓衰老和抗疲劳的作用[4-6]。
回流法或热浸法是提取总糖的传统方法[7-8],但存在提取时间长、提取温度高、提取率低的问题。并且,长时间高温提取可能会造成糖类降解,导致其药理活性降低[9]。酶解法凭借提取条件温和、耗能低、效率高、操作简单等优点被广泛用于植物活性成分的提取,至今尚未有关于酶解法提取锁阳总糖的报道。采用纤维素酶和果胶酶复合酶复合提取锁阳总糖,旨在探索一种高效的锁阳总糖提取工艺。本研究在单因素考察的基础上,以锁阳总糖得率为指标,采用2次旋转正交设计法对影响提取主要因素进行优化,此外,采用响应面法进一步分析,为科学、合理地开发锁阳总糖资源提供理论基础。
1 仪器与材料AR1140电子天平,上海奥豪斯仪器有限公司;HI221pH测定仪,意大利哈纳HANNA公司;DJ-10A粉碎机,上海隆拓仪器设备有限公司;电热恒温水浴锅,北京永光明医疗仪器有限公司;TDL-5台式大容量离心机,上海安亭科学仪器厂;TP300超声波提取器,北京天鹏电子新技术有限公司;UV-2600紫外可见分光光度计,日本岛津公司;DHG-9240电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司。
锁阳药材,新疆麦迪森维药有限公司,经石河子大学药学院成玉怀高级实验师鉴定为锁阳科锁阳属植物锁阳Cynomorium songaricum Rupr.,于干燥阴凉处避光保存。果胶酶、纤维素酶,Solarbio公司;葡萄糖、无水乙醇、80%浓硫酸、蒽酮、磷酸二氢钾、氢氧化钠均为分析纯。
2 方法与结果 2.1 锁阳总糖提取锁阳饮片干燥后粉碎,过80目筛,以80%乙醇-锁阳粉末(4∶1)的比例浸泡24 h,离心,弃去有机溶剂,干燥,制备脱脂粗粉保存备用。
称取预处理后的样品5.0 g,浸泡在50 mL、pH值4.5~6.5溶液中,加入一定量(质量分数以锁阳粉末计)的复合酶(果胶酶、纤维素酶),在适宜温度下提取若干时间,离心取上清液并定容至50 mL,作为供试品溶液。测定结束后,用无水乙醇醇析,使最终乙醇体积分数达到80%,4 ℃静置过夜。离心收集沉淀,所得沉淀分别用95%乙醇、丙酮、无水乙醇多次洗涤后,干燥至恒定质量。所有实验重复3次。
2.2 锁阳总糖得率测定 2.2.1 对照品溶液的制备精密称量105 ℃干燥至恒定质量葡萄糖对照品100.00 mg,去离子水溶解,定容至100 mL,配制成1.00 mg/mL葡萄糖对照品溶液。
2.2.2 线性关系考察采用蒽酮-硫酸法。精密量取葡萄糖对照品溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL,分别定容至50 mL,再各取2 mL置于10 mL带塞试管中,加入6 mL 0.1%蒽酮-浓硫酸溶液,混合均匀,置于沸水浴15 min,室温放置15 min,使其恢复常温,于625 nm处测定吸光度(A)值[10]。以葡萄糖质量浓度(C)为横坐标,A值为纵坐标进行线性回归,得回归方程A=42.304 C+0.042 7,r=0.999 0,结果表明葡萄糖在4~24 mg/L线性关系良好。
2.2.3 锁阳总糖得率的测定精密量取供试品溶液1.0 mL,用去离子水稀释1 000倍,精密量取2.0 mL,按“2.2.2”项方法测定A值,计算锁阳总糖量及锁阳总糖得率。
锁阳总糖得率=提取总糖的质量/锁阳粉末的质量
2.3 单因素考察为考察复合酶解法各因素对总糖得率的影响,通过文献调研[11-14],对酶解比例(酶解比例为果胶酶与纤维素酶比例)、酶用量、酶解温度、酶解时间及溶液初始pH值共5个因素进行单因素试验。其他条件固定,精密称取5.0 g预处理样品,加入50 mL去离子水(料液比1∶10),酶用量1%,初始溶液pH值为5.5。实验因素在实际操作过程中可适当更改。
2.3.1 酶解比例对总糖得率的影响植物细胞壁是由纤维素组成的刚性骨架嵌入到由半纤维素和糖蛋白凝胶状果胶化合物组成[15],因此某些酶可以通过破坏细胞壁水解结构性总糖和脂质体提高内容物的溶出[16]。分别考察酶解比例为1∶3、2∶3、1∶1、3∶2、3∶1对总糖得率的影响,结果总糖得率分别为(10.32±0.14)%、(12.87±0.43)%、(17.11±0.37)%、(10.98±0.20)%、(10.27±0.46)%。当果胶酶-纤维素酶(1∶1)时,总糖得率达到最大值17.11%,这是由于当2种酶协同作用于植物细胞壁时,细胞内容物充分溶出,总糖提取效果最好。据相关文献报道[17],果胶酶与纤维素酶比例过大或过小均不能使细胞壁充分破坏。
2.3.2 酶用量对总糖得率的影响分别考察酶用量为0.5%、1.0%、2.0%、3.0%对总糖得率的影响,结果总糖得率分别为(12.98±0.14)%、(15.76±0.18)%、(15.99±0.11)%、(16.30±0.11)%。当底物量(锁阳质量)一定时,复合酶用量0.5%~3.0%时,总糖得率先升高后趋于平缓。当酶用量达到1.0%时,总糖得率达到15.76%;当酶用量超过1.0%后,总糖得率却没有显著性变化,初步确定最佳酶用量为1.0%。
2.3.3 酶解温度对总糖得率的影响随着温度的增加,提取溶剂中总糖的扩散系数增大,溶解性增强,总糖得率增加,但高温也会导致酶的活性降低[18-19]。分别考察酶解温度为40、45、50、55、60 ℃对总糖得率的影响,结果总糖得率分别为(15.78±0.29)%、(15.53±0.19)%、(16.29±0.17)%、 (17.46±0.16)%、(16.32±0.13)%。当温度高于45 ℃后,随着温度的升高,锁阳总糖得率显著增加。温度达到55 ℃时总糖得率达到17.46%,进一步升温,总糖得率反而降低。
2.3.4 酶解时间对总糖得率的影响分别考察酶解时间为35、45、55、65、75 min对总糖得率的影响,结果总糖得率分别为(11.56±0.22)%、(16.62±0.38)%、(15.98±0.41)%、(15.32±0.24)%、 (15.20±0.33)%。随着酶解时间的增加总糖得率逐渐增加,酶解时间45 min时总糖得率达到16.62%。当酶解时间超过45 min后,酶解基本完全,随时间的延长,总糖得率反而下降,这是因为长时间的酶解使溶出的总糖结构遭到破坏,总糖得率反而下降。
2.3.5 溶液初始pH值对总糖得率的影响分别考察溶液pH值为4.5、5.0、5.5、6.0、6.5对总糖得率的影响,结果总糖得率分别为(14.98±0.09)%、(15.06±0.33)%、(17.83±0.23)%、(14.87±0.07)%、(13.39±0.16)%。当溶液初始pH<5.5时,随着pH值的增大总糖得率增大,提取溶液初始pH>5.5时,总糖得率呈下降趋势。当提取溶液初始pH=5.5时,总糖得率达到最高值。由于酶对pH值比较敏感,pH值的变化可以改变酶空间构象而引起酶活性的降低,进而引起锁阳总糖得率的降低。当pH<5时,酸性条件加热破坏糖的结构,pH值为7时无意义,初步确定最佳的溶液初始pH值为5.5。
2.4 提取工艺的参数优化 2.4.1 2次旋转正交试验及数据分析通过单因素试验确定提取参数的初步范围,选择影响锁阳总糖提取的3个主要因素:酶解比例(X1)、酶解温度(X2)和酶解时间(X3),采用3因素5水平2次旋转组合实验[20-21],以锁阳总糖得率(Y)为考察指标,进行锁阳总糖提取条件优化。根据3因素的上下限值(X1j,X2j),计算各影响因素的零水平X0j和变化区间∆j,并根据公式:X0j=(X1j+X0j)/2,∆j=(X1j+X0j)/γ(γ=$\sqrt{3}$),编制因素水平编码表。按照3因素2次旋转组合设计要求,得到23组锁阳总糖提取实验,其中15~23号是0水平9次重复实验,实验结果见表 1。
|
|
表 1 2次回归旋转组合设计及实验结果 (n = 3) Table 1 Design and experimental results of quadratic orthogonal rotation regression combination design (n = 3) |
2.4.2 统计分析与模型拟合
复合酶法提取锁阳总糖的2次旋转正交优化的结果如表 1所示。对表中实验数据进行多元回归拟合,获得Y对自变量X1、X2、X3(编码值)的2次多项回归模拟方程:Y= 17.305 70-0.142 78 X1-0.371 37 X2-0.175 60 X3-0.378 29 X12-0.519 71 X22 -0.562 14 X32+0.213 75 X1X2-0.143 75 X1X3+0.088 75 X2X3。
通过F检验和P值检验可知,回归模型具有统计学意义(表 2)。通过F值可知F1=1.201 52<F0.05(5,8)=3.69,说明回归方程失拟不显著,拟合较好,可认为所选用的2次回归模型是适当的,模型并未受到其他因子的影响;回归显著性检验F2=5.047 27>F0.01(9,13)=4.19,回归是显著的,说明回归方程拟合良好,模型的预测值准确度可达95%。对回归系数显著性检验,在α=0.10显著水平剔除不显著项后,简化后的回归方程Y′=17.305 70-0.371 37 X2-0.378 29 X12-0.519 71 X22-0.562 14 X32。由表 2可知,通过比较X1、X2、X3的F值可以得出各个因素对总糖得率影响的大小顺序依次为X2>X3>X1。
|
|
表 2 方差分析表 Table 2 Variation analysis |
2.4.3 主要因素分析
用降维法[22]将任意2个因素固定在0水平,得到另1个因素与得率的效应方程分别为X1:Y1=17.305 70-0.142 78 X1-0.378 29 X12;X2:Y2=17.305 70-0.371 37 X2-0.519 71 X22;X3:Y3=17.305 70-0.175 60 X3-0.562 14 X32;由方程X1、X2、X3分别作图,由图 1可知在−γ≤X≤γ的范围内,各因素对Y的影响均呈先增大后减少的趋势,其中X2的变化趋势最为明显,说明X2对Y的影响最大。
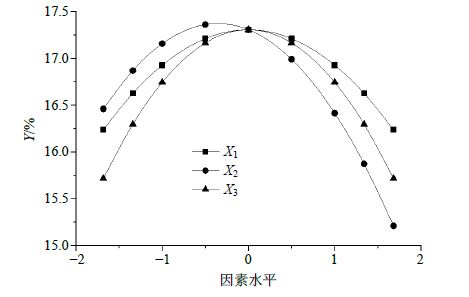
|
图 1 单因素效应分析 Fig.1 Effect analysis of single factor |
2.4.4 交互效应分析
在回归方程Y中,X1X2项与X2X3项为“+”,说明X1与X2、X2与X3均存在协同效应;而X1X3项为“-”,说明X1与X3存在拮抗作用。将1个因素固定为0水平,可得到两两互作效应方程(α=0.10显著水平剔除不显著项后,简化后的回归方程)分别为Y12=17.305 70-0.371 37 X2-0.378 29 X12-0.519 71 X22;Y13=17.305 70-0.378 29 X12-0.562 14 X32;Y23=17.305 70-0.371 37 X2-0.519 71 X22-0.562 14。
根据Design-Expert V8.0软件响应面分析法,以Y为响应值,分别绘制方程Y12、Y13、Y23的响应面及其等高线。由图 2可知,Y均先缓慢增至最高点后下降,变化趋势平缓,X1和X2的交互作用对Y的影响最显著;X3和X1、X2和X3两两交互作用变化趋势均不明显。

|
图 2 X1、X2和X3对Y的响应面 (A) 及其等高线 (B) Fig.2 Response surface (A) and contour plot (B) for X1,X2,and X3 to Y |
2.4.5 预测模型验证
采用DPS数据处理系统对实验数据进行分析,通过计算机模拟寻优得出总糖提取的优化组合为X1在0水平(1∶1),X2在0水平(55 ℃),X3在0水平(45 min),在此条件下Y为17.31%,通过实际实验得出最佳Y为17.54%,与理论值(17.31%)基本匹配,说明此模型稳定、可行。
3 讨论本实验对复合酶解法提取锁阳总糖进行研究,得出锁阳总糖的优化提取工艺:酶用量1%,酶解初始pH 5.5,酶解比例1∶1,酶解温度55 ℃,酶解时间45 min,在此优化条件下锁阳总糖得率为(17.54±0.35)%。相较于传统的热浸提取法与回流提取法[23],复合酶解法降低能耗、缩短提取时间、提取条件较为温和、对锁阳总糖结构破坏小、生物酶选择性强、实验操作简单。优化后的复合酶解法提取工艺可以作为一种新的辅助方法,对提高锁阳总糖的提取率有很大意义。
本实验通过2次旋转正交组合设计以及DPS系统处理,较以往的设计方法借助非线性数学模拟拟合,提供了由模型探索最佳工艺的策略,并通过增加中心点的重复实验,减小实验误差,提供了更加科学、全面、精确的实验结果[24]。通过对实验数据进行多元回归拟合,建立总糖得率与酶解温度,酶解时间,酶解比例的关系,得出各主要因素对总糖得率影响大小顺序:酶解温度>酶解时间>酶解比例,通过响应面分析两两因素互作效应,得出酶解比例和酶解温度的交互作用对总糖得率的影响最为显著。本实验为锁阳总糖提取工艺的确定提供了量化资料,并且为其他天然产物中总糖的提取奠定了理论基础。
| [1] | 中国中医药管理局. 中华本草(5)[M]. 上海: 上海科学技术出版社, 1999 . |
| [2] | Meng H C, Wang S, Li Y. Chemical constituents and pharmacologic actions of Cynomorium plants[J]. Chin J Nat Med , 2013, 11 (4) :321–329. |
| [3] | Cui Z H, Guo Z Q, Miao J H, et al. The genus Cynomorium in China:An ethnopharmacological and phytochemical review[J]. J Ethnopharmacol , 2013, 147 (1) :1–15. DOI:10.1016/j.jep.2013.01.020 |
| [4] | 聂莉莎, 马丽, 杰爱民. 锁阳药性及功能的现代研究进展[J]. 中国民族民间医药 , 2009, 18 (16) :17–19. |
| [5] | 王晓梅, 张倩, 热娜·卡斯木, 等. 锁阳全草化学成分的研究[J]. 中草药 , 2011, 42 (3) :458–460. |
| [6] | 焦扬, 李彩霞, 倪丽芳, 等. 锁阳多糖抗氧化性研究[J]. 食品科技 , 2007, 32 (11) :113–115. |
| [7] | 熊正英, 马晓莲, 孙岩, 等. 锁阳多糖对运动训练大鼠睾酮含量、物质代谢与运动能力的影响[J]. 陕西师范大学学报:自然科学版 , 2011, 39 (8) :103–108. |
| [8] | 汪荔, 王征, 张娇, 等. 传统工艺与膜分离技术联合对马齿苋多糖的提取分离与抗氧化活性研究[J]. 中草药 , 2016, 47 (10) :1676–1681. |
| [9] | Hromádková Z, Ebringerová A, Valachovič P. Ultrasound-assisted extraction of water-soluble total sugars from the roots of valerian (Valeriana officinalis L.)[J]. Ultrason Sonochem , 2002, 9 (1) :37–42. DOI:10.1016/S1350-4177(01)00093-1 |
| [10] | 位杰, 吴翠云, 蒋媛, 等. 蒽酮法测定红枣可溶性糖含量条件的优化[J]. 食品科学 , 2014, 35 (24) :136–140. |
| [11] | 李亚辉, 马艳弘, 黄开红, 等. 响应面法优化复合酶提取芦荟总糖工艺及其抗氧化活性分析[J]. 食品科学 , 2014, 35 (18) :63–68. |
| [12] | 魏俊青, 刘晓娟, 肖春玲. 酶解法提取紫玉米总糖技术的研究[J]. 食品工业科技 , 2012, 33 (23) :188–191. |
| [13] | 李洪燕, 罗浩, 刘结容, 等. 酶解法提取罗汉果总糖的工艺研究[J]. 食品安全质量检测学报 , 2015, 6 (2) :689–694. |
| [14] | 刘莉, 彭冉, 刘强. 酶解法提取稻秆总糖的工艺研究[J]. 时珍国医国药 , 2011, 22 (10) :2437–2438. |
| [15] | Fu Y J, Liu W, Zu Y G, et al. Enzyme assisted extraction of luteolin and apigenin from pigeonpea[Cajanuscajan (L.) Millsp.] leaves[J]. Food Chem , 2008, 111 (2) :508–512. DOI:10.1016/j.foodchem.2008.04.003 |
| [16] | Azmir J, Zaidul I S M, Rahman M M, et al. Techniques for extraction of bioactive compounds from plant materials:A review[J]. J Food Eng , 2013, 117 (4) :426–436. DOI:10.1016/j.jfoodeng.2013.01.014 |
| [17] | Cheng Z Y, Song H Y, Yang Y J, et al. Optimization of microwave-assisted enzymatic extraction of polysaccharides from the fruit of Schisandra chinensis Baill[J]. Int J Biol Macromol , 2015, 76 :161–168. DOI:10.1016/j.ijbiomac.2015.01.048 |
| [18] | Li W, Cui S W, Kakuda Y. Extraction, fractionation, structural and physical characterization of wheat β-D-glucans[J]. Carbohyd Polym , 2006, 63 (3) :408–416. DOI:10.1016/j.carbpol.2005.09.025 |
| [19] | Braga M E M, Moreschi S R M, Meireles M A A. Effects of supercritical fluid extraction on Curcuma longa L. and Zingiber officinale R. Starches[J]. Carbohydr Polym , 2006, 63 (3) :340–346. DOI:10.1016/j.carbpol.2005.08.055 |
| [20] | 李停, 贾永义, 刘士力, 等. 二次正交旋转组合设计优化人工诱导翘嘴鲌雌核发育[J]. 中国水产科学 , 2016, 23 (1) :77–89. |
| [21] | 郑礼胜, 倪娜, 刘向前. 二次通用旋转试验设计优化栀子苷的酶解工艺[J]. 中草药 , 2012, 43 (7) :1340–1343. |
| [22] | 张凯, 李刚. 基于改进降维法的可靠度分析[J]. 计算力学学报 , 2011, 28 (2) :187–192. |
| [23] | 张伟刚, 郑娜娜, 芮洋, 等. 宁夏野生锁阳多糖的提取工艺及体外抗氧化活性研究[J]. 食品工业科技 , 2014, 35 (24) :279–284. |
| [24] | 邹小艳, 魏立新, 杜玉枝, 等. 星点设计-效应面法优化川西樟牙菜提取工艺[J]. 中草药 , 2008, 39 (5) :693–696. |
 2016, Vol. 47
2016, Vol. 47


