2. 军事口腔医学国家重点实验室, 口腔疾病国家临床医学研究中心, 陕西省口腔生物工程技术研究中心, 第四军医大学口腔医院 药剂科, 陕西 西安 710032
2. State Key Laboratory of Military Stomatology & National Clinical Research Center for Oral Diseases & Shaanxi Engineering Research Center fou Dental Materials and Advanced Manufacture, Department of Pharmacy, Hospital of Stomatology, The Fourth Military Medical University, Xi'an 710032, China
姜黄素(curcumin,Cur)是中药姜黄Curcuma longa L.的主要活性成分,其具有广泛的药理作用[1-2]。研究表明姜黄素具有抗肿瘤、抗炎、保护肝脏、抗菌等药理作用[3-4],且毒副作用小,应用前景广阔[5]。但Cur稳定性差、溶解度低、血浆半衰期短、血药浓度低、口服不易吸收、生物利用度低,影响了Cur的临床应用[6]。
纳米脂质载体(nanostructured lipid carriers,NLC)是采用具有良好生物相容性的高熔点固体脂质材料,加入一定比例的液体脂质材料形成混合类脂质,将整个脂质作为载体,药物包载于脂质内核中或吸附于纳米粒表面而形成的新型胶体给药系统。其可以提高药物的水溶性、稳定性及生物利用度[7]。磷脂酰丝氨酸(phosphatidylserine,PS)属于一种生物内源性的膜材,大量存在于凋亡细胞的外膜,能高效识别巨噬细胞上的受体而实现巨噬细胞特异性靶向[8]。因此本实验采用PS对纳米粒进行修饰后,包载药物Cur,制备PS修饰的Cur纳米脂质载体(Cur-mNLC),旨在提高Cur的水溶性和稳定性,同时借助PS介导的巨噬细胞靶向作用增加药物在巨噬细胞的聚集。本实验对Cur纳米脂质载体(Cur-NLC)、Cur-mNLC及游离的Cur溶液ip给药后在大鼠体内的药动学特征进行比较,为Cur新剂型的开发提供参考。
1 材料 1.1 仪器BT125D十万分之一电子天平(Sartorius公司);SENCO®R系列旋转蒸发仪(上海申生科技有限公司);SHB-3循环水多用真空泵(郑州杜甫仪器厂);YJ96-Ⅱ超声细胞粉碎机(宁波新芝生物科技股份有限公司);UV/VIS Lambda35(珀金埃尔默责任有限公司);激光粒度分析仪(Mastersizer 2000,英国马尔文公司);G560E涡旋混合器(Scientific Industries);Agilent 1290 Infinity超高效液相色谱-6460型三重四级杆串联质谱仪(美国Agilent Technology公司),配有电喷雾离子源(ESI)及MassHunter(VersionB.04.10)工作软件。
1.2 试剂与药品Cur对照品(质量分数98.9%,批号110823-201405,中国食品药品检定研究院);Cur原料药(质量分数98%,批号201406,上海阿拉丁生化科技股份有限公司);大黄素对照品(内标物[9],质量分数98.7%,批号110756-201512,中国食品药品检定研究院);大豆磷脂S100(质量分数97%,上海Lipoid公司);PS(质量分数>70%,上海将来实业股份有限公司);三油酸甘油酯(上海梯希爱化成工业发展有限公司);胆固醇(质量分数99%,日本精细化工);胆固醇油酸酯(质量分数97%,Alfa Aesar公司)。甲醇和乙腈均为一级色谱纯(Fisher公司);水为二次纯化水(自制)。
1.3 动物18只雄性SD大鼠,体质量(180±20)g,购自第四军医大学实验动物中心,合格证号SCXK(军)2012-0007。
2 方法与结果 2.1 Cur-NLC和Cur-mNLC的制备精密称取处方量的大豆磷脂S100、PS、三油酸甘油酯、胆固醇、胆固醇油酸酯和Cur,混合后,加10 mL氯仿超声溶解,旋转蒸发挥去有机溶剂,得到干燥的脂质薄膜。在30℃下用pH 6.5磷酸盐缓冲液对脂质薄膜进行水化30 min,将脂质混悬液超声处理10 min,再进行探头超声(300 W,6 min)。最后采用0.22 μm的有机滤膜进行滤过,即得到Cur-mNLC。Cur-NLC制备方法同上,但处方中不含PS。
2.2 Cur-NLC和Cur-mNLC粒径、包封率及载药量的测定 2.2.1 纳米粒的粒径和多分散指数(PDI)的测定将Cur-NLC和Cur-mNLC样品用蒸馏水稀释适当的倍数后,用Nano-ZS90激光粒度分析仪动态光散射法测定脂质载体的粒径和PDI。结果见表 1。
|
|
表 1 Cur-NLC和Cur-mNLC的粒径、PDI、包封率及载药量(x±s, n=3) Table 1 Diameter, PDI, encapsulation efficiency, and drug loading capacity of Cur-NLC and Cur-mNLC (x±s, n=3) |
2.2.2 包封率和载药量的测定
制备葡聚糖凝胶微柱,取一次性5 mL注射器,弃去活塞,将定性滤纸填入管底防胶漏,将去离子水充分溶胀过夜的Sephadex G-50葡聚糖凝胶小心装入注射器内,1 000 r/min离心10 s,除去多余的水分,备用[10]。
取Cur-NLC或Cur-mNLC样品0.5 mL滴加到制备的微柱中心,1 000 r/min离心2 min,以后每次补充0.5 mL蒸馏水洗脱2 min,收集带有乳光的部分于100 mL量瓶中,加无水乙醇破乳定容,摇匀,过0.22 μm有机滤膜,测定吸光度(A)值,计算包封在NLC中的药物质量(m),称取的药物量为m1,计算Cur-NLC或Cur-mNLC的包封率(m/m1)和载药量[m/(m1+m2),m2为载体材料的质量]。结果见表 1。
2.3 血浆中Cur分析方法的建立 2.3.1 色谱条件色谱柱为Wonda Cract ODS-2(150 mm×4.6 mm,5 μm);流动相为乙腈-水(90:10);柱温25℃;体积流量0.3 mL/min;进样量5 μL。色谱图见图 1。
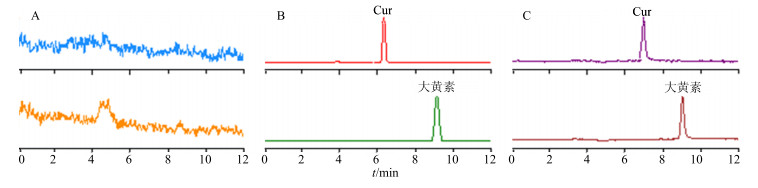
|
图 1 空白血浆(A)、空白血浆+姜黄素对照品溶液+内标液(B)、血浆样品+内标液(C)的色谱图 Fig.1 UPLC-MS/MS chromatograms of blank plasma (A), blank plasma with curcumin and internal standard (B), and drug plasma with internal standard (C) |
2.3.2 质谱条件
离子源为电喷雾电离源(ESI);扫描方式为多反应监测(MRM);离子模式为负离子;喷雾电压344.75 kPa(50 psi);毛细管电压:负离子3.5 kV;干燥气温度350℃;干燥气体积流量6 L/min;鞘气温度350℃;鞘气体积流量11 L/min;碎裂电压110 V(Cur),137 V(大黄素);碰撞能量0 eV(Cur)和29 eV(大黄素);扫描时间12 min;定量离子对m/z 367.0→217.0(Cur)、269.0→225.1(大黄素),质谱图见图 2。
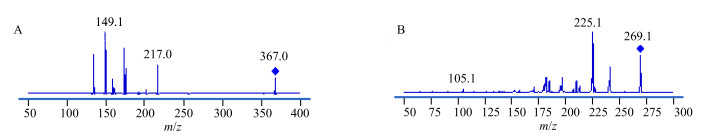
|
图 2 姜黄素(A)和大黄素(B)质谱图 Fig.2 Mass spectrum of Cur (A) and emodin (B) |
2.3.3 对照品溶液的制备
精密取Cur对照品10.46 mg,置于100 mL量瓶中,以甲醇溶解,配制成104.60 μg/mL的Cur对照品储备液,分别取适量Cur对照品储备液,以甲醇稀释,配制质量浓度为0.001、0.005、0.010、0.052、0.104、0.523、1.046、5.230 μg/mL的系列对照品溶液。
2.3.4 内标液的制备精密取大黄素对照品10.40 mg,置于100 mL量瓶中,以甲醇溶解,精密取上述大黄素溶液0.1 mL,置于100 mL量瓶中,以甲醇溶解,得0.104 μg/mL的内标溶液,冰箱保存备用。
2.3.5 血浆样品处理精密取大鼠血浆200 μL加入内标大黄素溶液200 μL(0.104 μg/mL)涡旋30 s,混合均匀后,精密加入色谱甲醇400 μL,涡旋1 min,13 000 r/min低温高速离心10 min,分离上清液于1.5 mL离心管中,氮气吹干,精密取甲醇200 μL复溶,涡旋3 min,13 000 r/min离心,取上清液5 μL进样分析。
2.3.6 质量控制样品的配制精密吸取系列Cur对照品溶液和内标液各200 μL,再精密加入空白血浆于离心管中,涡旋30 s,混合均匀后,按“2.3.5”项下方法操作,配制Cur质量浓度分别为0.523、0.052、0.005 μg/mL的高、中、低3个不同质量浓度的质量控制样品。
2.3.7 方法专属性考察空白血浆、空白血浆+Cur对照品溶液+内标液、血浆样品+内标液的色谱图见图 1。可见Cur的保留时间为6.99 min,大黄素的保留时间为9.01 min,Cur和内标大黄素分离效果良好,血浆中内源性物质对Cur和大黄素的出峰时间无干扰。
2.3.8 标准曲线的制备精密吸取大鼠空白血浆200 μL于离心管中,精密加入Cur系列对照品溶液和内标液各200 μL,涡旋,溶解后,按“2.3.5”项下方法操作,配制成Cur质量浓度分别为0.001、0.005、0.010、0.052、0.104、0.523、1.046、5.230 μg/mL的溶液9份,按照“2.3.1”项下色谱条件和“2.3.2”项下质谱条件注入UPLC-MS/MS进行分析测定,记录色谱峰面积。以Cur的质量浓度为横坐标(X),以Cur响应值和大黄素的响应值之比为纵坐标(Y),进行线性回归,得回归方程为Y=11.990 X-0.417 1(r=0.998 6)。根据回归方程,Cur质量浓度在0.001~5.230 μg/mL线性关系良好。
2.3.9 提取回收率取高、中、低质量浓度(0.523、0.052、0.005 μg/mL)的质量控制样品各3份,每份样品进样分析3次,记录色谱峰面积(A1)。同时精密取空白血浆200 μL,加入400 μL甲醇沉淀蛋白,分离上清液,再精密加入Cur对照品溶液和大黄素内标溶液各200 μL,按“2.3.5”项下操作,配制成质量浓度为0.523、0.052、0.005 μg/mL的未经提取处理的样品各3份,每份样品进样分析3次,记录色谱峰面积(A2)。以A1与A2的比值考察此方法的提取回收率。结果表明,高、中、低3个质量浓度的平均提取回收率为99.42%,RSD为4.95%(n=9),符合要求。
2.3.10 精密度和准确度取高、中、低质量浓度的质控样品各3份,于同1 d不同时间段连续测定3次,计算日内精密度,结果表明高、中、低质量浓度的日内精密度RSD分别为3.09%、3.17%、3.48%。高、中、低质量浓度的日间精密度(每天测定1次,连续测定3 d)RSD分别为4.47%、4.19%、4.45%(n=3),符合生物分析方法指导原则要求[11]。高、中、低质量浓度质控样品的准确度分别为(99.20±0.64)%、(100.84±1.01)%、(98.60±0.94)%,均符合要求。
2.3.11 稳定性考察取高、中、低质量浓度的质量控制样品各3份,第1份质量控制样品按照“2.3.5”项下操作,注入UPLC-MS/MS进样分析,记录色谱峰面积;第2份质量控制样品室温放置12 h后同前操作,考察样品在室温条件下的稳定性;第3份质量控制样品于−20℃下保存24 h,反复冻融3次后同前操作,记录样品在冻融条件下的稳定性。高、中、低质量浓度质量控制样品峰面积的RSD分别为3.28%、4.95%、5.00%,表明样品在室温放置12 h,以及于−20℃下保存24 h,反复冻融3次后稳定性良好。
2.3.12 基质效应取高、中、低质量浓度的质量控制样品各3份,注入UPLC-MS/MS进样分析,记录色谱峰面积。以此色谱峰面积和相同质量浓度Cur对照品的色谱峰面积之比为基质效应,RSD为4.18%(n=9),符合要求。
2.4 Cur-mNLC在大鼠体内的药动学研究 2.4.1 动物分组及给药取清洁级SD大鼠18只,适应性喂养3 d,自由饮食。给药前12 h禁食不禁水,随机分成3组,每组6只,分别ip给予Cur-NLC、Cur-mNLC及Cur溶液。各药物均以20%聚山梨酯80溶解,质量浓度为2 mg/mL,给药剂量按Cur计均为10 mg/kg。各组分别于给药后5、10、30 min及1、2、4、8、12、24、36、48、72 h大鼠眼眶取血1 mL于1.5 mL离心管中,4 000 r/min离心,制备得大鼠血浆待测。
2.4.2 药动学数据分析以给药后各时间点Cur的血药浓度和时间绘制血药浓度-时间曲线(图 3)。主要药动学参数用药代动力学分析软件(DAS 2.1.1)进行处理,非房室动力学模型进行统计距分析,数据以x±s表示,药动学参数见表 2。
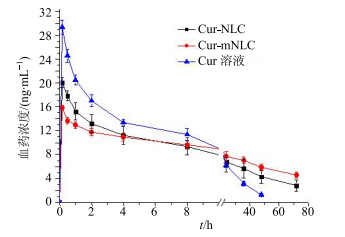
|
图 3 Cur-mNLC、Cur-NLC、Cur溶液ip给药后大鼠体内Cur血药浓度-时间曲线(x±s, n=6) Fig.3 Blood concentration-time profiles of curcumin in rats after ip administration of Cur-mNLC, Cur-NLC, and Cur-solution at 10 mg/kg (x±s, n=6) |
|
|
表 2 Cur-mNLC、Cur-NLC、Cur溶液ip给药后在大鼠体内的主要药动学参数(x±s, n=6) Table 2 Pharmacokinetic parameters of Cur-mNLC, Cur-NLC, and Cur-solution after ip administration at 10 mg/kg (x±s, n=6) |
由图 3和表 2可见,与Cur溶液组相比,Cur-NLC和Cur-mNLC组大鼠血浆药物达峰浓度(Cmax)较低,差异均显著(P<0.01),而Cur-mNLC组更低,与Cur-NLC组相比,差异显著(P<0.01);但Cur-NLC和Cur-mNLC组的药物在体循环中的平均滞留时间(MRT)更长(P<0.05),而Cur-mNLC组MRT0~∞比Cur-NLC组更长(P<0.05),表明在腹腔液中Cur纳米制剂尤其是Cur-mNLC中药物清除比游离药物组更慢。分析原因可能是由于纳米制剂尤其是Cur-mNLC进入腹腔后大部分被腹腔内富含巨噬细胞的组织如肝脏、脾脏等吞噬,而后才会从组织中缓慢释放部分游离药物进入体循环;在腹腔液中只有一小部分药物会从纳米制剂中释放后直接穿过腹膜或通过淋巴管排出后进入体循环,导致其在血浆中的质量浓度较低,体内滞留时间延长。而Cur溶液组中的药物则可以较快地进入体循环,很快达到Cmax,并较快地从体内清除。此外还可以看出,将Cur制备成Cur-mNLC后,其AUC0~∞为(933.014±106.766)h∙μg/L,相较于Cur溶液的AUC0~∞[(632.026±145.224)h∙μg/L]和Cur-NLC的AUC0~∞[(362.193±17.574)h∙μg/L]分别提高了2.58倍(P<0.05)和1.48倍(P<0.05),说明Cur-mNLC,相较于普通纳米制剂和游离药物溶液能明显提高Cur的生物利用度。
3 讨论本实验建立的UPLC-MS/MS法测定大鼠血浆中Cur的质量浓度,具有灵敏度高、专属性好、操作简便、快速等特点。
含药纳米粒ip给药后,药物在机体的处置由多个动力学过程组成:包括药物从纳米粒中释放,纳米粒在腹腔内组织中的聚集(有利于药物递送至靶器官),药物从腹腔吸收进入血液循环以及通过肝脏代谢进行消除等多个步骤。文献报道[12]纳米粒从腹腔中的清除主要通过淋巴管排出,且取决于其粒径大小。粒径较小的纳米粒(<50 nm)可穿过淋巴结,粒径较大的纳米粒(>700 nm)会被截留在淋巴结中,而粒径介于50~700 nm的粒子主要停留在腹腔中,游离药物则可透过腹腔膜或穿过淋巴管吸收入血。在腹腔中纳米脂质载体中的药物释放速率比较缓慢,而一旦药物从载体中释放出来则会快速地进入体循环[13]。虽然载体中的药物在腹腔中释放缓慢,但与游离药物相比,其在体内的滞留时间延长,清除率下降[10],有利于提高药物的生物利用度。
针对于稳定性差、溶解度低、血浆半衰期短、血药浓度低、口服不易吸收、生物利用度低等问题对Cur进行结构修饰或者改变剂型是目前研究的热点之一[14-16]。本实验根据药动学结果初步分析可能是由于Cur-mNLC组中的载体大部分被肝、脾等富含巨噬细胞的腹腔内组织摄取,导致其血药浓度较低,后期将进行组织分布研究进一步探讨Cur-mNLC在体内的代谢过程,为开发Cur新剂型药物提供依据。
| [1] | 李高文, 徐英, 库宝善, 等. 姜黄素的中枢药理作用研究进展[J]. 神经药理学报 , 2011, 1 (2) :48–57. |
| [2] | 罗廷顺, 刘洪文, 刘正文, 等. 姜黄素的提取分离与药理作用研究进展[J]. 现代药物与临床 , 2011, 26 (2) :102–107. |
| [3] | 张梦翔, 施高翔, 严园园, 等. 姜黄素对5种非白念珠菌菌丝及生物膜形成的抑制作用[J]. 中草药 , 2015, 46 (4) :549–553. |
| [4] | Zhang D, Luo J Y, Yan D, et al. Effects of Two Curcuminoids on Candida albicans[J]. Chin Herb Med , 2012, 4 (3) :205–212. |
| [5] | Zhu H T, Bian C, Yuan J C, et al. Curcumin attenuates acute inflammatory injury by inhibiting the TLR4/MyD88/NF-κB signaling pathway in experimental traumatic brain injury[J]. J Neuroinflammation , 2014, 11 (1) :1–17. DOI:10.1186/1742-2094-11-1 |
| [6] | Lao C D, Ruffin M T, Normolle D, et al. Dose escalation of a curcuminoid formulation[J]. BMC Complement Altern Med , 2006, 6 (4) :10–17. |
| [7] | 方敏.姜黄素纳米结构脂质载体的制备及其靶向性研究[D].武汉:华中科技大学, 2013. |
| [8] | Khatik R, Dwivedi P, Khare P, et al. Development of targeted 1, 2-diacyl-sn-glycero-3-phospho-l-serine-coated gelatin nanoparticles loaded with amphotericin B for improved in vitro and in vivo effect in leishmaniasis[J]. Exp Opin Drug Deliv , 2014, 11 (5) :633–646. DOI:10.1517/17425247.2014.889678 |
| [9] | Li J. A rapid and simple HPLC method for the determination of curcumin in rat plasma: assay development, validation and application to a pharmacokinetic study of curcumin liposome[J]. Biomed Chromatogr , 2009, 23 (11) :1201–1207. DOI:10.1002/bmc.v23:11 |
| [10] | 王济.不同脂肪酸修饰的洛伐他汀仿生高密度脂蛋白载药系统的研究[D].南京:中国药科大学, 2013. |
| [11] | 张立康, 汪小珍, 李婉姝, 等. 姜黄素在大鼠体内药代动力学和生物利用度研究[J]. 中国药理学通报 , 2011, 27 (10) :1458–1462. |
| [12] | Sigfridsson K, Lundqvist A, Strimfors M. Evaluation of exposure properties after injection of nanosuspensions and microsuspenions into the intraperitoneal space in rats drug[J]. Devel Ind Pharm , 2013, 39 (11) :1832–1839. DOI:10.3109/03639045.2012.738684 |
| [13] | Fu Q, Hargrove D, Lu X L. Improving paclitaxel pharmacokinetics by using tumor-specific 2 mesoporous silica nanoparticles with intraperitoneal delivery[J]. Nanomedicine , 2016, 12 (7) :1951–1959. |
| [14] | 张峰, 陈敬清, 岑娟, 等. 具有高水解稳定性的姜黄素类似物的抗多药耐药肿瘤作用研究[J]. 中草药 , 2014, 45 (12) :1736–1742. |
| [15] | 邢潇琳, 范春雷, 丛晓东, 等. 姜黄素葡甲胺共晶的大鼠肠吸收特征研究[J]. 中草药 , 2015, 46 (11) :1645–1648. |
| [16] | 李纳, 汤丹丹, 王丽雯, 等. 喷雾干燥法制备姜黄素磷脂复合物壳聚糖微球干粉吸入剂及其表征[J]. 中草药 , 2014, 45 (17) :2475–2481. |
 2016, Vol. 47
2016, Vol. 47


