药用植物组织培养(medicinal plants tissue culture)是指在无菌条件下,将离体的药用植物器官(根、茎、叶、花、果、茎尖等)、组织(形成层、表皮、皮层、髓部细胞、胚乳等)、细胞(大孢子、小孢子及体细胞)以及原生质体,培养在人工培养基上和人工控制的环境中,使其生长、分化、增殖,甚至形成完整植株的过程和技术。组织培养不仅经济高效、技术含量高、有利于自动化,还具有周期短、生长快速的特点。因此,组织培养技术不仅广泛应用于农业和园艺,还在药用植物方面备受重视,对珍稀濒危药用植物资源保护、离体快繁、药用植物可持续发展及有效次生代谢产物规模化生产起到至关重要的作用[1]。
目前,外植体污染、玻璃化、褐化现象已经成为制约药用植物组织培养发展的重要因素,并称药用植物组织培养三大瓶颈。其中,褐化问题涉及方面复杂,受外植体、基质微环境、外源物添加等内部和外部多种因素影响。药用植物从外植体处理阶段到初始诱导和继代培养阶段均可能受到环境胁迫、酚酶氧化和醌类毒害的影响发生褐化,进而阻碍药用植物的生长分化乃至死亡,降低组织培养研究成功机率。近些年,随着中药需求量日益增加,药用植物资源紧缺,特别是野生珍稀濒危药用植物。若继续放任褐化现象发展,不仅降低实验成功率,造成资源浪费,还不能满足生物技术为工业化生产和保护生物多样性的初衷。因此,深入研究褐化机制、分析致褐因素、提出有效抑褐对策是保证组培培养成功的关键,满足了人们对药用植物安全、有效性的期待。本文参考近年来药用植物褐化相关文献,综述褐化机制、影响因素及防褐措施,以期为褐化的深入研究提供科学参考。
1 药用植物组织培养中的褐化现象目前,药用植物组织培养主要在2方面应用广泛:一是利用试管苗微繁技术大量生产种苗,以满足人工栽培需求,解决野生药用资源紧缺的困难;二是利用组培技术培养植物组织、细胞,直接从中获取次级代谢产物或从生物反应生产有效成分[2, 3]。
然而,在组织培养过程中褐化现象成为阻碍愈伤组织诱导和植株再生的一大难题。目前,药用植物组织培养中褐化现象在木本和草本植物中均有报道,如库拉索芦荟[4]、朝鲜蓟[5]、芍药[6]、红豆杉[7]、锁阳[8]、斛蕨[9]等。
杨爽等[10]在手掌参组织培养中发现,手掌参芽部离体培养褐化率高达93.33%,严重阻碍其生长和分化。郭治友等[11]在甜叶悬钩子褐化控制实验中发现,空白培养基中外植体1 d内就呈现褐化特征,1周内全部炭化死亡。因此,是否能及时阻滞和有效控制褐化现象成为了药用植物组培技术成功的关键。
2 药用植物组织培养中外植体褐化类型及其机制 2.1 酶促褐化酶促褐化(enzymatic browning)是在有氧条件下,酚酶催化酚类物质形成醌及其聚合物的反应过程。药用植物组织中含有的酚类物质作为细胞呼吸传递物存在于完整植物体的细胞中,并且酚类物质与多酚氧化酶存在区域不同,一直并长期处于酚-醌系统的动态平衡,因此正常发育中的药用植物无褐化特征[12]。但药用植物组织培养是在离体状态下进行,势必会对植物产生创伤刺激并形成伤口,使细胞结构遭到破坏,酚类物质与多酚氧化酶在氧气条件下氧化成褐色物质醌和水,从而显现褐化特征[13, 14]。换言之,当细胞完整性被破坏后,酚-醌未能保持动态平衡,同时具备了酶、底物和氧气3个条件,发生酶促褐化现象,其反应式如图 1所示。
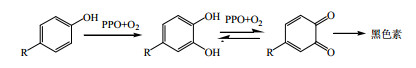 | 图 1 酶促褐化反应式 Fig.1 Enzymatic browning reaction |
酚类物质是植物中普遍存在的一类次生代谢产物,同时也是主要的酶促褐化底物。据文献报道,酚类物质主要分为黄酮类、酚酸类、鞣质类(如棓单宁和原花色素苷)[15]。酚类物质主要有两种合成途径:一种是通常在高等植物中发生的苯丙氨酸脱氨基反应;另一种则是莽草酸途径生成查尔酮等一系列后续反应[16]。
药用植物组织培养涉及的酶促褐变相关酶主要为多酚氧化酶(PPO)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)。酶促褐化条件必须同时满足才可发生酶促褐化现象,理论上讲可以认为干预任一条件来实现控制褐化的目的。笔者认为可以通过明确药用植物酶促褐变底物的活性范围,从褐变机制角度采取相应抑褐措施,如阻滞相关酶的产生、捕捉并去除氧气存在、削弱中间生成物的积累、干预酶与底物结合等[17]。郑超等[18]相关分析结果表明,愈伤褐化程度与PPO和POD活性呈负相关。郝英超[19]通过考察提取pH、提取时间、料液比等不同影响因子对金银花中PPO活性变化的实验,确定了PPO活性最适条件范围,建立了金银花酶促褐化模型并研究其褐化机制。此外,褐变基因表达方面也是目前新颖的褐变研究方向。Xu等[20]对植物外植体褐变进行了全基因组的分析表达,结果显示褐变外植体中PPO、POD、PAL活性明显增强,研究中还发现了许多新的致褐相关基因,为今后进一步破译外植体褐变基因提供了方法学参考。
2.2 非酶促褐化酚类等物质在非酶促条件下被氧化而发生显著颜色变化、趋向加深的现象为非酶促褐化(nonenzymatic browning),其主要是受到环境胁迫所致[21],主要表现为美拉德(Maillard)反应、焦糖化作用、抗坏血酸褐变等[13, 22]。
美拉德反应包括3个阶段,从羰基缩合与分子重排开始后进入果糖胺(重排后)进一步降解的中间过程,最后羟醛缩合与聚合形成褐色素[23]。焦糖化作用是糖类在不含氨基化合物时经高温作用形成糖的脱水产物及裂解产物;抗坏血酸氧化形成脱氢抗坏血酸,再水合形成2,3-二酮古洛糖酸,脱水脱羧形成糠醛后再形成褐色素[24]。
3 药用植物褐化现象的影响因素 3.1 外植体本身的影响 3.1.1 外植体龄、取材时间及取材部位药用植物外植体龄及取材时间不同,外植体发生褐化的机率和程度不尽相同。王鹏等[25]研究表明,红金银花未木质化茎段褐化率较低,为组培最佳外植体。邵龙珠等[26]认为成龄材料褐化程度显著于幼龄材料,外植体龄越大褐化率越高。邓添等[27]每月中旬取臭马比木茎段以研究外植体褐化情况差异,结果表明3~4月取材褐化死亡率最小。张桂芳等[28]研究表明1~3月为佛手最佳抑褐取材时间。这可能是由于夏季气温相对较高,已经萌发的植物含有较多褐化底物,因而褐化概率明显增大。
外植体取材部位不同意味着在位置效应影响下的植物发育及生理状态有所差异,内源激素表达差异性就决定了褐化程度必然不同。袁丽红等[29]选择藏红花无菌芽、花芽幼叶、球茎为外植体,30 d后发现球茎愈伤诱导时间比前两者晚9 d左右,但褐化率却明显低于无菌芽和幼叶。
3.1.2 外植体处理方式药用植物组织培养过程中抗褐化固然重要,但防褐化也不容轻视,对药用植物培养材料进行预处理及处理方式的研究,将会提高组培快繁技术的成功率,成为褐化防治路上的“顺风车”。雷颖[30]对野生松潘乌头块根进行预处理(MS+1.0 mg/L 6-BA+200 mg/L PVP+300 mg/L VC),每24 小时转移1次,经3次转移后,使外植体褐化率较空白处理组降低了90%。秦宇[31]在红豆杉组培研究中发现,未切割叶的茎段诱导的愈伤体积大且蓬松,切除叶的茎段底部易出现褐化现象。笔者认为切割方式不同可能导致植物细胞获得破坏后的敏感拮抗反应程度的不同,植物细胞壁、细胞膜不能维持完整性时的代谢变化,成为异养方式,生成毒害细胞的醌类物质。
3.2 外在因素对药用植物褐化的影响 3.2.1 灭菌剂及作用时间自发展药用植物组织培养以来,无论是科研还是实际生产中都致力于突破组织培养中污染、玻璃化、褐化这三大问题。多数灭菌剂不仅可以对植物材料污染问题起到正面效果,还对褐化现象起到一定的抑制作用,常见灭菌剂类型见表 1。
| 表 1 常见灭菌剂类型和作用效果 Table 1 Types and effects of common sterilizing agents |
Morteza等[33]研究提出,无菌水清洗外植体1 h,以1% NaClO和吐温20表面灭菌7 min后,无菌水清洗3次(每次5 min)是最佳无籽伏牛花抑褐处理方法。Yan等[35]研究表明,2 min乙醇(200 ml/L)处理是有效抑制褐化和微生物生长的方法。杨爽等[10]在手掌参组培中发现不同类型的灭菌剂褐化率不同,0.1%氯化汞抑褐效果强于5%次氯酸钠,并且同种灭菌剂随灭菌时间的延长褐化率升高,腋芽萌动率降低。
3.2.2 培养基pH、种类及其状态药用植物组织培养褐化现象受培养基pH因素影响。王培忠等[36]研究结果显示,一定范围内pH值与褐化率呈负相关,pH值越趋于中性褐化程度越轻。
不同种类的培养基无机盐量不同,MS培养基较1/2 MS培养基无机盐量高,酚类物质易形成醌类物聚集[37]。庾韦花等[38]在牛尾菜外植体褐化控制研究中得到结论,WPM培养基因含较低无机盐而更适于牛尾菜组织培养,出现褐化特征比MS培养基推迟了4 d。
多酚类物质氧化后形成的醌类物质在液体基质中能及时分散出去,不会聚集在外植体附近形成毒害作用,利于褐化的防治。据文献报道,愈伤组织褐化率随琼脂浓度增加而加大,抗褐化效果最好的是以珍珠岩为支撑物的液体培养基,其次为半固体培养基,固体培养基褐化率和致死率最高[39, 40]。
3.2.3 培养条件组培实验中,除了要控制温度,光照条件和光质对组培实验效果也有很大影响。任巍威[41]研究表明,苦参在低温或27 ℃以上条件下极易发生褐化,最适抑褐温度为24~26 ℃。Andrea等[42]建议组培过程中使用红、蓝光光质。王小娟[43]研究不同光照条件对鱼腥草愈伤组织褐化的影响,结果显示不同光照时间对组织褐化存在差异影响,培养初期暗培养有助于减轻褐化。
当愈伤组织形成后,植物次生代谢产物积累到一定量时,为防止营养缺失和醌类物质积累出现褐化,还需要在一定时间内将培养物转入新鲜介质中或在更换培养基时及时切除已经褐化的组织[29]。换言之,继代周期的选择也会在一定程度上影响褐化率的高低,但是继代周期过短不仅不利于组织的分化与脱分化,还会增加污染率[10]。赵庆芳等[44]对蒙古黄芪进行连续暗培养天数、光培养时间、继代时间等因素的正交试验,结果显示10 d后继代既能保持愈伤组织正常生长又能减轻褐化。
3.3 添加外源物对药用植物组织培养褐化的影响 3.3.1 植物激素目前公认的植物激素有五大类,即生长素类、细胞分裂素类、赤霉素类、乙烯和脱落酸,具有内生性、可运输性、调节性三大特点。适宜的细胞分裂素与生长素比例,对抑制褐化有明显作用[45]。邱晓芳等[46]以B5为杜仲组培基础培养基,研究6-苄基腺嘌呤(6-BA)、萘乙酸(NAA)对愈伤组织继代培养的影响,结果发现随着NAA浓度增加,褐化率升高,呈现与6-BA相反的效果,实验证明浓度为1.0 mg/L时,6-BA抑褐效果好,愈伤组织增长平稳,与贾星远[47]研究结果一致。Lazarus等[48]认为添加6-BA只能降低9周之内的褐化情况,不作用于后期愈伤组织培养,添加2,4-D对褐化也无明显改善效果。
3.3.2 抗褐化剂药用植物组织培养常用的抗褐化剂主要通过吸附作用和抗氧作用发挥作用。吸附剂主要为活性炭(AC)和聚乙烯吡咯烷酮(PVP);抑制多酚氧化作用的试剂主要为维生素C(VC)、核黄素(VB2)、硝酸银(AgNO3)等[4, 49]。
AC单独使用可在一定程度上减轻褐化[50]。雒晓芳[21]研究发现当归愈伤组织增殖阶段使用0.1 mg/L AC能有效控制褐化。池源[51]研究证明单独使用AC可在出芽率保持在70.8%的基础上降低褐化率至25%,PVP也可减轻褐化程度,但效果不及AC。然而,韦柳成[52]通过实验证明,1 g/L PVP可以将褐化率降至0,与池源结论不一致,这可能是由植物基因型差异造成的。笔者在实践中倾向于使用PVP,因为若AC用量过大,培养基加热灭菌时pH值会变小,且PVP是具有专一性的吸附剂,可专一吸附组培过程中所释放的醌类物质,而AC不仅会吸附有害物质,还可能会无选择性吸附植物生长分化所需的营养物质。
VC为酸性己糖衍生物,是稀醇式己糖酸内酯,添加VC于培养基时要特别注意培养基pH值的波动。Wang等[53]研究得出VC质量浓度为0.2 g/L时,青钱柳组织培养物褐化程度最轻。鲁光耀等[54]在白及组培快繁中发现,使用植物生长调节剂时加入15 mg/L VC愈伤组织无褐化现象。
Sija等[55]在MS基础培养基和木本植物培养基中加入3 g/L AC、75 mg/L VC及2.5 g/L PVP诱导子叶愈伤组织,结果发现几种抗褐化剂联合使用更有助于降低褐化度。Nahid等[56]对光叶仙茅的研究结果显示,使用抗坏血酸、柠檬酸、PVP、多菌灵和0.1%氯霉素浸泡9 h能够显著降低茎尖外植体褐变。
半胱氨酸是一种生物体内常见的氨基酸,可由体内的蛋氨酸转化而来,可与胱氨酸互相转化。遇硝普盐(nitroprusside)呈紫色,存在于许多蛋白质和谷胱甘肽中,与Ag+、Hg+、Cu+等金属离子可形成不溶性硫醇盐(mercaptide)。Amodio等[57]报道了添加0.5%半胱氨酸是最佳抑制洋蓟褐变的方法。Pratibha等[58]提出在培养基中分别减少谷胱甘肽、抗坏血酸、生育酚和半胱氨酸的组合处理可以解决组织褐化和坏死的问题。
此外,也有研究表明生物素、硅酸钠、水杨酸、核黄素、柠檬酸、植酸、没食子酸丙酯等在保持增殖系数的同时,也有推迟褐化和降低褐化率的作用[1, 59, 60]。但是无论使用哪种方法或多种方法结合以达到防治褐化的目的,都应该有一定的科学范围并存在部分局限性,超过最适范围往往会伴随负效应的发生[61, 62]。
4 控制药用植物组织培养褐化的有效措施 4.1 选择适宜的外植体和培养条件不同基因型的药用植物,有不同基因表现型,加之褐变过程是一个复杂的基因网络,故在实践中要做好筛选工作,尽量避开褐化极其严重的品种。长势粗壮的外植体生命力旺盛,分化和脱分化性能强,褐化机率相对较低,因此是组培技术的首选[63]。不同的位置生理效应表达不同,李蒙飞[64]研究结果显示,手参茎尖为褐化率最低的理想外植体;陈贝贝等[65]研究证明黄精叶钩吻叶片褐化最严重,其次是花柄,茎褐化程度最轻。
在预防褐化过程中,可对培养条件适当控制,外植体黑暗、低温预处理有明显降低褐化的效果,韩晓磊[66]采用青葙外植体冷藏2 d后,接入含有0.01 g/L VC和1 g/L PVP的培养基中以达到抑制褐化的目的。一般来说,在初始培养的1~6周内,黑暗培养或低光强下培养可以降低PPO活性,抑制酚类物质氧化[67]。也有学者认为短时间热激处理能使酶失活,抑制褐化发生[68]。
4.2 调控组织培养基质理想的组培基质环境,可以通过碳源、琼脂浓度、无机盐及微量元素量及pH来设置,良好的环境条件有助于抗褐化。通常来说,琼脂浓度越低越有助于醌类物质的分散;降低无机盐及增加微量元素的量与褐化率呈正比;多酚氧化酶的活性于pH值6.0~6.5时最大,随pH值的降低呈减弱趋势[69]。
Agnieszka等[70]研究植物杂交种的褐化,以期优化愈伤组织诱导和再生植株的培养基组分。研究结果表明,愈伤组织在以蔗糖为碳源的培养基中褐化严重,在添加香蕉果肉和蜂蜜的培养基中褐化明显减少且愈伤组织状态良好。在药用植物组织培养中,常常会添加一些对组培效果有益却不明机制的物质,如椰子汁、蜂王浆、果浆等[71]。以蜂蜜代替蔗糖达到抗褐化效果,可能是由于蜂蜜中某些特定有机化合物含有抗氧化特性,抑制了酚类物的酶促褐化反应。
4.3 加入抗氧化物质药用植物组织培养中的褐化问题主要是因为产生过多的酚类物质所致,过量的酚类化合物抑制愈伤组织生长和增殖,但是一定浓度的酚类物质也是植株再生所必须的。在培养基中加入少量抗氧化剂,如抗坏血酸、牛血清蛋白、硫代硫酸钠、AC、PVP、吗啉乙烷磺酸(MES)[72, 73]等,或者在含抗氧化剂的培养基中进行预培养,既可以促进愈伤组织再生又可以起到削弱醌类物质毒害的效果,笔者认为这也许是通过控制酚类物质的量来实现的。据文献报道,0.05%~0.5% VC和柠檬酸混合是抑制多酚氧化的有效措施[69]。
Andrew等[74]旨在通过抑制PAL活性来探讨一种新的预防褐化的方法,在青蒿组织培养基质中加入了一种竞争性PAL抑制剂氨基茚磷酸(AIP)。结果显示,培养基中加入AIP不仅能够显著减少组织褐变和总酚的量,还能减少组织提取物吸光度,并且在减少褐变的同时还伴随细胞分裂素的大幅增加,是一种有效的抑制褐化新方法。另外,实验显微观察结果阐释了酚类物质释放到培养基质中的原理,即酚类物质多在褐化组织离散的细胞中积累,这些细胞高度质壁分离且易破裂。
酚氧化酶的关键性金属离子是铜,利用螯合剂,如EDTA螯合铜离子对抑制褐化也有帮助,同时螯合剂也可能是抗氧化剂,用于抑制酚氧化酶活性和降低氧化速率,从而减轻培养物褐化程度[14, 75, 76]。
4.4 气体熏蒸Sun等[77]探讨了H2S熏蒸法对抑制鲜切藕片酶促褐化的影响。研究测定评估了褐变程度、褐变颜色、总酚量、过氧化物阴离子产生率、H2O2量、抗氧化能力、酚代谢相关酶(PAL、CAT、POD、PPO)。结果显示,以15 μL/L H2S熏蒸能显著地抑制酶促褐化,增强抗氧化能力,过氧化物阴离子产生率和H2O2量明显减少。研究证明H2S熏蒸法可以通过增强抗氧化能力降低细胞氧化损伤,以达到抑制褐化的效果。
Zhang等[78]探讨CO熏蒸对植物酚类代谢的影响,测定结果显示PPO和POD的活性受抑,PAL活性增强,证明CO可能抑制了酶促褐变发生。另外,Roksana等[79]通过测定酶活性还提出了NO的抑褐可能机制。
4.5 其他措施对易褐化的药用植物组织培养,可以适时更换新鲜培养基,去除积累的醌类物质;剪切外植体时保证愈伤诱导率的同时,要尽量保持伤口最小,这样才能保证酚类物质以最低量流出,减轻褐化程度;植物激素虽然用量少,但对植物生长及抗褐化都有着不容忽视的作用。另外,据有关文献报道,NaCl是一种无毒、有效的物美价廉的防褐剂,不仅有助于细胞增长,还可抑制酚酶活性[80]。
5 结语与展望综上所述,若能阻断药用植物组织培养褐变发生中的任一环节,就能阻碍褐化的发生。实践中主要从阻断氧流入和控制氧化酶入手,如采用热处理法和添加抑制剂以降低酚酶活力;调节pH值和水分活度借以改变酚酶作用条件;抗氧化剂的使用及隔绝培养材料与氧气的接触等。
药用植物组织培养技术自发展以来,结合生物学、遗传学、植物化学、药理学、生理学,获得了颇多的生态及经济效益,但在实践过程中的褐化现象的出现,始终是组织培养最难以克服的问题。随着现代科技的发展,不断从组织组成、超微结构学、染色体片段等方面深入研究褐化机制,从而为其应用于实际生产中提供参考。然而,研究多集中于相关致褐化因素影响下酶促褐化底物及酶活性的变化趋势,在相关致褐基因的表达、遗传基因水平上解释褐变机制的并不多,因此深入研究药用植物褐化基因网络是必要且刻不容缓的。另一方面,开发成本低、操作简易的生物技术也是大势所趋,不仅节省人力、物力、财力,也将为褐化的有效控制提供新的视角。同时,培养方式的优化也对实际操作中抑制褐化提供了一种可能。例如,以CO2替代基质中的糖作为植物生长的碳源,使其能在人工光照下吸收CO2自养生长,因而在一定程度上避免了微生物的污染,有效地解决了培养中褐化、生根率及移栽成活率低的问题。
| [1] | 邬秀宏, 李中林, 陈正明, 等. 茶树组织培养中外植体褐化控制的研究[J]. 西南农业学报, 2012, 25(3): 1065-1068. |
| [2] | 薛 淮, 刘 敏, 张纯花. 中国药用植物组织培养研究进展[J]. 植物杂志, 2002(1): 6-7. |
| [3] | 张家菁, 于元杰. 伞形科药用植物组织培养的研究进展[J]. 特产研究, 2011, 33(1): 63-66. |
| [4] | 代建丽, 宋婵婵, 徐 晨, 等. 库拉索芦荟组织培养褐化现象的抑制研究[J]. 安徽农学通报, 2013, 19(6): 23-24. |
| [5] | Angela Q, Giovanni M, Miriana D, et al. Isolation of a polyphenol oxidase (PPO) cDNA from artichoke and expression analysis in wounded artichoke heads[J]. Plant Physiol Biochem, 2013, 68(7): 52-60. |
| [6] | 曲文静. 芍药组织培养及褐化研究 [D]. 北京: 北京林业大学, 2014. |
| [7] | 袁云香, 朱丽君, 王建鹏, 等. 南方红豆杉愈伤组织诱导及褐化防治研究[J]. 北方园艺, 2014, 38(19): 90-92. |
| [8] | 段园园. 脱落酸和茉莉酸甲酯对锁阳茎切口愈合及褐变的调控 [D]. 呼和浩特: 内蒙古大学, 2013. |
| [9] | 李 娟, 全 健, 韩 凤, 等. 槲蕨愈伤组织的诱导研究[J]. 现代中药研究与实践, 2012, 26(5): 6-9. |
| [10] | 杨 爽, 方江平, 王 勇. 手掌参组织培养中外植体褐化的影响因素研究[J]. 贵州农业科学, 2012, 40(1): 22-25. |
| [11] | 郭治友, 钱绍方, 罗 应. 甜叶悬钩子植物组织培养褐化现象控制研究[J]. 安徽农业科学, 2009, 37(19): 8848-8850. |
| [12] | Shimizu M M, Melo G A, Brombini dos Santos A, et al. Enzyme characterization, isolation and cDNA cloning of polyphenol oxidases in the hearts of palm of three commercially important species[J]. Plant Physiol Biochem, 2011, 49(9): 970-977. |
| [13] | 张泽锦. 川贝母鳞茎褐变的生理因子变化及其褐变抑制 [D]. 雅安: 四川农业大学, 2010. |
| [14] | 冯小峰. 山银花多酚氧化酶及过氧化物酶酶学性质研究 [D]. 济南: 山东农业大学, 2014. |
| [15] | 李志国. 茯苓病毒与菌丝褐变现象的研究 [D]. 武汉: 华中农业大学, 2007. |
| [16] | 崔堂兵, 郭 勇, 张长远. 植物组织培养中褐变现象的产生机理及克服方法[J]. 广东农业科学, 2001(3): 16-18. |
| [17] | 王 瑶, 岳 桦. 芍药属植物组织培养中褐化问题的研究进展[J]. 黑龙江农业科学, 2009(2): 159-160. |
| [18] | 郑 超, 徐 晟, 夏 冰, 等. 三种抗氧化剂对曼地亚红豆杉愈伤组织褐化及相关物质含量的影响[J]. 植物生理学报, 2013, 49(3): 259-263. |
| [19] | 郝英超. 金银花褐变过程酚类物质代谢机理研究 [D]. 洛阳: 河南科技大学, 2013. |
| [20] | Xu C J, Zeng B Y, Huang J M, et al. Genome-wide transcriptome and expression profile analysis of phalaenopsis during explant browning[J]. PLoS One, 2015, 10(4): e0123356. |
| [21] | 雒晓芳. 药用植物当归的组织培养研究 [D]. 兰州: 西北师范大学, 2005. |
| [22] | 唐乐攀. 抗坏血酸/半胱氨酸体系非酶褐变反应动力学研究 [D]. 恩施: 湖北民族学院, 2014. |
| [23] | 周逸群, 贺福元, 杨岩涛, 等. 美拉德反应研究现状及对中药炮制和制剂工艺研究方法的影响[J]. 中草药, 2014, 45(1): 125-130. |
| [24] | 汪东风. 食品化学 [M]. 北京: 化学工业出版社, 2010. |
| [25] | 王 鹏, 李 艳, 王文静. 红金银花组织培养中防褐化技术实验[J]. 河南科学, 2015, 33(5): 735-738. |
| [26] | 邵龙珠, 赵淑君, 王淑荣, 等. 植物组织培养中的常见问题与解决技术措施[J]. 林业勘查设计, 2012(1): 49-51. |
| [27] | 邓 添, 谢少雄, 董世超, 等. 臭马比木茎段培养中污染控制和防褐化研究[J]. 广东农业科学, 2013(6): 25-28. |
| [28] | 张桂芳, 刘军民, 关杰敏, 等. 佛手组织培养中褐变控制研究[J]. 中药材, 2010, 33(6): 857-859. |
| [29] | 袁丽红, 陆玉婷, 黄 晶. 藏红花愈伤组织诱导和褐化抑制[J]. 南京工业大学学报: 自然科学版, 2009, 31(6): 21-26. |
| [30] | 雷 颖. 松潘乌头块根愈伤组织诱导及再生体系的建立[J]. 植物生理学报, 2014, 50(11): 1727-1732. |
| [31] | 秦 宇. 红豆杉组织培养体系建立与优化 [D]. 长沙: 湖南农业大学, 2012. |
| [32] | 孙周平, 褚丽敏. 刺五加腋芽培养中抗褐化初探[J]. 植物生理学通讯, 2008, 44(6): 1137-1139. |
| [33] | Morteza M, Abdolreza B, Hasan M, et al. Investigation into seasonal effect and browning inhibitor on callus regeneration of seedless Barberry (Berberis vulgaris var. asperma)[J]. Plant Tissue Cult Biotechnol, 2011, 21(2): 161-168. |
| [34] | 左利娟, 石进朝, 陈兰芬, 等. ‘傲雪'金银木组培快繁技术研究[J]. 安徽农业大学学报, 2014, 41(4): 701-705. |
| [35] | Yan S L, Yang T B, Luo Y G. The mechanism of ethanol treatment on inhibiting lettuce enzymatic browning and microbial growth[J]. LWT-Food Sci Technol, 2015, 63(1): 383-390. |
| [36] | 王培忠, 赵 欣, 张宗申. 东北矮紫杉细胞悬浮培养中褐化问题的研究[J]. 安徽农业科学, 2012, 40(10): 5760-5762. |
| [37] | 李凤华, 汤绍虎, 孙一铭, 等. 降低何首乌愈伤组织褐化研究[J]. 西南师范大学学报: 自然科学版, 2005, 30(2): 337-340. |
| [38] | 庾韦花, 蒙 平, 张向军, 等. 牛尾菜组织培养中外植体褐变现象控制研究[J]. 广西农业科学, 2010, 41(12): 1262-1265. |
| [39] | 胡 凯, 祝顺琴, 谈 锋, 等. 曼地亚红豆杉愈伤组织诱导和继代培养中抑制褐化的研究[J]. 西南师范大学学报: 自然科学版, 2004, 29(4): 659-663. |
| [40] | 徐 飞. 白首乌的组织培养及其生理生化分析 [D]. 济南: 山东农业大学, 2011. |
| [41] | 任巍威. 药用植物苦参组织培养的研究 [D]. 太原: 山西农业大学, 2013. |
| [42] | Andrea F M, Marcos Vinicius L C, Eliana S T, et al. The effect of light quality on leaf production and development of in vitro-cultured plants of Alternanthera brasiliana Kuntze[J]. Environ Exp Bot, 2011, 70(1): 43-50. |
| [43] | 王小娟. 鱼腥草愈伤组织培养及不同居群抗炎抑菌作用比较的研究 [D]. 合肥: 安徽农业大学, 2009. |
| [44] | 赵庆芳, 韩 静, 刘 静, 等. 蒙古黄芪愈伤组织诱导及褐化抑制[J]. 西北师范大学学报: 自然科学版, 2009, 45(2): 70-73. |
| [45] | Mansour A, Jamila Z, Ismail E H. Low concentration of BAP and high rate of subcultures improve the establishment and multiplication of somatic embryos in date palm suspension culture by limiting oxidative browning associated with high levels of total phenols and peroxidase activities[J]. Sci Horticul, 2011, 130(1): 344-348. |
| [46] | 邱晓芳, 朱 笃, 张志斌, 等. 杜仲愈伤组织继代培养及抑制褐化的研究[J]. 食品科学, 2007, 28(8): 307-309. |
| [47] | 贾星远. 不同激素对冬凌草花瓣愈伤组织的诱导及其次生代谢产物的影响[J]. 中国现代中药, 2015, 17(4): 379-381. |
| [48] | Lazarus A S. Effect of physiological age and growth regulators on callus browning of coconut endosperm in vitro culture[J]. Biotropia, 2011, 18(1): 31-41. |
| [49] | 李 琰, 冯俊涛, 王永宏, 等. 抗褐变剂对雷公藤愈伤组织生长和次生代谢产物含量的影响[J]. 武汉植物学研究, 2010, 28(2): 224-228. |
| [50] | 张劲松. 北细辛愈伤组织诱导及苯丙氨酸解氨酶基因片段的克隆 [D]. 济南: 东北农业大学, 2014. |
| [51] | 池 源. 药用植物山乌龟的组织培养研究 [D]. 重庆: 西南大学, 2009. |
| [52] | 韦柳成. 凤丹组织培养及培养条件对愈伤组织中丹皮酚含量的影响 [D]. 南京: 南京农业大学, 2011. |
| [53] | Wang J, Xie Y F, Fang S Z. A preliminary study on callus induction and proliferation of Cylocarya paliurus[J]. Agric Sci Technol, 2012, 13(1): 74-78. |
| [54] | 鲁光耀, 杨 仙, 蒋瑞彬, 等. 白芨组培快速繁殖体系研究[J]. 浙江中医药大学学报, 2015, 39(5): 383-390. |
| [55] | Sija S L, Potty V P, Santhoshlal P S. Impact of culture media and growth hormones on callus induction and root organogenesis in cotyledon segment of Anacardium occidentale L.[J]. Ann Plant Sci, 2015, 4(4): 1057-1063. |
| [56] | Nahid B, Nur Ashikin P A, et al. Control of contamination and explant browning in Curculigo latifolia in vitro cultures[J]. J Med Plants Res, 2013, 7(8): 448-454. |
| [57] | Amodio M L, Cabezas-Serrano A B, Peri G, et al. Post-cutting quality changes of fresh-cut artichokes treated with different anti-browning agents as evaluated by image analysis[J]. Postharvest Biol Technol, 2011, 62(2): 213-220. |
| [58] | Pratibha M, Dibya D T, Neha G, et al. Effect of antioxidants and associate changes in antioxidant enzymes in controlling browning and necrosis of proliferating shoots of elite Jatropha curcas L.[J]. Biomass Bioener, 2010, 34(12): 1861-1869. |
| [59] | Lin Y F, Lin Y X, Lin H T, et al. Inhibitory effects of propyl gallate on browning and its relationship to active oxygen metabolism in pericarp of harvested longan fruit[J]. LWT-Food Sci Technol, 2015, 60(2): 1122-1128. |
| [60] | 方 强, 乔勇进, 王海宏. 褐变抑制剂对黄芩愈伤组织褐变及次生代谢产物的影响[J]. 吉林农业大学学报, 2008, 30(6): 808-812. |
| [61] | 朱小茜. 毛豹皮樟组织培养过程中褐化控制研究[J]. 安徽科技学院学报, 2013, 17(3): 33-36. |
| [62] | 蔡长福, 卢丽俐, 苏庆桂, 等. 朱砂根组织培养防褐化探讨[J]. 福建林业科技, 2013, 40(1): 99-102. |
| [63] | 余红英. 植物组织培养中褐化的机理及对策[J]. 河南科技, 2013, 21(11): 190. |
| [64] | 李蒙飞. 手参愈伤组织培养及植株再生研究 [D]. 杨凌: 西北农林科技大学, 2014. |
| [65] | 陈贝贝, 汪安乐, 蒋 明, 等. 黄精叶钩吻组培中褐化控制的探讨[J]. 浙江农业科学, 2012, 1(4): 490-492. |
| [66] | 韩晓磊. 青葙愈伤组织培养及其药理活性研究 [D]. 长春: 吉林农业大学, 2013. |
| [67] | 王纪忠, 蒋婷婷, 朱丽丽, 等. 植物组培技术存在的问题及解决方法[J]. 现代农业科技, 2012(20): 166-167. |
| [68] | 祁建国. 植物组织培养中常见问题与对策[J]. 现代园艺, 2012(16): 197. |
| [69] | 张宏平, 姬爱国, 和林涛. 植物组培快繁褐化现象研究进展[J]. 农业工程, 2013, 3(5): 128-132. |
| [70] | Agnieszka P, Franciszek D. Improvement of medium for Miscanthus × Giganteus callus induction and plant regeneration[J]. Acta Biol Cracoviensia Series Bot, 2010, 52(1): 105-110. |
| [71] | André L L S, André L G, Gilvano E B N, et al. Micropropagation of Eucalyptus saligna SM. from cotyledonary nodes[J]. Pak J Bot, 201547(1): 311-318. |
| [72] | Nurşen C, Cüneyt A. Inhibition of browning problem during micropropagation of Sideritis trojana Bornm. , an endemic medicinal herb of Turkey[J]. Romanian Biotechnol Lett, 2011, 16(6): 6760-6765. |
| [73] | Appleton M R, Ascough G D, Staden J V. In vitro regeneration of Hypoxis colchicifolia plantlets[J]. South Afr J Bot, 2012, 80(80): 25-35. |
| [74] | Jones A M P, Saxena P K. Inhibition of phenylpropanoid biosynthesis in Artemisia annua L.: A novel approach to reduce oxidative browning in plant tissue culture[J]. PLoS One, 2013, 8(10): e76802. |
| [75] | 张 静, 田胜尼, 孙庆业, 等. EDTA螯合铜胁迫对旱柳生长和生理特性的影响[J]. 安徽农业科学, 2013, 41(6): 2351-2353. |
| [76] | 张西兴, 庞世花, 高 琪. 一种微量元素螯合铜盐的制备研究[J]. 广州化工, 2014, 42(17): 74-75. |
| [77] | Sun Y, Zhang W, Zeng T, et al. Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenolic metabolism[J]. Food Chem, 2015, 177: 376-381. |
| [78] | Zhang S Y, Yu Y W, Xiao C L, et al. Effect of carbon monoxide on browning of fresh-cut lotus root slice in relation to phenolic metabolism[J]. LWT-Food Sci Technol, 2013, 53(2): 555-559. |
| [79] | Roksana H, Wills R B H, Penta P J, et al. Effect of nitric oxide (NO) and associated control treatments on the metabolism of fresh-cut apple slices in relation to development of surface browning[J]. Postharvest Biol Technol, 2013, 78(4): 16-23. |
| [80] | 蒋 芳. 植物组织培养外植体褐变的研究进展分析[J]. 生物技术世界, 2015(5): 5. |
 2016, Vol. 47
2016, Vol. 47


