2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
阿尔茨海默病(Alzheimer’s disease,AD)是常见的中枢神经系统退行性疾病,基本特征为记忆减退、认知障碍、生活能力进行性减退,发病率随着年龄的增长而增加,已成为发达国家老年人四大死因之一。此病病程漫长且不可逆,精神上和经济上给家庭和社会带来严重的危害。随着我国人口逐渐老龄化,AD的发病率不断上升,因此,建立有效、快速筛选抗AD药物的分析方法、提高抗AD药物开发速度,具有重要意义。
高内涵筛选(high content screening,HCS)是基于荧光成像的高效筛选评价技术,近几年在新药研发领域发挥了重要作用[1]。此项技术不仅能保持待测细胞结构和功能的完整,还能从单一实验中获得多种信息,多方面考察待测样品的活性。目前,HCS技术已应用到新药研发的各个阶段[2, 3],包括药物活性筛选、毒性评估和早期的ADME(吸收、分布、代谢、排泄)研究等。
中药多成分、多靶点的特点在治疗复杂疾病方面具有显著优势。根据前期文献报道,本研究选取了20种中药,制备了60个提取物,采用β淀粉样蛋白(Aβ25-35)诱导神经细胞损伤的AD体外细胞模型,结合HCS技术对中药提取物的细胞保护作用进行筛选。Aβ是AD的主要病理特征之一,在胞外沉积形成老年斑,这可能是AD发病原因之一。神经母细胞瘤SH-SY5Y细胞是一种分化程度较低的神经肿瘤细胞,其形态、生理生化功能类似于正常神经细胞。研究表明Aβ25-35诱导SH-SY5Y细胞凋亡和坏死[4]。小檗碱是黄连的重要成分之一,有清热解毒和抗菌的功效,研究发现,小檗碱还可抑制Aβ产生、Tau蛋白过度磷酸化以及参与AD发病过程中的关键酶[5, 6],抑制Aβ诱导的SH-SY5Y细胞乳酸脱氢酶(LDH)的漏出和肿瘤坏死因子-α(TNF-α)水平的上调,对该模型发挥明显的细胞保护作用[7]。故本研究以小檗碱为阳性药,制备Aβ25-35诱导的SH-SY5Y细胞损伤模型,采用Hoechst33342、碘化丙啶(PI)双染法检测细胞晚期凋亡和坏死水平,Calcein Blue、Caspase-3/7双染检测凋亡相关蛋白Caspase-3/7水平,建立以荧光标记为基础的、有效、快速抗Aβ25-35致SH-SY5Y细胞损伤模型药物的分析方法,为治疗AD药物的研发提供理论依据。
1 材料 1.1 细胞神经母细胞瘤SH-SY5Y细胞购自南京凯基生物科技发展有限公司,用含10%胎牛血清的RPMI 1640完全培养基于37℃、5% CO2孵箱中培养。每3天按1∶5传代1次,取对数生长期细胞进行实验。
1.2 药材及主要试剂益母草Leonurus ja ponicus Houtt.、木香Aucklandia lappa Decne.、乌药Lindera aggregate(Sims)Kosterm.、刘寄奴Siphonostegia chinensis Benth.、肉苁蓉Cistanche deserticola Y.C.Ma、当归Angelica sinensis(Oliv.)Diels、丹皮Paeonia suffruticosa Andr.、续断Dipsacus asper Wall. ex Henry、杜仲Eucommia ulmoides Oliv.、防己Stephania tetrandra S.Moore、泽兰Lycopus lucidus Turcz. var. hirtus Regel、丹参Salvia miltiorrhiza Bge.、牛膝Achyranthes bidentata Bl.、淫羊藿Epimedium brevicornu Maxim.、地锦草Euphorbia humifusa Willd.、分心木Juglans regia L.、赤芍Paeonia lactiflora Pall.、元胡Corydalis yanhusuo W.T.Wang、女贞子Ligustrum lucidum Ait.、旱墨莲Eclipta prostrala L.20种中药材饮片,购自连云港康济大药房,经江苏康缘药业股份有限公司王振中研究员鉴定均为正品;RPMI 1640培养基,南京凯基生物科技发展有限公司;胎牛血清,杭州天杭生物科技有限公司;胰蛋白酶,购自Gibco公司;Aβ25-35、Hoechst33342、PI,购自Sigma公司;Calcein Blue、CellEvent Caspase-3/7 Green Detection Reagent,购自Molecular Probes公司;其他试剂均为分析纯。小檗碱购自中国食品药品检定研究院(批号110713-201212,质量分数86.7%),二甲基亚砜(DMSO)购自Sigma公司。
1.3 仪器SW-CJ-2F型超净工作台(上海博迅实业有限公司);Thermo 3111型CO2培养箱(美国Thermo Fisher Scientific);XDS-1型倒置显微镜(重庆光学仪器厂);LDZ5-2型离心机(北京京力离心机有限公司);countess型细胞自动计数仪(美国Invitrogen公司);ImageXpress Micro型高内涵细胞分析仪(美国MD公司);调温电热套(通州市申通电热器厂);R502旋转蒸发仪(上海申生科技有限公司);FD-1B-55冷冻干燥机(北京博医康实验有限公司);HH-4数显恒温水浴锅(国华电器有限公司);MP15KC计数天平(上海恒平科学仪器有限公司)。
2 方法 2.1 中药提取物的制备称取各单味药材饮片300g置于5L烧瓶中,加入10倍量水浸泡1h后,回流2h,绢布滤过,再加入8倍量水回流1h,绢布滤过,合并2次提取液,静置;取上清液上柱体积(BV)为500mL的大孔树脂,4BV纯化水去杂后,不同体积分数乙醇梯度洗脱,体积流量2 BV/h,依次得到20%、40%、95%乙醇洗脱部位,旋转蒸发仪70℃浓缩至小体积,水浴蒸干,冷冻干燥后分别得到各药材20%、40%、95%乙醇洗脱部位样品。样品用DMSO溶解,配成200 mg/mL母液,−20℃保存。
2.2 试剂的配制Aβ25-35溶液:1 mg Aβ25-35溶于943 μL无菌超纯水中,配成1 mmol/L的母液,放于37℃培养箱中老化7 d;Hoechst33342溶液:100 mg Hoechst33342溶于10 mL磷酸缓冲液(PBS)中,配成10 mg/mL母液;PI溶液:250 mg PI溶于12.5 mL DMSO中,配成20 mg/mL母液;Calcein Blue溶液:1 mg Calcein Blue溶于42.97 μL DMSO中,配成50 mmol/L母液,分装。以上试剂配制完成后均−20℃保存备用。实验前用RPMI 1640培养基稀释成实验所需浓度。
2.3 分组及给药将细胞分为对照组、模型组、阳性药(小檗碱)组和给药组。取对数生长期细胞,调整密度为6×104/mL,每孔100 μL接种于96孔板,37℃、5%CO2孵箱中培养18~20 h。20 h后吸弃旧培养基,对照组和模型组加入100 μL含0.1%DMSO的空白培养基,阳性药组加入100 μL 含25μg/mL小檗碱的培养基,给药组加入100 μL含10μg/mL中药提取物的培养基,各组DMSO体积分数不高于0.1%,每组设3个复孔。药物作用4 h后,对照组加入100 μL的空白培养基,模型组、阳性药组和给药组加入100 μL含20 μmol/L Aβ25-35的培养基(Aβ25-35终浓度为10 μmol/L);孔内总体积为200 μL。放于培养箱继续孵育48 h后进行各项指标测定。
2.4 Hoechst33342和PI双染各组细胞96孔板孵育48 h后,1500r/min离心5min,每孔小心吸除150 μL培养基,加入50 μL的Hoechst33342、PI染液(RPMI 1640培养基稀释,Hoechst33342、PI终质量浓度分别为10、15 μg/mL),避光,放入细胞培养箱中孵育10 min后,立即用高内涵细胞分析仪进行细胞成像。
2.5 Calcein Blue和Caspase-3/7双染各组细胞96孔板孵育48 h后,1500r/min离心5min,弃去板中液体,各孔加入100 μL Calcein Blue染液(RPMI1640培养基稀释,终浓度为50 μmol/L),避光,放入培养箱中孵育30min后,用预热的RPMI1640培养基洗板3次,各孔加入100 μL的Caspase-3/7染液(RPMI 1640培养基稀释,终浓度5 μmol/L),避光,放入细胞培养箱中孵育30min后,立即用高内涵细胞分析仪进行细胞成像。
2.6 细胞成像与分析Hoechst33342和PI双染成像条件如下:10倍物镜,每孔取4个视野。Hoechst33342激发波长377nm,发射波长447nm;PI激发波长543nm,发射波长593nm。以4个视野中的Hoechst33342染色细胞数(蓝色)记为总细胞数,PI染色细胞数(红色)记为晚期凋亡和坏死细胞数,阳性率=PI染色细胞数/Hoechst33342染色细胞数,保护率=(模型组阳性率-给药组阳性率)/(模型组阳性率-对照组阳性率)。
Calcein Blue和Caspase-3/7双染成像条件如下:10倍物镜,每孔取4个视野。Calcein Blue激发波长377nm,发射波长447nm;Caspase-3/7激发波长482nm,发射波长536nm。以Calcein Blue染色细胞数(蓝色)作为总细胞数,以Caspase-3/7染色细胞数(绿色)作为阳性细胞数,阳性率=Caspase-3/7染色细胞数/Calcein Blue染色细胞数,抑制率=(模型组阳性率-给药组阳性率)/(模型组阳性率-对照组阳性率)。
3 结果 3.1 模型评价Aβ25-35导致SH-SY5Y细胞PI和Caspase-3/7阳性细胞数增加,引起细胞发生凋亡、坏死以及激活Caspase-3/7,阳性药小檗碱对细胞的凋亡和坏死、Caspase-3/7的激活均有明显的抑制作用(P<0.01),该模型可用于药物筛选。结果见表 1。
| 表 1 双染法检测小檗碱的神经保护作用 Table 1 Neuroprotective effects of berberine on Aβ25-35-induced SH-SY5Y cell injury by double staining |
应用模型对60个提取物进行筛选,保护率在80%~90%的提取物有8个,90%以上的提取物有9个,结果见表 2。其中刘寄奴40%乙醇部位及丹参20%、40%乙醇部位保护效果最优,结果见表 2和图 1。
| 表 2 Hoechst33342和PI双染法检测60个中药提取物的神经保护作用 Table 2 Neuroprotective effects of 60 CMM extracts on Aβ25-35-induced SH-SY5Y cell injury by Hoechst 33342/PI double staining |
 | 图 1 刘寄奴40%乙醇部位及丹参20%、40%乙醇部位对Aβ25-35致SH-SY5Y细胞损伤模型的保护作用 Fig.1 Protective effects of threeCMM extracts on Aβ25-35-induced SH-SY5Y cell injury |
挑选Hoechst 33342/PI模型保护率在80%以上的17个中药提取物,采用Calcein Blue/(Caspase-3/7)双染法观察17个中药提取物对模型细胞Caspase-3/7活性的影响,抑制率在80%~90%的中药提取物有5个,结果见表 3。其中刘寄奴40%乙醇部位及丹参20%、40%乙醇部位提取物抑制率最优,均在90%以上,能够较好地抑制Aβ25-35诱导的神经细胞中Caspase-3/7活性增加,见图 2。结果提示应用HCS技术能够筛选出具有神经细胞保护活性的中药提取物。
| 表 3 CalceinBlue和Caspase-3/7双染法检测17个中药提取物对模型细胞Caspase-3/7活性的影响 Table 3 Effects of 17CMM extracts on cell model of Caspase-3/7 by Calcein Blue and Caspase-3/7 double staining |
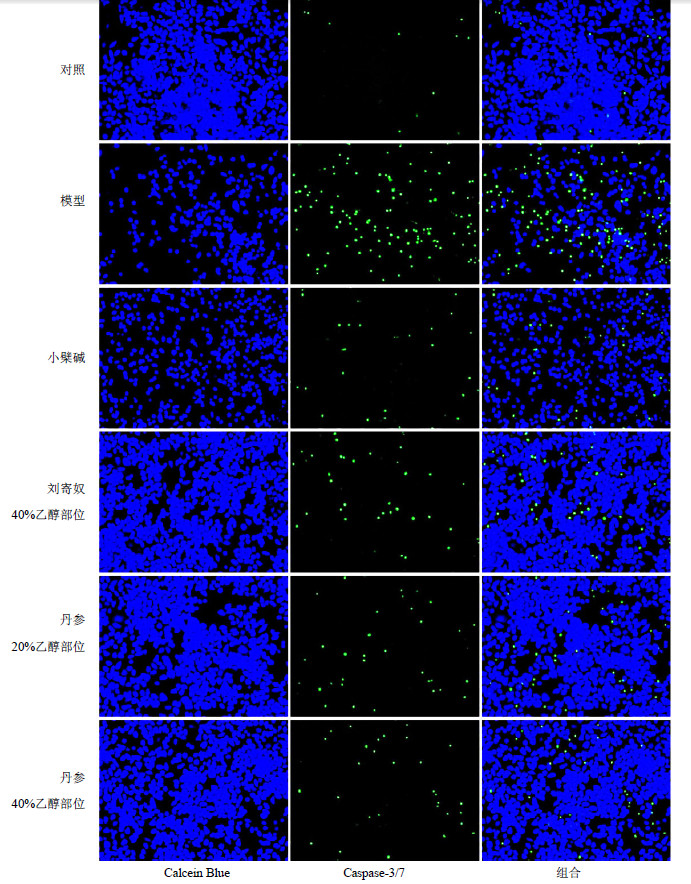 | 图 2 刘寄奴40%乙醇部位及丹参20%、40%乙醇部位对Aβ25-35致SH-SY5Y细胞损伤模型Caspase-3/7活性的影响 Fig.2 Effects of threeCMM extracts on Caspase-3/7activityin SH-SY5Y cellinjuried byAβ25-35 |
AD是最常见的神经退行性疾病,此病病理特征是神经元胞外形成老年斑(senile plaque,SP)、神经元胞内形成神经原纤维缠结(neurofibrillarytangles,NFTs)以及神经元的丢失。此病发病机制至今不明,病因有多种学说,例如β-淀粉样蛋白(Aβ)沉积学说、基因突变学说、胆碱能受损学说、铝中毒假说等。目前认为,Aβ是各种原因诱导AD的共同通路,是AD发生过程中的重要环节[8]。Aβ是淀粉样前体蛋白(APP)的一个39~43个氨基酸残基组成的肽段,是SP的主要成分。研究认为痴呆的发生是由于Aβ在脑内广泛沉积,最终引起神经元退化和凋亡[9]。聚集态的Aβ不仅能够直接对神经元产生损伤作用,同时也能增强神经元对兴奋性氨基酸、神经毒素等损伤因子的敏感性,诱导神经元出现坏死和凋亡[10, 11, 12]。Aβ损伤神经元初期,细胞膜完整,细胞逐渐皱缩,同时发生核固缩等现象,最终形成凋亡小体[13]。Aβ损伤神经元后24 h,提取神经元DNA,DNA ladder检测结果也证实凋亡的发生[14]。目前普遍认为细胞凋亡是半胱氨酸蛋白酶Caspase级联反应的结果,Caspase-3、6、7处于级联反应下游,是凋亡的执行者。研究发现,Aβ25-35可引起小脑颗粒细胞和皮质神经元发生凋亡,模型细胞中Caspase-3活性增加,Caspase-3特异性抑制剂可抑制Aβ25-35造成的损伤[15]。向大鼠脑室内注射Aβ可以活化Caspase-3和Caspase-7[16],也有研究认为,Aβ活化凋亡通路上游的启动蛋白酶,经级联放大反应激活下游的效应蛋白酶[17]。Caspase-3在凋亡中起重要作用,以酶原形式存在的Caspase-3被激活后,活化的Caspase-3切割多种蛋白质底物,例如细胞骨架蛋白、抗凋亡蛋白和修复DNA的酶等,最终导致细胞死亡[18]。
本研究利用Aβ25-35损伤SH-SY5Y细胞建立体外AD模型,小檗碱为阳性对照,采用Hoechst33342和PI双染法,利用HCS技术观察60个中药提取物对模型细胞的保护作用,Hoechst33342、PI均可与DNA结合,Hoechst33342为膜通透性染料,而PI不能通过正常的细胞膜,只有在细胞处于晚期凋亡或坏死时,PI可与核结合。并用Calcein Blue和Caspase-3/7双染法观察活性提取物对模型细胞Caspase-3/7活性的影响。Caspase-3/7均为下游效应蛋白酶,直接作用于底物蛋白,引起凋亡。Caspase-3/7的激活被认为是凋亡发生的关键事件,以caspase-3/7的活化水平反应细胞的凋亡水平[19]。该染料被凋亡细胞中的Caspase-3/7切割后,切割产物可与DNA结合,发出绿色荧光;Calcein Blue被活细胞摄取后,切割AM基团,切割产物无法自由出入细胞,在胞内呈蓝色荧光。研究发现,刘寄奴40%乙醇部位及丹参20%、40%乙醇部位对Aβ25-35引起的细胞损伤有较好的保护作用。
虽然刘寄奴对AD的治疗活性未见报道,但北京大学的研究人员从刘寄奴中分离得到11个黄酮类化合物和2个黄酮木脂素类化合物,其中包括柚皮素和槲皮素[20]。有报道指出,柚皮素可减少链脲佐菌素诱导的AD模型大鼠Tau蛋白磷酸化水平和Aβ的水平,改善模型大鼠的认知能力和学习记忆能力[21]。槲皮素能够降低喹啉酸诱导的AD模型大鼠海马组织钙水平和血清自由基水平,改善模型大鼠学习记忆能力[22, 23]。有研究指出,丹参能够缓解AlCl3致AD模型小鼠学习记忆能力的减退,降低模型小鼠脑内及血清中胆碱酯酶活性[24]。丹参提取物隐丹参酮能够剂量依赖的减少跳台实验和水迷宫实验的错误次数,改善模型小鼠的学习记忆能力[25]。槲皮素、柚皮素和隐丹参酮可能是这3种中药提取物中的活性成分。它们对Aβ25-35致SH-SY5Y细胞损伤模型保护作用可能与抗凋亡作用有关,本研究为开发治疗AD药物提供了实验依据。
综上所述,本研究应用HCS技术观察60个中药提取物对Aβ25-35致SH-SY5Y细胞损伤模型的保护作用,筛选所得提取物对Aβ25-35致SH-SY5Y细胞损伤模型有较好的保护作用,可能是通过抑制Caspase-3/7的活性、抑制凋亡通路而发挥作用的。此方法与传统的荧光显微镜相比,具有通量高、效率高的优点,能够快速、客观地把图片结果转换为数值结果;与流式细胞术相比,无需消化细胞,细胞成团对实验无太大影响,需要的细胞量少;与Western Blotting相比,减少了细胞蛋白提取、定量、电泳分离等一系列步骤,大大缩短了检测时间。应用HCS技术快速发现具有潜在活性的药物对新药研发具有重要意义。
| [1] | Liptrot C. High content screening-from cells to data to knowledge [J]. Drug Discov Today, 2001, 6(16): 832-834. |
| [2] | Giuliano K A, Haskins J R, Taylor D L. Advances in high content screening for drug discovery [J]. Assay Drug Dev Technol, 2003, 1(4): 565-577. |
| [3] | Lessman C A. The developing zebrafish (Danio rerio): a vertebrate model for high-throughput screening of chemical libraries [J]. Birth Defects Res C Embryo Today, 2011, 93(3): 268-280. |
| [4] | 蔡 贞, 姬志娟, 徐艳玲, 等. APP17肽对Aβ25-35诱导神经细胞凋亡保护作用 [J]. 中国药理学通报, 2002, 18(1): 31-35. |
| [5] | 马丽丽, 陈晓红. 小檗碱在神经系统疾病中的应用进展 [J]. 新医学, 2012(7): 437-440. |
| [6] | 王 静, 张艳军, 常亮堂. 小檗碱对Aβ25-35损伤大鼠皮层神经元的保护作用 [J]. 中草药, 2011, 42(4): 728-733. |
| [7] | 许 旌, 张 洪, 杨 帆, 等. 小檗碱对Aβ25-35致SH-SY5Y细胞株炎症反应中TNF-α及I型受体表达的干预作用 [J]. 中国中药杂志, 2013(9): 1327-1330. |
| [8] | Ashall F, Goate A M. Role of the beta-amyloid precursor protein in Alzheimer's disease [J]. Trends Biochem Sci, 1994, 19(1): 42-46. |
| [9] | Zhu H, Fu W, Mattson M P. The catalytic subunit of telomerase protects neurons against amyloid beta-peptide-induced apoptosis [J]. J Neurochem, 2000, 75(1): 117-124. |
| [10] | Kim H, Park B S, Lee K G, et al. Effects of naturally occurring compounds on fibril formation and oxidative stress of beta-amyloid [J]. J Agric Food Chem, 2005, 53(22): 8537-8541. |
| [11] | Awasthi A, Matsunaga Y, Yamada T. Amyloid-beta causes apoptosis of neuronal cells via caspase cascade, which can be prevented by amyloid-beta-derived short peptides [J]. Exp Neurol, 2005, 196(2): 282-289. |
| [12] | Ma B, Meng X, Wang J, et al. Notoginsenoside R1 attenuates amyloid-beta-induced damage in neurons by inhibiting reactive oxygen species and modulating MAPK activation [J]. Int Immunopharmacol, 2014, 22(1): 151-159. |
| [13] | Loo D T, Copani A, Pike C J, et al. Apoptosis is induced by beta-amyloid in cultured central nervous system neurons [J]. Proc Natl Acad Sci USA, 1993, 90(17): 7951-7955. |
| [14] | Geula C, Wu C K, Saroff D, et al. Aging renders the brain vulnerable to amyloid beta-protein neurotoxicity [J]. Nat Med, 1998, 4(7): 827-831. |
| [15] | Allen J W, Eldadah B A, Huang X, et al. Multiple caspases are involved in beta-amyloid-induced neuronal apoptosis [J]. J Neurosci Res, 2001, 65(1): 45-53. |
| [16] | 姜 艳, 金 英, 王世兴, 等. 吡格列酮对淀粉样β蛋白片段1-42引起的大鼠海马神经细胞凋亡相关蛋白表达的影响 [J]. 中国药理学与毒理学杂志, 2008, 22(5): 355-361. |
| [17] | Harada J, Sugimoto M. Activation of caspase-3 in beta-amyloid-induced apoptosis of cultured rat cortical neurons [J]. Brain Res, 1999, 842(2): 311-323. |
| [18] | 王旭刚, 高 政. 预防性应用阿托伐他汀对SD大鼠局部脑缺血再灌注脑组织Caspase-3表达的影响 [J]. 中国实用神经疾病杂志, 2011, 14(16): 20-22. |
| [19] | Onodera R, Motoyama K, Okamatsu A, et al. Potential use of folate-appended methyl-beta-cyclodextrin as an anticancer agent [J]. Sci Rep, 2013, 3: 1104. |
| [20] | 温 晶, 史海明, 昝 珂, 等. 刘寄奴的化学成分研究 [J]. 中草药, 2010, 41(6): 870-873. |
| [21] | 杨文青, 马 晶, 余华荣. 柚皮素改善阿尔茨海默病模型大鼠的认知能力及其机制研究 [J]. 中草药, 2013, 44(6): 715-720. |
| [22] | 李永金, 顾振纶. 槲皮素对Alzheimer病大鼠的脑保护作用及其机理研究 [J]. 中成药, 2002, 24(11): 859-862. |
| [23] | 李永金, 顾振纶, 陈月芳, 等. 槲皮素对阿尔茨海默病大鼠学习记忆影响及与海马细胞凋亡关系的研究 [J]. 中草药, 2003, 34(7): 632-635. |
| [24] | 仇淑君, 王忠良, 李广意, 等. 丹参对AD模型小鼠学习记忆及脑内和血清内乙酰胆碱酯酶水平的影响 [J]. 实验动物科学, 2014, 31(4): 11-13. |
| [25] | 梅峥嵘. 隐丹参酮对阿尔茨海默病的治疗作用及其机制研究 [J]. 广州: 中山大学, 2009. |
 2016, Vol. 47
2016, Vol. 47


