2. 黑龙江中医药大学药学院, 黑龙江 哈尔滨 150040
2. Department of Pharmacognosy, Heilongjiang University of Chinese Medicine, Harbin 150040, China
北青龙衣为胡桃科(Juglandaceae)胡桃属Juglans L.植物核桃楸Juglans mandshurica Maxim.的未成熟果实的外果皮[1]。民间多年来一直用于治疗恶性肿瘤,并被2001年版《黑龙江省中药材标准》收载[2]。近年来,国内外学者对其抗肿瘤活性进行了大量的报道[3-5],对其化学成分也进行了大量的研究。目前,从北青龙衣中分离得到的化合物有萘醌类、黄酮类、二芳基庚烷类、萜类、鞣质类、多糖类、有机酸类及挥发油等[6-8]。
胡桃科多种药用植物均可作为青龙衣入药,导致其基原多、产地多,品种混乱、质量参差不齐,尤其是过季的废弃核桃皮大量充斥市场,影响临床疗效。课题组前期研究表明不同产地、不同采收时期北青龙衣指纹峰差异较大,然而目前关于北青龙衣质量控制多集中于胡桃醌的定量测定[9-10],胡桃醌化学性质不稳定,难以有效控制药材质量。因此,明确北青龙衣所含主要的、稳定的化学成分对于有效评价及控制药材质量具有重要意义。另一方面,北青龙衣中所含的萘醌类化合物性质不稳定,传统的植物化学研究方法不仅耗时耗力,而且长时间的提取、加热浓缩以及长期暴露在空气中均可导致分离获得的化合物结构发生变化,而非药材所含原型成分。因此,明确北青龙衣药材主要原型成分对进一步研究其药效物质基础具有现实意义。
超高效液相色谱(UPLC)通过在色谱柱上使用小颗粒填料以及其他部件的改进,具有更高的分离度、更快的分析速度和更大的峰容量等优点。四级杆-飞行时间串联质谱(Q-TOF)为高分辨质谱仪,不仅具有高分辨、高选择性的特点,通过精确的相对分子质量快速确定化合物分子式。还可以通过高低能碰撞扫描,提供丰富的二级质谱信息,再通过对照品比对及裂解规律分析,从而鉴定或推断化合物结构。近年来,将液相色谱的高效分离能力和质谱的高灵敏度相结合,尤其是与高分辨质谱和多级质谱联合使用的技术手段,已广泛应用于中药成分的分析,为研究天然产物开辟了全新的途径[11-15]。
本研究采用超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-TOF/MS)技术对多产地、大样本的北青龙衣进行在线分离分析研究,通过化学计量学模式确定其共有的主要化学成分。利用UPLC一维的保留时间锁定化合物,通过二维的精确质量数和同位素峰度比确定分子式,再通过对照品比对或质谱裂解规律分析确定或推断其结构式。最终鉴定或推断了北青龙衣中31种主要化学成分,其中包括11种萘醌类、3种二芳基庚烷、3种黄酮、8种三萜类及6个其他类化合物。本研究以期为北青龙衣的质量评价指标的选择提供科学依据,为其药效物质的深入研究奠定基础,亦为胡桃属药用植物类似化学成分的质谱裂解途径研究提供借鉴和参考。
1 仪器与材料 1.1 仪器ACQUITY UPLC(美国Waters公司,包括二元高压梯度泵、真空脱气机、自动进样器、柱温箱);AB SCEIX Triple-TOFTM 5600+型质谱仪(AB SCIEX,USA,配有ESI源和APCI源),数据采集软件:Analyst TF 1.6 software(AB SCEIX,USA);数据处理软件系统:Peakview 2.0/masterview1.0 software(AB SCEIX,USA)、Markerview 1.2.1(AB SCEIX,USA);Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),AQUITY UPLC BEH C18 VanGuard Pre-Column预柱(5 mm×2.1 mm,1.7 μm)。KQ-300DB型数控超声仪(昆山市超声仪器有限公司);BSA224S-CW型电子天平(赛多利斯科学仪器公司);LG16-W型高速离心机(北京京立离心机有限公司)。
1.2 试剂甲醇(分析纯,天津市科密欧化学试剂有限公司),乙腈(色谱纯,Merck,德国),甲酸(色谱纯,Fisher,美国),蒸馏水(广州屈臣氏食品饮料有限公司)。
1.3 药材与对照品北青龙衣药材于2014年7月至8月采自黑龙江省13个不同产地,每产地取3个采样点,每采样点采集2份样品,见表 1。药材均经黑龙江省中医药科学院初东君主任药师鉴定为胡桃属植物胡桃楸Juglans mandshurica Maxim.未成熟果实。剥取外果皮,通风处阴干,7 d后用于样品制备。
|
|
表 1 不同产地北青龙衣样品信息 Table 1 Information on samples of exocarp of J. mandshurica from different habitats |
对照品胡桃酮、1, 5-萘二酚(自制,经归一化法测定质量分数大于98%);金丝桃苷(批号111521-200303,中国食品药品检定研究院,质量分数大于99%);熊果酸(X-006-110812,成都瑞芬思生物科技有限公司,质量分数大于99%)。
2 方法 2.1 对照品溶液的制备精密称取胡桃酮、1, 5-萘二酚、金丝桃苷、熊果酸对照品适量,加甲醇分别制成约50 μg/mL的溶液作为对照品溶液。
2.2 供试品溶液的制备取不同产地青龙衣药材1.0 g,精密称定,分别加甲醇25 mL超声处理(功率300 W,频率40 kHz)30 min,放冷,补足甲醇,摇匀,滤过,取续滤液于−80 ℃冻存,分析前恢复室温,13 000 r/min离心5 min,取上清液,即得。
2.3 色谱条件Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),AQUITY UPLC BEH C18 VanGuard Pre-Column预柱(5 mm×2.1 mm 1.7 μm),柱温30 ℃,流动相A为0.1%甲酸水,B为0.1%甲酸乙腈,梯度洗脱:0~3 min,5%~22% B;3~15 min,22%~60% B;15~20 min,60%~70% B;20~29 min,70%~100% B;29~30 min,100% B。体积流量0.3 mL/min,进样量2 μL。
2.4 质谱条件采用ESI离子源,离子化模式为电喷雾正离子模式,离子源电压为5 500 V,离子源温度为550 ℃,裂解电压(DP)分别为80 V,碰撞能量(CE)分别为35 eV,碰撞能量扩展(CES)分别为15 eV。雾化气体为氮气,辅助气Gas1为38 kPa,辅助气Gas2为38 kPa,气帘气Cur Gas为24 kPa。一级质谱母离子扫描范围为80~1 500,IDA设置响应值超过100 cps的8个最高峰进行二级质谱扫描,子离子扫描范围为m/z 50~1 500,开启动态背景扣除(DBS)。数据采集软件:Analyst TF 1.6 software(AB SCEIX,USA);数据处理软件系统:Peakview 2.0/masterview1.0 software(AB SCEIX,USA)、Markerview 1.2.1(AB SCEIX,USA)。
2.5 数据分析吸取13个产地78份北青龙衣供试品溶液,进样测定,记录UPLC-MS色谱图。通过Markerview 1.2.1软件提取78个样本中1 000个离子,依据离子强度排序,按离子在所有样本中均出现,且相对强度基本大于e4的原则选取共有离子。共有离子通过Peakview 2.0/masterview1.0软件,依据精确质量数和同位素峰度比确定分子式,通过对照品及数据库的二级谱图比对、裂解规律分析,结合已有文献报道,确定共有离子结构式。
3 结果 3.1 UPLC-Q-TOF/MS分析经过色谱条件和质谱条件的优化,选择正离子模式下,按照“2.3”及“2.4”项条件分析,获得了良好的分离效果及离子化效率,其中产地为1-FZ样品的总离子流图(TIC)见图 1。
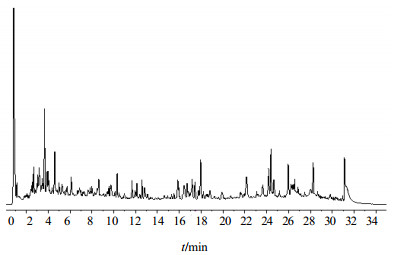
|
图 1 北青龙衣供试品正离子TIC图 Fig.1 UPLC-MS TIC of exocarp of J. mandshurica in positive mode |
按照“2.3”及“2.4”实验条件分别对13个产地78份样本北青龙衣药材样品进行UPLC-Q-TOF/MS分析,不同产地样品指纹图谱见图 2。
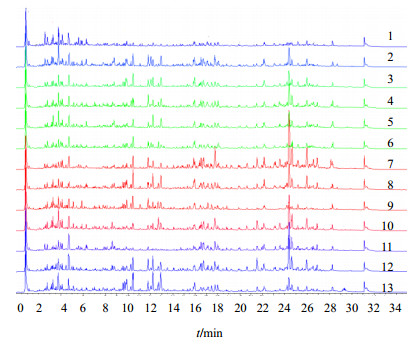
|
图 2 不同产地北青龙衣药材ESI+TIC指纹图谱 Fig.2 ESI + TIC Fingerprint of exocarp of J. mandshurica from 13 different habitats obtained by UPLC/Q-TOF-MS in positive mode |
由图 2可知,不同产地药材总离子流图整体具有一定的相似性,局部又有较大差异,然而通过masterview1.0软件非目标性筛查表明,每个色谱峰往往代表了多种化合物,各样本之间亦存在较大差异,因此,采用“2.5”项下的选取原则,共筛选出36个在所有北青龙衣样本中均稳定出现且离子强度较高的化合物。
3.2 结构鉴定飞行时间质谱为高分辨质谱可以测得偏差<1.0×10−5的离子质量,同时结合同位素丰度比进行分析,可以准确计算所测化合物的分子式。明确各共有峰的分子式能够保证在色谱参数或仪器设备发生变化而导致保留时间发生漂移时,仍可通过分子离子m/z值搜索而对该峰进行准确定位,从而保证指纹图谱的良好重复性。
对选取的36个共有化合物进行了结构分析,其中部分化合物无法给出分子式或无二级碎片。其他化合物结合ESI正负离子模式下检测所得的精确相对分子质量,利用Peakview 2.0计算获得可能的元素组成,确定可能的分子式。各成分经二级质谱分析,得到了特征碎片离子及准确的化学元素组成,与masterview1.0软件的理论质谱碎片计算结果相匹配,结合chemspider数据库给出的结构信息、对照品二级谱图以及胡桃属植物化学成分文献数据,鉴定或推断了其中31个化合物的结构,包括11个萘醌类、3个二芳基庚烷类、3个黄酮类、8个三萜类及6个其他类化合物。结果见表 2。
|
|
表 2 北青龙衣共有离子结构信息 Table 2 Information of common ion construction of exocarp of J. mandshurica |
3.2.1 萘醌类
萘醌类化合物是北青龙衣中主要的抗肿瘤活性物质[6],连续失去H2O和CO是其典型的质谱裂解规律[16-17]。以化合物10为例,其准分子离子179 [M+H]+丰度比较低,易连续失去H2O形成稳定的161 [M+H-H2O]+、143 [M+H-2H2O]+碎片离子,而161,143碎片离子可继续丢失CO形成133 [M+H-H2O-CO]+、115 [M+H-2H2O-CO]+碎片离子,在高能碰撞下,也可发生六元环开裂产生的一系列碎片。化合物10与核桃酮对照品二级碎片基本吻合,因此,鉴定化合物10为核桃酮,其二级质谱、裂解可能途径分别见图 3、4。
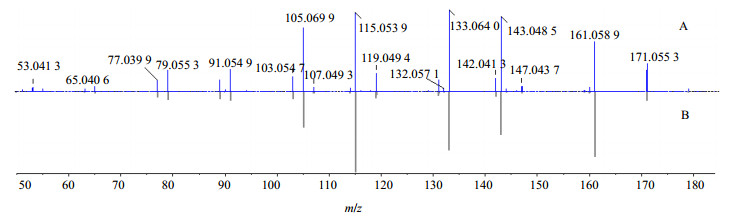
|
图 3 化合物10 (A)二级质谱及核桃酮对照品(B)比对镜像图 Fig.3 MS/MS spectrum for compound 10 (A) and mirror image of reference substance (B) |
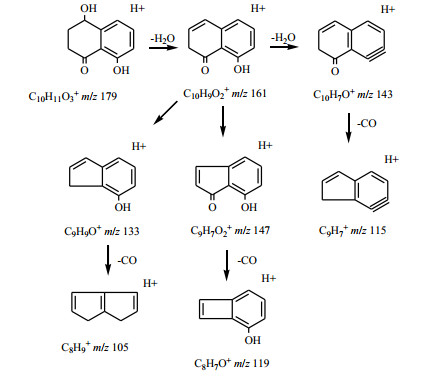
|
图 4 化合物10可能的裂解途径 Fig.4 Possible fragmentation pathway for compound 10 |
3.2.2 黄酮类
黄酮类成分是广泛存在于自然界的一大类化合物,多种黄酮类化合物都具有明显的抗肿瘤和逆转肿瘤细胞多药耐药作用,但黄酮类成分没有萘醌类和二芳基庚烷类化合物作用显著[6]。关于此类化合物的质谱裂解规律报道较多[16-17],以化合物11为例,其准分子离子273 [M+H]+丰度比较高,失去B环及C环发生重排,可产生丰度比最高的153 [M+H-C8H8O]+碎片离子。还易失去1分子子H2O形成255 [M+H-H2O]+碎片离子,该碎片离子不稳定,易失去B环及C环O原子而形成147[M+H-H2O-C6H4O2]+碎片离子。147离子可在高能碰撞下产生一系列丰度比较低的子离子。综合以上信息,推断化合物11为柚皮素,其二级质谱、裂解可能途径分别见图 5、6。
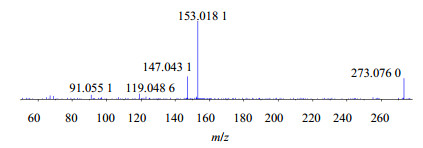
|
图 5 化合物11二级质谱 Fig.5 MS/MS spectrum for compound 11 |
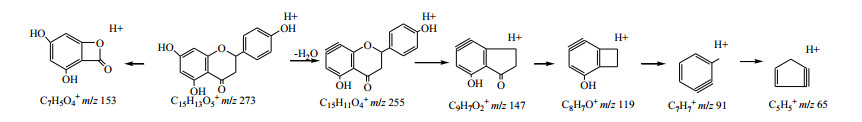
|
图 6 化合物11可能的裂解途径 Fig.6 Possible fragmentation pathway for compound 11 |
3.2.3 二芳基庚烷类
二芳基庚烷类化合物是一类比较特殊的天然产物,其特点是2个特征性很强的芳环与七碳线型长链相连,此类成分是胡桃属植物中另一类重要的抗肿瘤活性成分[6]。关于此类化合物的质谱裂解规律很少报道,以化合物19为例,对其质谱裂解规律进行了初步的推断。其准分子离子327 [M+H]+丰度比较高,其有3条可能的主要裂解途径:(1)易失去1分子H2O形成309 [M+H-H2O]+碎片离子,该碎片离子不稳定,易发生大环开环,重排形成丰度比最高的131 [M+H-H2O-C11H14O2]+碎片离子;(2)可开环形成207 [M+H-C8H8O]+碎片离子,207离子可连续失去-O、-H2O及-CH2形成丰度比较高的159 [M+H-C8H8O-O-H2O-CH2]+碎片离子;(3)可在环氧大环位置连续失去羰基及周围的亚甲基等一系列碎片而形成121[M+H-C12H14O3]+碎片离子。综合以上信息,推断化合物11为galeon,其二级质谱、裂解可能途径分别见图 7、8。
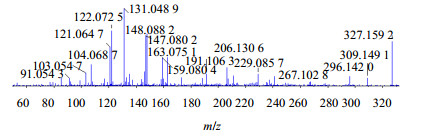
|
图 7 化合物19二级质谱 Fig.7 MS/MS spectrum for compound 19 |
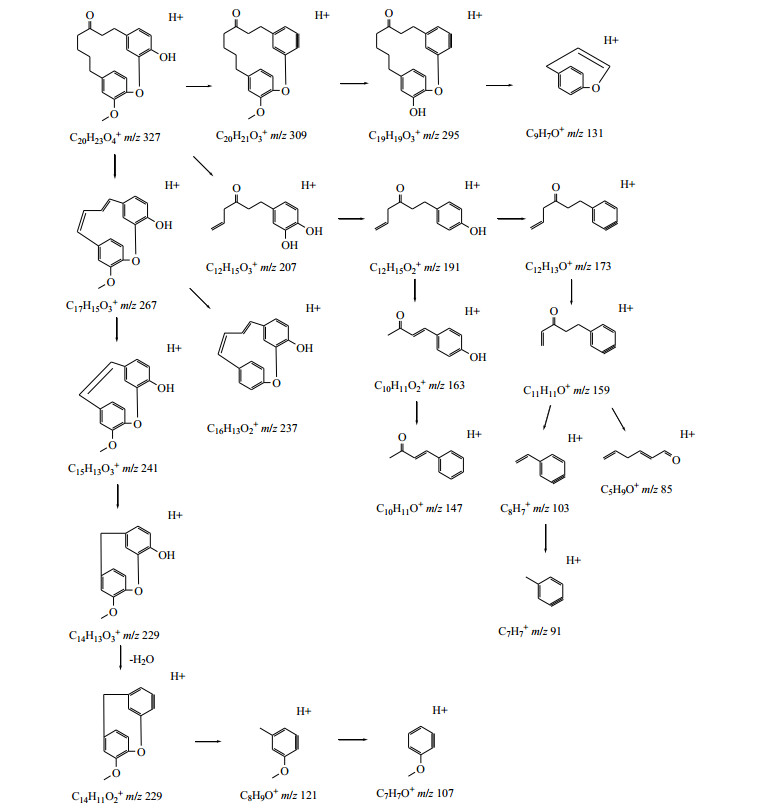
|
图 8 化合物19可能的裂解途径 Fig.8 Possible fragmentation pathway for compound 19 |
3.2.4 三萜类化合物
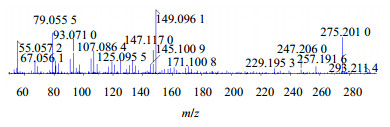
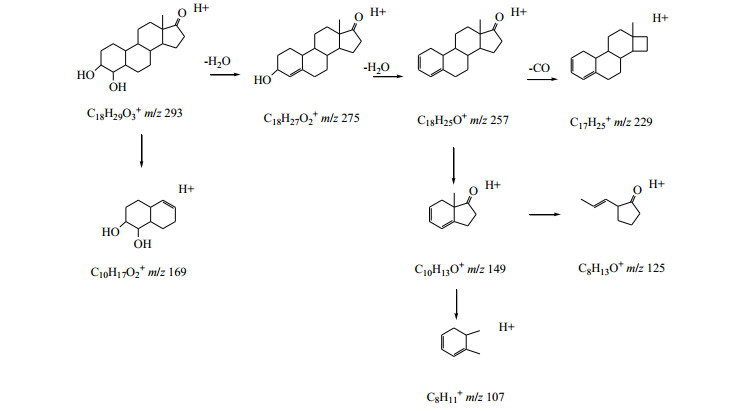
最新研究从胡桃属植物中分离出多种三萜类成分,具有良好的抗肿瘤活性,且此类成分毒性远低于萘醌类化合物,具有研究和开发潜力[6]。目前关于三萜苷类成分糖基质谱裂解规律报道较多[16-17],而苷元报道较少。以化合物23为例,对其质谱裂解规律进行了的推断。其准分子离子293 [M+H]+丰度比较低,易连续失去H2O形成稳定的275 [M+H-H2O]+、257 [M+H-2H2O]+碎片离子,而257碎片离子可继续丢失CO形成229 [M+H-2H2O-CO]+碎片离子,也可失去A环和B环形成丰度比最高的149 [M+H-2H2O-C8H12]+碎片离子,此外,准分子离子293 [M+H]+也可直接丢失C环和D环,形成169 [M+H-C8H12O]+碎片离子,综合以上信息,推断化合物23为3, 4-dihydroxyestran-17-one,其二级质谱、裂解可能途径分别见图 9、10。
|
图 9 化合物23二级质谱 Fig.9 MS/MS spectrum for compound 23 |
|
图 10 化合物23可能的裂解途径 Fig.10 Possible fragmentation pathway for compound 23 |
4 讨论
本研究广泛收集了黑龙江省13个产地的78批北青龙衣,具有一定的代表性,且准确标记了产地的经纬度,结果具有可溯源性。采用HPLC-Q-TOF/MS技术,首次对北青龙衣的化学成分进行了研究。通过提取不同产地样本的36个共有离子,对北青龙衣的主要化学成分进行分析鉴定,再通过二级碎片离子对其加以确认,共推测鉴定出31个化合物。这31个化合物在不同来源的北青龙衣药材中均稳定出现,可作为北青龙衣的主要药效物质基础加以深入研究,也可选取其中药理活性较强的化合物对北青龙衣质量进行评价和控制。
研究过程中对36个共有峰结构分析发现,部分化合物偏差在5×10−6~1×10−5,甚至超出1×10−5。而高分辨质谱鉴定往往要求母离子偏差小于5×10−6,分辨率与化合物质量数密切相关,目前高分辨质谱仪小于2×10−6的指标来源于测定近1 000(m/z)化合物的结果。而中药小分子化合物往往小于500(m/z),且二级谱图的匹配是更重要的鉴定依据。因此,适当放宽母离子偏差的要求,有助于更好认识中药化合物的丰富性。
本研究为北青龙衣的化学成分鉴定提供了一种高效的分析方法,该方法能够在较短时间内完成化学成分分析的工作,避免了从粗提物纯化才能鉴别的繁琐过程以及结构的变化,同时实现北青龙衣药材多组分的良好分离并提供各峰的组成和结构信息。但高分辨质谱技术在结构鉴定方面依然存在一定的局限性,例如,对取代基取代不同位点的同分异构体的确认,裂解碎片的合理解释等相关文献较少。因此,采用多级质谱数据进行结构确认的工作需要进一步研究,通过总结不同类型化合物在不同厂商仪器上的质谱碎裂模式与规律,为中药化学成分及其类似物质的结构解析提供参考。此外,一些未知成分分析、化合物的几何构型、糖基的连接位置,需要进一步结合核磁共振技术进行分析,获得化合物的准确结构。因此,认为液质联用技术高通量的在线分析与传统植物化学的单一成分的精细鉴定相结合将有力推动中药化学成分的研究。
| [1] | 江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 1986 . |
| [2] | 黑龙江省中药材标准[S].2001. |
| [3] | 俞文婕, 添敏, 翟延君. 胡桃楸抗肿瘤作用及其机制研究概况[J]. 中国实验方剂学杂志 , 2012, 18 (20) :329–332. |
| [4] | Ji C F, Yue L, Ji Y B. Effect of qinglongyi polysaccharides on complex mobility of erythrocytes in S 180 mice[J]. Chin Herb Med , 2013, 5 (1) :58–61. |
| [5] | 陈默然, 赵行宇, 沈楠, 等. 核桃青皮提取物对HeLa细胞增殖及caspase-3蛋白表达的影响[J]. 吉林医药学院学报 , 2011, 32 (5) :251–253. |
| [6] | 周媛媛, 王栋. 胡桃属植物抗肿瘤作用化学成分研究进展[J]. 中国药房 , 2010, 21 (43) :4119–4120. |
| [7] | 管小玉, 曲中原, 邹翔, 等. 胡桃楸的化学成分研究进展[J]. 中草药 , 2009, 40 (增刊) :35–38. |
| [8] | 周媛媛, 刘兆熙, 孟颖, 等. 青龙衣有效部位化学成分研究[J]. 中草药 , 2014, 45 (16) :2303–2306. |
| [9] | 侯栋, 高哲, 何童森, 等. HPLC测定核桃青皮中胡桃醌的含量[J]. 中国实验方剂学杂志 , 2012, 18 (15) :70–72. |
| [10] | 季宇彬, 陆婉, 曲中原, 等. 不同干燥方法、贮藏年限及采收时间对青龙衣中胡桃醌的影响[J]. 现代药物与临床 , 2009, 24 (2) :110–112. |
| [11] | 张小平, 蒋可志, 吕惠卿, 等. UPLC-Q-TOF鉴定条叶榕根茎乙酸乙酯提取物中的主要化学成分[J]. 质谱学报 , 2015, 36 (4) :310–320. |
| [12] | 李伟, 刘亚丽, 宋永贵, 等. UPLC-Q-TOF-MSE结合OPLS-DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J]. 中草药 , 2015, 46 (15) :2212–2217. |
| [13] | 郭宜城, 欧阳辉, 何明珍, 等. UPLC/Q-TOF-MS/MS鉴定西南银莲花中的皂苷类成分[J]. 中草药 , 2014, 45 (10) :1378–1386. |
| [14] | 张水寒, 蔡萍, 陈林, 等. 高效液相色谱-四级杆-飞行时间串联质谱分析雪峰虫草化学成分[J]. 中草药 , 2015, 46 (6) :817–821. |
| [15] | 李振华, 徐金娣, 鞠建明, 等. 川楝子水提化学成分的UPLC-ESI-Q-TOF-MS分析[J]. 中草药 , 2015, 46 (4) :496–501. |
| [16] | 吴立军. 天然药物化学[M]. 北京: 人民卫生出版社, 2005 . |
| [17] | 刘淑莹, 宋凤瑞, 刘志强. 中药质谱分析[M]. 北京: 科学出版社, 2012 . |
 2016, Vol. 47
2016, Vol. 47


