2. 云南省省级中药原材料质量监测技术服务中心, 云南 昆明 650200 ;
3. 云南中医学院中药学院, 云南 昆明 650500
2. Yunnan Technical Center for Quality of Chinese Materia Medica, Kunming 650200, China ;
3. College of Chinese Materia Medica, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China
重楼属Paris L.植物系百合科(Liliaceae)多年生草本,全世界共有24个种,分布于亚欧大陆的热带及温带地区,我国有19个种,主要分布在云南、贵州、四川等西南地区[1]。重楼在我国民间具有悠久的药用历史,《本草纲目》记载,名为“蚤休”,来源于重楼属的多个种,“治惊风,摇头弄舌,热气在腹中,癫疾,痈疮阴蚀,下三虫,去毒蛇”[2]。《滇南本草》记载重楼来源为滇重楼,“外科之至药也,主治一切无名肿毒,利小便”[3]。《中国药典》2015年版记载为云南重楼或七叶一枝花的干燥根茎,功能主治为“清热解毒,消肿止痛,凉肝定惊等,用于疔疮痈肿,咽喉肿痛,虫蛇咬伤,跌扑伤痛,惊风抽搐”[4]。现代研究表明其主要化学成分为甾体皂苷类、黄酮类、三萜类、脂肪酸类等,具有抗肿瘤、抗菌、止血、驱虫等药理作用[5]。近年来,国内外学者对该属植物进行了广泛研究,本文对重楼属植物的系统分类、化学成分和药理作用进行综述,为深入研究重楼属植物提供参考。
1 重楼属植物分类1888年Franchet将重楼属分为Sect. Euparis和Sect. Euthyra 2个组,此后,国内外学者将本属植物进行多次分组。我国植物学家李恒根据植物形态特征及演化趋势,确定了新的分类系统[1],包括8个组,24个种,12个变种,2个变型。本文归纳了该属植物的组别、种名、拉丁名以及分布地域,见表 1。
|
|
表 1 重楼属植物种类及资源分布 Table 1 Species and distribution of plants in Paris L. |
2 化学成分
重楼属的化学成分研究可追溯到1962年,黄伟光等[6]从重楼中分离出甾体皂苷成分。此后,国内外学者研究报道,包括甾体皂苷类、胆甾烷醇类、C21甾体化合物、植物甾醇类、昆虫变态激素、三萜类化合物、黄酮类化合物以及其他类化学成分。本文总结了从1962年到2015年从该属植物中提取分离出的211个化合物(表 2)。
|
|
表 2 重楼属植物中的化学成分 Table 2 Chemical constituents of plants in Paris L. |
2.1 甾体皂苷
甾体皂苷是一类由螺甾烷类化合物与糖结合而成的甾体苷类,是重楼属植物的主要化学成分,目前在12种该属植物中有研究报道。按螺甾烷结构中C-25的构型和F环的环合状态,可分为螺甾烷醇型(spirostanol)、异螺甾烷醇型(isosprirostanol)、呋甾烷醇型(furostanol)和变形螺甾烷醇型(pseudo-spirostand),4种类型在重楼属植物中均存在。
2.1.1 异螺甾烷醇型重楼属植物含有77个异螺甾烷醇型化合物(1~77,图 1),它们为该属植物主要的活性物质基础。苷元多为薯蓣皂苷元、偏诺皂苷元,一般在5(6)双键,3β、7β、17β位有羟基取代。糖部分有D-葡萄糖、L-鼠李糖、L-阿拉伯糖,还有少量的D-木糖和L-夫糖。糖基与苷元C3-OH成苷,少数与C1-OH、C21-OH、C23-OH、C26-OH、C27-OH成苷。主要有重楼皂苷Ⅰ(Pa,7)、重楼皂苷Ⅱ(Pb,7)、重楼皂苷Ⅵ(Tb,27)、重楼皂苷Ⅶ(Tg,24)、重楼皂苷H(25)、重楼皂苷Ⅲ(8)、纤细皂苷(11)、重楼皂苷C(2)、diosgenin-3-O-Rha (1→3) [Ara (1→4)]-Glc(3)等活性成分。近些年,研究者从该属植物中分离出一些结构比较新颖的化合物。Kang等[49]从四叶重楼中分离提取出含有25(26)或25(27)双键结构的3个新甾体皂苷parisyunnanoside I~G(47、72、73),具有抗人急性淋巴细胞白血病细胞CCRF的作用。Wu等[35]从滇重楼中分离出含有C-5和C-8位环二氧结构的甾体皂苷pariposides A~D(68~71),具有抗人类鼻咽癌肿瘤细胞(CNE)的作用。

|
图 1 重楼属植物中异螺甾烷醇型化合物结构 Fig.1 Structures of isosprirostanol in plants of ParisL. |
2.1.2 螺甾烷醇型
从滇重楼、七叶一枝花、宽叶重楼、北重楼中提取分离出9个螺甾烷醇型化合物(78~86,图 2)。
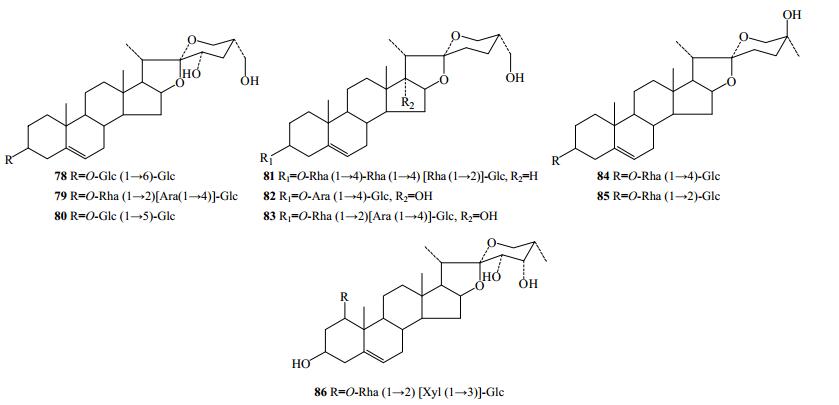
|
图 2 重楼属植物中螺甾烷醇型化合物结构 Fig.2 Structures of sprirostanol in plants of Paris L. |
2.1.3 呋甾烷醇型
重楼属植物共分离出17个呋甾烷醇型化合物(87~103,图 3),为F环开环的甾体皂苷,一般无抗菌、细胞毒等生物活性。苷元除在C3-OH位成苷外,C26-OH也与葡萄糖成苷。
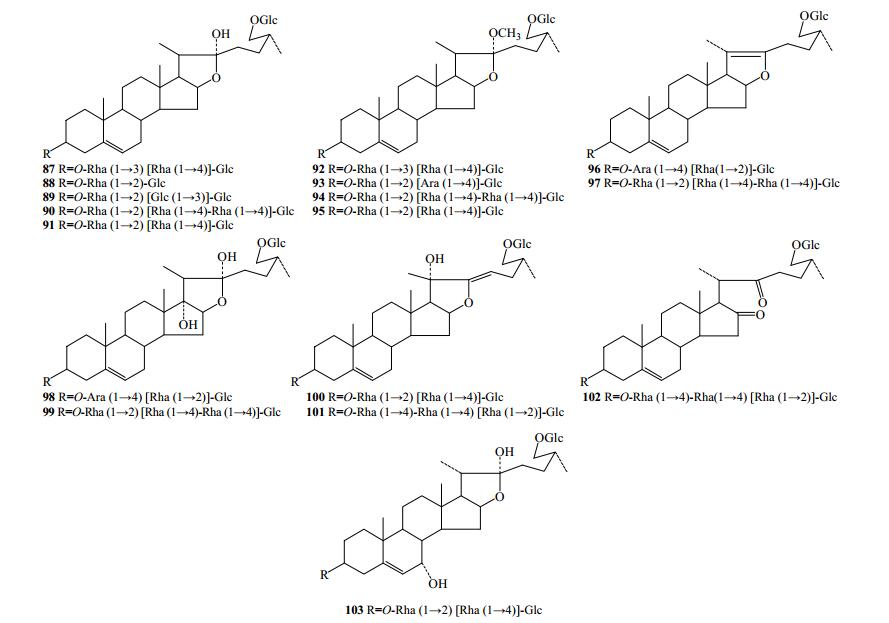
|
图 3 重楼属植物中呋甾烷醇型化合物结构 Fig.3 Structures of furostanol in plants of paris L. |
2.1.4 变型螺甾烷醇型
重楼属植物中共含有13个变型螺甾烷醇型甾体皂苷(104~116,图 4),苷元与糖主要在C3-OH和C26-OH成苷。Qin等[52]从滇重楼的茎叶中分离出chonglousides SL-9~SL-15(106~109、113~115)、abutiloside L(112)、nuatigenin-3-O-Rha (1→2)-Glc(116)等化合物,其中化合物112、116具有强烈的抗肿瘤细胞HepG2和HEK293的作用。

|
图 4 重楼属植物中变型螺甾烷醇型化合物结构 Fig.4 Structures of pseudo-spirostanol in plants of Paris L. |
2.2 胆甾烷醇类
研究报道重楼属植物共分离得到6个胆甾烷类化合物(117~122),主要在C3-OH和C26-OH位成苷(图 5)。化合物parispolyside E(117)、parispseudoside A~D(118、119、121、122)、parisyunnanoside F(120)具有诱导血小板凝集的作用[36],它们存在于长药隔重楼、滇重楼和北重楼中。
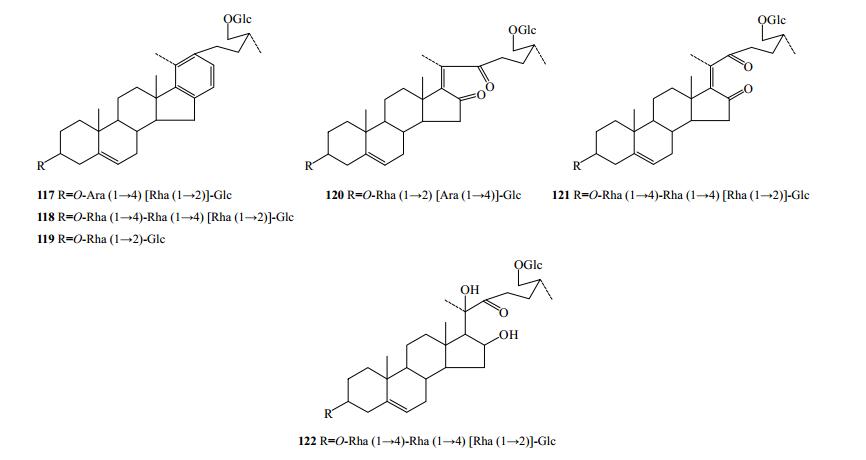
|
图 5 重楼属植物中胆甾烷醇型化合物结构 Fig.5 Structures of cholestanol in plants of Paris L. |
2.3 C21甾体化合物
重楼属植物中分离出的C21甾体化合物共9个(123~131,图 6),其中129、130具有较强的抗菌作用[61]。

|
图 6 重楼属植物中C21甾体化合物结构 Fig.6 Structures of C21-steroides in plants of Paris L. |
2.4 植物甾醇类
重楼属植物中含有的植物甾醇类化合物有8个(132~139,图 7),主要有萝卜苷(132)、β-谷甾醇(133)、pariposide F(134)、豆甾醇(136)、pariposide E(137)、α-菠甾醇(138)等,132和133在多个种中均存在。
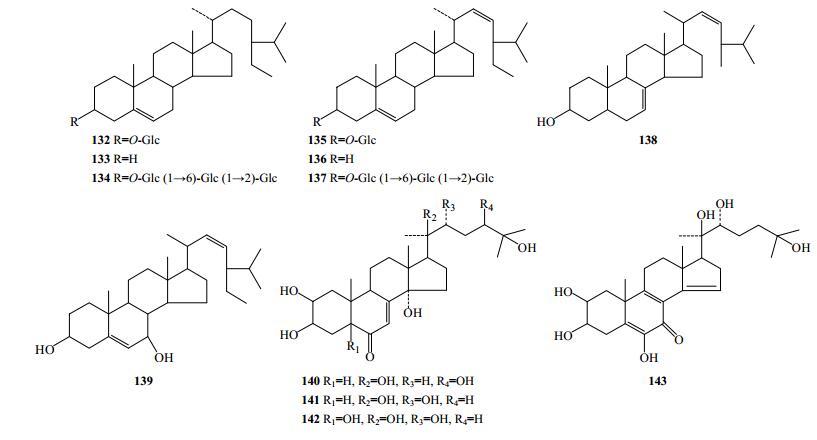
|
图 7 重楼属植物中植物甾醇和昆虫变态样激素类化合物结构 Fig.7 Structures of phytosterols and insect moulting hormones in plants of Paris L. |
2.5 昆虫变态激素
重楼属植物主要含有β-蜕皮素(140)、β-蜕皮甾酮(141)、5-羟基蜕皮甾酮(142)和calonysterone(143)4个昆虫变态激素类化合物(图 7),其中140存在于滇重楼、北重楼、毛重楼、长药隔重楼等多个种中。
2.6 五环三萜类化合物从滇重楼、毛重楼和金线重楼中分离出22个五环三萜类化合物(144~165,图 8)。除化合物159和160为羽扇豆烷(lupane)型,其他均为齐墩果烷(oleanane)型。
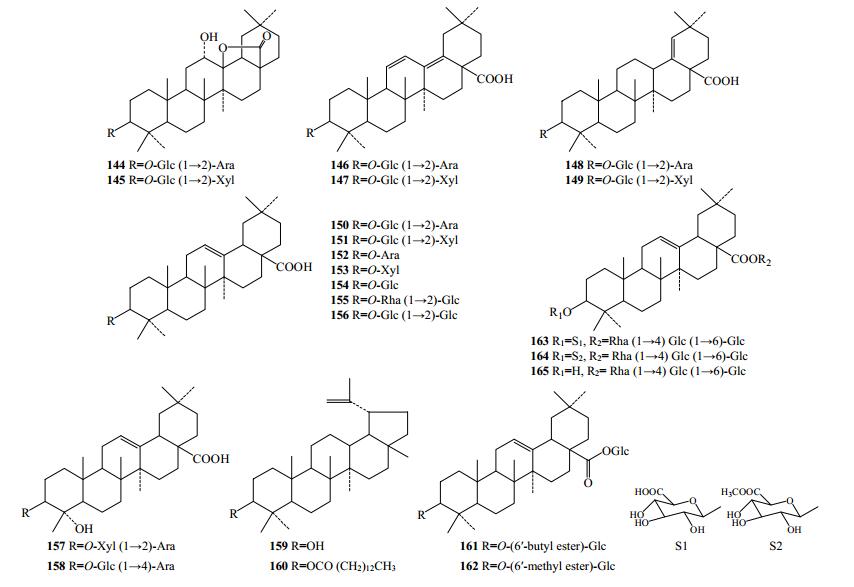
|
图 8 重楼属植物中五环三萜类化合物结构 Fig.8 Structures of pentacyclic triterpenoid in plants of Paris L. |
2.7 黄酮类化合物
黄酮类成分是该属植物中的脂溶性成分,多数具有生物活性。目前,提取分离的黄酮类化学成分有22个(166~187,图 9),广泛存在于五指莲、滇重楼和四叶重楼中,毛重楼和长药隔重楼中也含有该类成分。其主要结构类型是黄酮醇类,苷元有山柰酚、槲皮素和异鼠李亭,且在C1-OH位与糖基成苷。此外还有黄酮类、双黄酮类和查耳酮类。
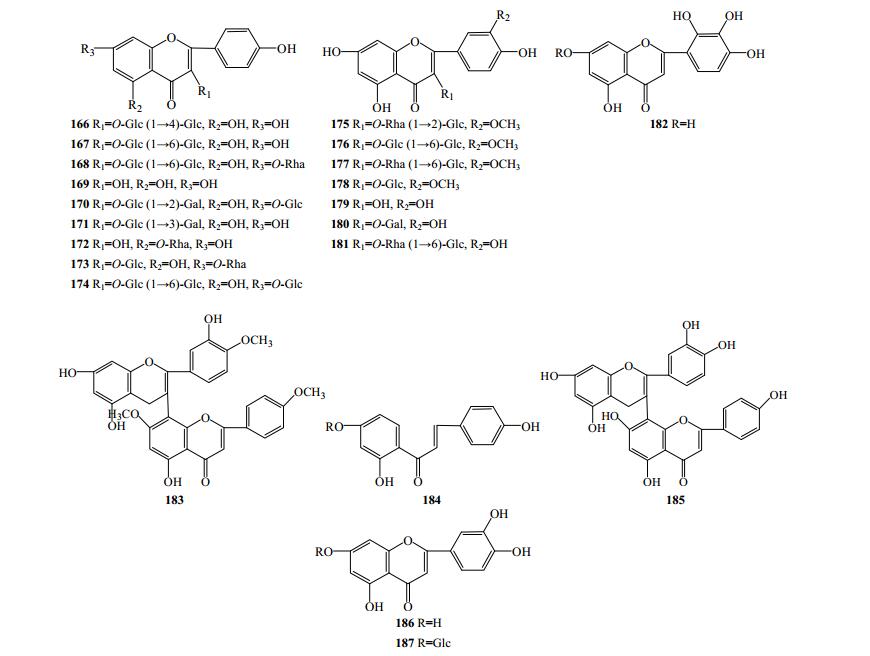
|
图 9 重楼属植物中黄酮类化合物结构 Fig.9 Structures of flavonoids in plants of Paris L. |
2.8 其他类化合物
除上述成分外,重楼属植物还含有脂肪酸类、苯丙素类、糖类、生物碱类以及醌类化合物,如parispolyside F~G(194、195)2个苯丙素类成分,heptasaccharide(196)、octasaccharide(197)等糖类化合物,十六烷酸(189)、十七碳烯酸甘油三酯(190)、glyceryl-α-mono-palmitate(203)、棕榈酸(204)等脂肪酸类成分,2-phenylethyl-Glc(209)、没食子酸(210)、vanillin(211)等芳香族化合物,flazin(205)和dibutyl phthalate(201)分别为生物碱类和蒽醌类成分(图 10)。
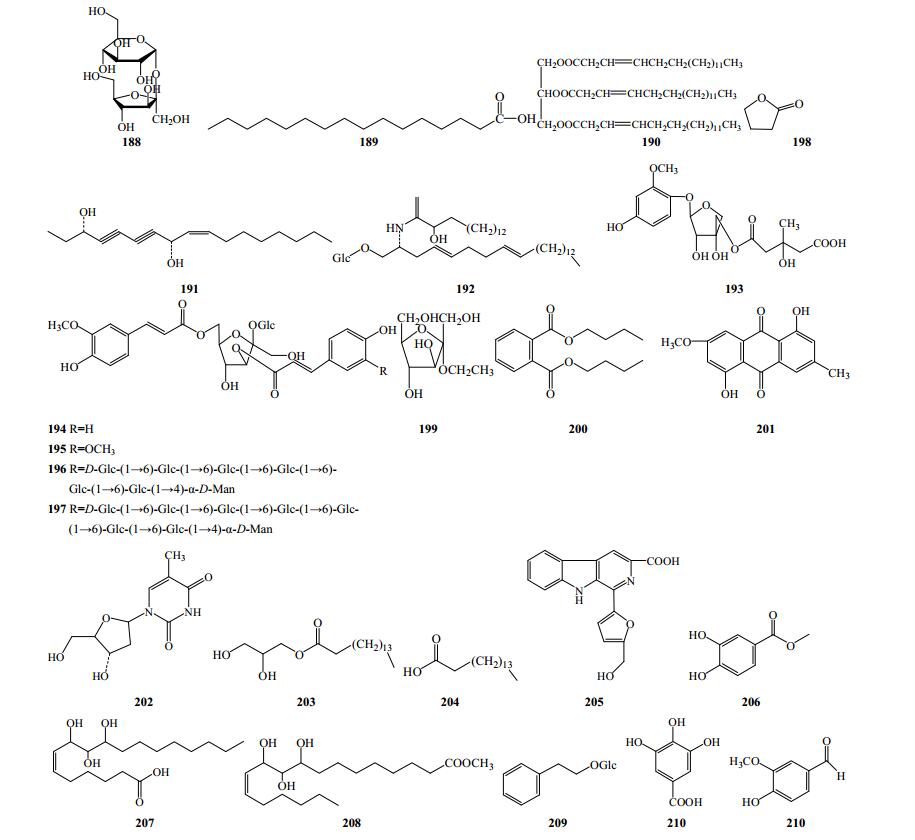
|
图 10 重楼属植物中其他类化合物结构 Fig.10 Structures of other constituents in plants of Paris L. |
3 药理活性
重楼属植物药理作用主要有抗肿瘤、抗菌、抗心肌缺血、抗氧化、免疫调节、止血、驱虫以及其他药理活性。
3.1 抗肿瘤现代药理研究表明,重楼属植物可用于鼻咽癌、肺癌、胃癌、肝癌、乳腺癌、子宫肌瘤、白血病等疾病的治疗,其抑制肿瘤细胞的机制可能与调节细胞凋亡相关蛋白的表达、改变与肿瘤细胞生长的相关蛋白活性、抑制肿瘤细胞生长周期及其内皮细胞的迁移和毛细血管形成等有关。
3.1.1 提取物国内外学者从提取物抗肿瘤药理活性及其作用机制等方面进行研究。Cheng等[71]利用蛋白质分析技术研究重楼总皂苷抑制肝癌细胞HepG2的作用,用基质辅助激光解吸电离时间质谱(MALDI-TOF-MS)对15个缩氨酸蛋白质进行分析鉴定,发现6个表达上调和6个表达下调的蛋白质,说明这些蛋白质与肿瘤细胞的形成、生长和繁殖有密切联系。此外,重楼总皂苷还可诱导肿瘤细胞凋亡、影响基质金属蛋白酶抑制剂(TIMP-2)和基质金属蛋白酶(MMP-2和MMP-9)的表达,抑制实验小鼠肺转移瘤的生长[72]。贾科等[73]研究重楼总皂苷对胃癌细胞株MGC-803生长的抑制作用,结果表明重楼总皂苷可显著抑制MGC-803细胞生长,并呈时间-剂量依赖关系,可阻滞细胞于S期,诱导细胞凋亡率的升高,其机制可能与下调EphA2和survivin的表达以及促进caspase-3的表达有关。
3.1.2 单体化合物近年来,重楼皂苷Ⅰ、Ⅱ、Ⅵ、Ⅶ、H,纤细薯蓣皂苷等活性单体抗肿瘤作用的研究逐渐增多,主要是从活性化合物的分离提取和药理作用机制2方面进行。Wu等[63]研究滇重楼根茎中的三萜皂苷类成分,发现3β-ol-oleane-12-en-28-oic acid-3-O-Glc (1→2)-Ara(150)、3β-ol-oleane-12-en-28-oic acid-3-O-Glc (1→2)-Xyl(151)、3β-ol-oleane-12-en-28-oic acid-3-O-Xyl(153)能显著抑制人鼻咽癌肿瘤细胞(CNE)增殖,其半数抑制浓度(IC50)分别为16.53、16.77、16.69 μmol/L。Kang等[49]对从多叶重楼中提取出甾体皂苷类成分进行活性测定,发现重楼皂苷Ⅰ(6)、dichotomin(90)、原纤细薯蓣皂苷(89)、pseudoproto-Pb(97)、parisyunnanoside A(98)能够抑制急性淋巴细胞白血病细胞,其IC50为0.97~85.34 μmol/L。Chan等[74]进行重楼皂苷D抑制血管内皮细胞和血管生成的研究,发现其在浓度为0.1~0.4 μmol/L可抑制人微血管内皮细胞的生长,在浓度为0.3和0.4 μmol/L时,可抑制内皮细胞的迁移和毛细血管的形成,从而抑制肿瘤细胞生长。Xiao等[75]研究重楼皂苷Ⅱ可抑制子宫肌瘤,作用机制与其提高凋亡分子的表达、减少细胞外信号调节激酶磷酸化和抗凋亡基因Bcl-2的表达有关。
3.2 抗菌作用重楼属提取物抗菌作用机制与其植物体内内生真菌及其代谢物能有效抑制人体内病原微生物有关。Deng等[45]研究了滇重楼中抗真菌皂苷,发现pennogenin-3-O-Rha (1→2) [Xly (1→5)-Ara (1→4)]-Glc(30)、重楼皂苷Ⅶ(24)、重楼皂苷H(25)对白色念珠菌的最低抑菌浓度(MIC)分别是25、50、100 μg/mL。Qin等[25]从滇重楼的茎叶中分离提取出chonglouoside SL-2(62)、chonglouoside SL-3(63)、chonglouoside SL-6(61)、重楼皂苷A(9)、重楼皂苷V(10)、薯蓣皂苷Ⅲ(8)、pennogenin-3-O-Rha (1→4)-Rha (1→4)-Glc(35)、重楼皂苷Ⅶ(24)和hypoglaucin H(123),抑制丙酸杆菌的MIC分别是62.5、62.5、3.9、16.5、17.2、39.0、17.2、31.3和62.5 μg/mL。Xuan等[76]从滇重楼中分离出的内生真菌及其代谢物能有效抑制人体内细菌的生长。此外,重楼提取物能够治疗支原体引起的女性生殖道感染,临床疗效优于对照组曼舒林,可克服由于长期应用抗生素带来的副作用和耐药性[77]。
3.3 抗心肌缺血和抗氧化重楼提取物可抗心肌细胞局部缺血,其机制可能是重楼提取物能增加细胞内钙离子外流,降低Na+、K+和Ca2+离子通道的三磷酸腺苷酶(ATPase)活性[78]。重楼皂苷可保护H2O2造成的ECV304细胞的氧化损伤,减轻高脂血动脉内皮细胞损伤,减少内皮细胞合成和释放内毒素,从而起到防治动脉粥样硬化和高血压病的作用[79]。
3.4 免疫调节作用重楼提取物及活性成分免疫调节作用表现在激活免疫细胞、抑制免疫活性物质、杀死病毒等方面。Zhang等[80]研究从多叶重楼中分离提取的具有免疫激活作用的薯蓣皂苷,发现重楼皂苷Ⅱ(7)、重楼皂苷V(10)和薯蓣皂苷元(1)能够激活小鼠巨噬细胞RAW264.7,诱导细胞发生“呼吸爆发”和产生氮氧化合物,从而起到免疫调节的作用。周满红等[81]研究表明重楼总皂苷对热灭活大肠杆菌诱导大鼠腹腔巨噬细胞分泌肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)具有显著的抑制作用。重楼95%醇提物可促进免疫活性物质IL-6释放,杀灭病毒EV71和CVB3,抑制病毒的复制,达到免疫调节的目的[82]。
3.5 止血作用重楼提取物及其活性成分止血作用与血小板聚集和血管收缩有关。Sun等[36]研究北重楼地上部分的甾体皂苷止血作用,结果表明分离提取的重楼皂苷Ⅶ在质量浓度为300 μg/mL时,血小板凝聚率达到62%。丛悦等[83]研究重楼皂苷H(25)诱导血小板聚集效应,可能机制是诱导血小板聚集依赖于血小板激活后ADP的释放和血栓烷素A2(TXA2)的生成。罗刚等[84]研究重楼皂苷C(2)的止血机制可能在于促进内源性凝血系统功能,诱导血管收缩。
3.6 驱虫作用从多叶重楼提取的重楼皂苷C、I、V(2、6、10)及其水解产物能杀死利什曼虫,其IC50为1.59~83.72μg/mL[48]。Wang等[85]研究发现重楼皂苷Ⅰ(6)和薯蓣皂苷Ⅲ(8)可有效抗指环虫,其半数效应浓度(EC50)分别为0.44和0.70 mg/L。
3.7 其他作用重楼属植物除具有以上药理作用外,还具有抗生育和镇痛等作用。沈放等[86]研究重楼皂苷化合物体外抗生育功效,发现偏诺皂苷和薯蓣皂苷具有抑制精子活力和精子成活率的显著功效,为高活性抗生育物质,尤以薯蓣皂苷为主要活性物质。重楼皂苷对完全福氏佐剂所致的关节炎大鼠急性吗啡镇痛耐受的作用研究表明重楼皂苷可阻断急性吗啡镇痛耐受的形成[87]。
4 结语近年来,随着国内外市场对重楼药材的需求增加,药用资源大幅减少,部分野生种濒临灭绝,解决资源匮乏问题迫在眉睫。本文总结了重楼属植物的分类、化学成分和药理作用,为后续研究提供依据。
传统中药重楼药用部位为根茎,近年来,国内外学者对其非药用部位进行了研究,发现一些具有生物活性的化学成分。例如,Qin等[25]从滇重楼的茎和叶中分离提取出6个新化合物chonglouosides SL-1~SL-6(52、60~64),这些化合物具有良好的抗菌作用。中药废弃物资源化,保护生态环境,促进中药产业的健康发展,解决工业化发展障碍,已成为中医药可持续发展的关键问题[88-89]。中药资源的创新开发,应从多方面进行,非药用部位利用、天然产物的生物转化、单体化合物的结构修饰等,需要更深入的研究。
目前,我国药材质量标准的检测成分为重楼皂苷Ⅰ、Ⅱ、Ⅵ、Ⅶ(6、7、27、24)。本文总结发现重楼属植物的化学成分多达211个,除指标成分外,其他成分也表现出多种药理作用,结合中药功效多成分、多靶点的特点,仅凭几种化学成分难以反映中药的多种功效主治。因此,建立一套符合中医药理论体系的质量标准,完善药材的质量评价,保证临床用药安全有效,有待进一步探讨。
| [1] | 李恒. 重楼属植物[M]. 北京: 科学出版社, 1998 . |
| [2] | 李时珍.本草纲目[M].刘恒如, 刘山永校注.北京:华夏出版社, 2013. |
| [3] | 兰茂.滇南本草[M].于乃义, 丁兰馥, 胡月英, 等整理.云南:云南科技出版社, 2000. |
| [4] | 中国药典[S].一部. 2015. |
| [5] | Wei J C, Gao W Y, Yan X D, et al. Chemical constituents of plants from the genus paris[J]. Chem Biodiv , 2014, 11 (9) :1277–1297. DOI:10.1002/cbdv.v11.9 |
| [6] | 黄伟光, 周俊. 重楼的甾体皂素配基成分研究[J]. 云南医学杂志 , 1962 (1) :64–65. |
| [7] | 黄伟光. 滇产植物的皂素成分研究Ⅲ.重楼属植物的皂甙及皂甙元[J]. 药学学报 , 1965, 1 (10) :657–661. |
| [8] | 黄贤校, 高文远, 赵万顺, 等. 五指莲重楼的黄酮和甾体类化学成分研究[J]. 中国中药杂志 , 2010, 35 (22) :2994–2998. |
| [9] | 赵志勇, 高文远, 黄贤校, 等. 长药隔重楼化学成分研究[J]. 中草药 , 2011, 42 (10) :1917–1920. |
| [10] | Wang Y, Gao W, Li X, et al. Chemical constituents from the rhizome of Paris bashanensis and their cytotoxic activity[J]. Lat Am J Pharm , 2013, 32 (2) :232–238. |
| [11] | 刘潇潇, 王磊, 隆颖, 等. 毛重楼的化学成分研究[J]. 中国中药杂志 , 2014, 39 (16) :3107–3111. |
| [12] | 陈昌祥, 周俊. 滇产植物皂素成分的研究V.滇重楼的甾体皂甙和β-蜕皮激素[J]. 云南植物研究 , 1981, 3 (1) :89–93. |
| [13] | Singh B S, Thakur R S, Schulten H R. Spirostanol saponins from paris polyphylla, structures of polyphyllin C, D, E and F[J]. Phytochemistry , 1982, 21 (12) :2925–2929. |
| [14] | 陈昌祥, 周俊. 五指莲重楼的甾体皂甙(2)[J]. 云南植物研究 , 1987, 9 (2) :239–245. |
| [15] | Mimaki Y, Kuroda M, Obata Y, et al. Steroidal saponins from the rhizomes of Paris polyphylla var. chinensis and their cytotoxic activity on HL-60 cells[J]. Nat Prod Lett , 2000, 14 (5) :357–364. DOI:10.1080/10575630008043768 |
| [16] | 黄芸, 崔力剑, 王强, 等. 南重楼Paris vietnamensis活性物质的分离与鉴定[J]. 药学学报 , 2006, 41 (4) :361–364. |
| [17] | 尹鸿翔, 薛丹, 白楠, 等. 狭叶重楼的主要甾体皂苷类化学成分的分离及鉴定[J]. 四川大学学报:医学版 , 2008, 39 (3) :485–488. |
| [18] | 黄贤校, 高文远, 满淑丽, 等. 北重楼的化学成分研究[J]. 中国中药杂志 , 2009, 34 (14) :1812–1815. |
| [19] | 黄贤校, 高文远, 谷克仁, 等. 毛重楼的化学成分研究[J]. 中草药 , 2009, 40 (9) :1366–1369. |
| [20] | 张志港, 赵德, 邓君. 巴山重楼化学成分研究[J]. 中药材 , 2011, 34 (3) :389–392. |
| [21] | 赵万顺, 高文远, 黄贤校, 等. 球药隔重楼的化学成分研究(英文)[J]. 天然产物研究与开发 , 2011, 23 (6) :1017–1020. |
| [22] | 崔艳.中药七叶一枝花某些活性成分化学结构研究[D].北京:北京化工大学, 2006. |
| [23] | 黄贤校.毛重楼、北重楼和五指莲的化学成分及其抗肿瘤活性研究[D].天津:天津大学, 2010. |
| [24] | 黄贤校, 高文远, 赵志勇, 等. 五指莲重楼的化学成分研究[J]. 中草药 , 2010, 41 (12) :1963–1966. |
| [25] | Qin X J, Sun D J, Ni W, et al. Steroidal saponins with antimicrobial activity from stems and leaves of Paris polyphylla var. yunnanensis[J]. Steroids , 2012, 77 (12) :1242–1248. DOI:10.1016/j.steroids.2012.07.007 |
| [26] | Nohara T, Yabuta H, Suenobu M, et al. Steroid glycosides in paris polyphylla SM[J]. Chem Pharm Bull , 1973, 21 (6) :1240–1247. DOI:10.1248/cpb.21.1240 |
| [27] | 刘海, 黄芸, 张婷, 等. 金线重楼的化学成分[J]. 中国药科大学学报 , 2006, 37 (5) :409–412. |
| [28] | 陈昌祥, 周俊. 滇产植物皂素成分的研究-X.五指莲的两个新甾体皂甙(1)[J]. 云南植物研究 , 1984, 6 (1) :111–117. |
| [29] | 康利平, 马百平, 张洁, 等. 重楼中甾体皂苷的分离与结构鉴定[J]. 中国药物化学杂志 , 2005, 15 (1) :25–30. |
| [30] | 刘显波, 张浩, 雍正平, 等. 长药隔重楼中甾体皂苷成分的分离与结构鉴定[J]. 华西药学杂志 , 2010, 25 (5) :508–511. |
| [31] | Wen F Y, Yin H X, Chen C, et al. Chemical characteristics of saponins from Paris fargesii var. brevipetala and cytotoxic activity of its main ingredient, paris saponin H[J]. Fitoterapia , 2012, 83 (4) :627–635. DOI:10.1016/j.fitote.2012.01.003 |
| [32] | Wang Y, Gao W Y, Liu X Q, et al. Anti-tumor constituents from Paris polyphylla[J]. Asian J Tradit Med , 2005, 1 (1) :7–10. |
| [33] | Zhao Y, Kang L P, Liu Y X, et al. Steroidal saponins from the rhizome of Paris polyphylla and their cytotoxic activities[J]. Planta Med , 2009, 75 (4) :356–363. DOI:10.1055/s-0028-1088380 |
| [34] | Wu X, Wang L, Wang H, et al. Steroidal saponins from Paris polyphylla var. yunnanensis[J]. Phytochemistry , 2012, 81 (3) :133–143. |
| [35] | Wu X, Wang L, Wang G C, et al. New steroidal saponins and sterol glycosides from Paris polyphylla var. yunnanensis[J]. Planta Med , 2012, 78 (15) :1667–1675. DOI:10.1055/s-00000058 |
| [36] | Sun C L, Ni W, Yan H, et al. Steroidal saponins with induced platelet aggregation activity from the aerial parts of Paris verticillata[J]. Steroids , 2014, 92 :90–95. DOI:10.1016/j.steroids.2014.09.008 |
| [37] | Nohara T, Ito Y, Seike H, et al. Study on the constituents of Paris quadriforia L.[J]. Chem Pharm Bull , 1982, 30 (5) :1851–1856. DOI:10.1248/cpb.30.1851 |
| [38] | Miyamura M, Nakano K, Nohara T, et al. Steroid saponins from Paris polyphylla SM-supplement[J]. Chem Pharm Bull , 1982, 30 (2) :712–718. DOI:10.1248/cpb.30.712 |
| [39] | 陈昌祥, 连红兵, 李运昌, 等. 滇重楼种子中的甾体皂甙[J]. 云南植物研究 , 1990, 12 (4) :452–452. |
| [40] | 陈昌祥, 周俊, 张玉童, 等. 滇产植物皂素成分的研究-Ⅷ.禄劝花叶重楼的甾体皂甙[J]. 云南植物研究 , 1983, 5 (2) :219–223. |
| [41] | Xiao C M, Huang J, Zhong X M, et al. Two new homo-aro-cholestane glycosides and a new cholestane glycoside from the roots and rhizomes of Paris polyphylla var. pseudothibetica[J]. Helv Chim Acta , 2009, 92 (12) :2587–2595. DOI:10.1002/(ISSN)1522-2675 |
| [42] | 华栋, 刘杨, 王夏茵, 等. 宽叶重楼化学成分研究[J]. 中南药学 , 2015, 13 (1) :43–46. |
| [43] | 陈昌样, 周俊, 张玉童, 等. 滇重楼地上部分的甾体皂甙[J]. 云南植物研究 , 1990, 12 (3) :323–329. |
| [44] | 肖草茂, 黄静, 谭小燕, 等. 长药隔重楼的化学成分研究[J]. 华西药学杂志 , 2009, 24 (1) :7–9. |
| [45] | Deng D W, Lauren D R, Cooney J M, et al. Antifungal saponins from Paris polyphylla Smith[J]. Planta Med , 2008, 74 (11) :1397–1402. DOI:10.1055/s-2008-1081345 |
| [46] | 陈昌祥, 周俊. 滇重楼的两个新甾体皂甙元[J]. 云南植物研究 , 1992, 14 (1) :111–113. |
| [47] | 陈昌祥. 滇重楼地上部分的两个微量皂甙[J]. 云南植物研究 , 1995, 17 (2) :215–220. |
| [48] | 徐暾海, 毛晓霞, 徐雅娟, 等. 云南重楼中的新甾体皂苷[J]. 高等学校化学学报 , 2007, 28 (12) :2303–2306. |
| [49] | Kang L P, Liu Y X, Eichhorn T, et al. Polyhydroxylated steroidal glycosides from Paris polyphylla[J]. J Nat Prod , 2012, 75 (6) :1201–1205. DOI:10.1021/np300045g |
| [50] | Zhao Y, Kang L P, Liu Y X, et al. Three new steroidal saponins from the rhizome of Paris polyphylla[J]. Magn Reson Chem , 2007, 45 (9) :739–744. DOI:10.1002/(ISSN)1097-458X |
| [51] | Jenett-Siems K, Krause N, Siems K, et al. Chemical composition and biological activity of Paris quadrifolia L[J]. Z Naturforsch C , 2012, 67 (11/12) :565–570. |
| [52] | Qin X J, Yu M Y, Ni W, et al. Steroidal saponins from stems and leaves of Paris polyphylla var. yunnanensis[J]. Phytochemistry , 2016, 121 :20–29. DOI:10.1016/j.phytochem.2015.10.008 |
| [53] | 刘海, 张婷, 陈筱清, 等. 云南重楼的甾体皂苷类成分[J]. 中国天然药物 , 2006, 4 (4) :264–267. |
| [54] | Wen Y S, Ni W, Qin X J, et al. Steroidal saponins with cytotoxic activity from the rhizomes of Paris polyphylla var. yunnanensis[J]. Phytochem Lett , 2015, 12 :31–34. DOI:10.1016/j.phytol.2015.02.011 |
| [55] | Singh S B, Thakur R S, Schulten H R. Furostanol saponins from Paris polyphylla:structures of polyphyllin G and H[J]. Phytochemistry , 1982, 21 (8) :2079–2082. DOI:10.1016/0031-9422(82)83047-1 |
| [56] | Matsuda H, Pongpiriyadacha Y, Morikawa T, et al. Protective effects of steroid saponins from Paris polyphylla var. yunnanensis on ethanol-or indomethacininduced gastric mucosal lesions in rats:structural requirement for activity and mode of action[J]. Bioorg Med Chem Lett , 2003, 13 (6) :1101–1106. DOI:10.1016/S0960-894X(03)00052-0 |
| [57] | 陈昌祥, 张玉童, 周俊. 滇重楼地上部分的配糖体[J]. 云南植物研究 , 1995, 17 (4) :473–478. |
| [58] | 黄芸, 王强, 叶文才, 等. 华重楼中一个新的类胆甾烷皂苷[J]. 中国天然药物 , 2005, 3 (3) :138–140. |
| [59] | 刘杨, 华栋, 王夏茵, 等. 金线重楼的皂苷成分研究[J]. 中南药学 , 2015, 13 (1) :40–43. |
| [60] | Huang Y, Cui L, Zhan W, et al. Separation and identification of steroidal compounds with cytotoxic activity against human gastric cancer cell lines in vitro from the rhizomes of Paris polyphylla var. chinensis[J]. Chem Nat Compd , 2007, 43 (6) :672–677. DOI:10.1007/s10600-007-0225-8 |
| [61] | Qin X J, Chen C X, Ni W, et al. C22-steroidal lactone glycosides from stems and leaves of Paris polyphylla var. yunnanensis[J]. Fitoterapia , 2013, 84 :248–251. DOI:10.1016/j.fitote.2012.12.007 |
| [62] | 王羽, 高文远, 袁理春, 等. 滇重楼的化学成分研究[J]. 中草药 , 2007, 38 (1) :17–20. |
| [63] | Wu X, Wang L, Wang G C, et al. Triterpenoid saponins from rhizomes of Paris polyphylla var. yunnanensis[J]. Carbohyd Res , 2013, 368 :1–7. DOI:10.1016/j.carres.2012.11.027 |
| [64] | 张玉波, 吴霞, 李药兰, 等. 云南重楼的化学成分[J]. 暨南大学学报:自然科学与医学版 , 2014, 35 (1) :66–72. |
| [65] | Wang Y, Gao W Y, Zhang T J, et al. A novel phenylpropanoid glycosides and a new derivation of phenolic glycoside from Paris polyphylla var. yunnanensis[J]. Chin Chem Lett , 2007, 18 (5) :548–550. DOI:10.1016/j.cclet.2007.03.011 |
| [66] | 王羽.滇重楼抗肿瘤活性成分的研究[D].天津:天津大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10056-2008183472.htm |
| [67] | Yan L L, Gao W Y, Zhang Y J, et al. A new phenylpropanoid glycosides from Paris polyphylla var. yunnanensis[J]. Fitoterapia , 2008, 79 (4) :306–307. DOI:10.1016/j.fitote.2007.11.029 |
| [68] | Zhou L G, Yang C Z, Li J Q, et al. Heptasaccharide and octasaccharide isolated from Paris polyphylla var. yunnanensis and their plant growth-regulatory activity[J]. Plant Sci , 2003, 3 :571–575. |
| [69] | Devkota K P, Khan M T H, Ranjit R, et al. Tyrosinase inhibitory and antileishmanial constituents from the rhizomes of Paris polyphylla[J]. Nat Prod Res , 2007, 21 (4) :321–327. DOI:10.1080/14786410701192777 |
| [70] | 吴霞, 张玉波, 王国才, 等. 云南重楼中2个脂肪酸的分离鉴定及其抑制鼻咽癌细胞活性研究[J]. 广东药学院学报 , 2014, 30 (6) :698–701. |
| [71] | Cheng Z X, Liu B R, Qian X P, et al. Proteomic analysis of antitumor effects by Rhizoma Paridis total saponin treatment in HepG2 cells[J]. J Ethnopharmacol , 2008, 120 (2) :129–137. DOI:10.1016/j.jep.2008.07.030 |
| [72] | Man S, Gao W, Zhang Y, et al. Antitumor and antimetastatic activities of Rhizoma Paridis saponins[J]. Steroids , 2009, 74 (13/14) :1051–1056. |
| [73] | 贾科, 吴庆琛, 张成. 重楼总皂苷对胃癌细胞株MGC-803生长的抑制作用[J]. 中国生化药物杂志 , 2011, 32 (4) :284–286. |
| [74] | Chan J Y W, Koon J C M, Liu X, et al. Polyphyllin D, a steroidal saponin from Paris polyphylla, inhibits endothelial cell functions in vitro and angiogenesis in zebrafish embryos in vivo[J]. J Ethnopharmacol , 2011, 137 (1) :64–69. DOI:10.1016/j.jep.2011.04.021 |
| [75] | Xiao X, Zou J, Minh Bui-Nguyen T, et al. Paris saponin Ⅱ of Rhizoma Paridis-A novel inducer of apoptosis in human ovarian cancer cells[J]. Biosci Trends , 2012, 6 (4) :201–211. DOI:10.5582/bst. |
| [76] | Xuan Q, Bao F K, Pan H M, et al. Isolating fungal endophyte from Paris polyphylla Smith var. yunnanensis and identifying their antibacterial ability[J]. Afr J Microbiol Res , 2010, 4 (10) :1001–1004. |
| [77] | 姜淑梅.重楼治疗解脲支原体引起女性下生殖道感染的临床研究[D].长春:长春中医药大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10199-2010255208.htm |
| [78] | Li P, Fu J, Wang J, et al. Extract of Paris polyphylla simth protects cardiomyocytes from anoxia-reoxia injury through inhibition of calcium overload[J]. Chin J Integr Med , 2011, 17 (4) :283–289. DOI:10.1007/s11655-011-0704-4 |
| [79] | 高琳琳, 李福荣, 康莉, 等. 蚤休醇提物对H2O2损伤的ECV304细胞的细胞周期与凋亡的影响[J]. 中国药理学通报 , 2008, 24 (11) :1513–1517. |
| [80] | Zhang X F, Cui Y, Huang J J, et al. Immuno-stimulating properties of diosgenyl saponins isolated from Paris polyphylla[J]. Bioorg Med Chem Lett , 2007, 17 (9) :2408–2413. DOI:10.1016/j.bmcl.2007.02.039 |
| [81] | 周满红, 于红, 贺华经, 等. 重楼总皂苷对热灭活大肠杆菌诱导大鼠腹腔巨噬细胞分泌TNF-α及IL-1β的影响[J]. 四川中医 , 2008, 26 (4) :24–26. |
| [82] | Wang Y C, Yi T Y, Lin K H. In vitro activity of Paris polyphylla smith against enterovirus 71 and coxsackievirus B3 and its immune modulation[J]. Am J Chin Med , 2011, 39 (6) :1219–1234. DOI:10.1142/S0192415X11009512 |
| [83] | 丛悦, 柳晓兰, 余祖胤, 等. 重楼皂苷H诱导血小板聚集效应及其机制的研究[J]. 解放军医学杂志 , 2010, 35 (12) :1429–1432. |
| [84] | 罗刚, 吴廷楷, 周永禄, 等. 重楼皂甙C止血作用的初步研究[J]. 中药药理与临床 , 1988, 4 (2) :37–40. |
| [85] | Wang G X, Han J, Zhao L W, et al. Anthelmintic activity of steroidal saponins from Paris polyphylla[J]. Phytomedicine , 2010, 17 (14) :1102–1105. DOI:10.1016/j.phymed.2010.04.012 |
| [86] | 沈放, 杨黎江, 彭永芳, 等. 重楼皂苷类化合物体外抗生育功效研究[J]. 中国现代应用药学 , 2010, 27 (11) :961–964. |
| [87] | 徐海伟, 黎海蒂, 王建, 等. 重楼皂甙翻转急性吗啡耐受关节炎大鼠下丘脑内ACTH水平的下降(英文)[J]. 中国神经科学杂志 , 2001, 17 (3) :259–264. |
| [88] | 段金廒, 张伯礼, 宿树兰, 等. 基于循环经济理论的中药资源循环利用策略与模式探讨[J]. 中草药 , 2015, 46 (12) :1715–1722. |
| [89] | 袁盼, 申俊龙, 申远. 基于生态效应的中药废弃物资源化的模式与技术选择[J]. 中草药 , 2015, 46 (19) :2829–2833. |
 2016, Vol. 47
2016, Vol. 47


