蒺藜Tribuli Fructus别称白蒺藜、旁通、屈人,是蒺藜科(Zygophyllaceae)蒺藜属Tribulus L.植物蒺藜Tribulus terrestris L.的干燥成熟果实,全国各地均有分布,生于沙地、荒地、山坡附近[1]。蒺藜全草均可入药,含有皂苷、黄酮、生物碱等多种化合物,其中甾体皂苷和黄酮类成分是其主要化学成分,且以甾体皂苷类成分研究最多,具有改善心脑血管功能、调节血糖、抗衰老、调血脂、改善性功能和抑制癌细胞活性等药理作用[2-4]。近几年研究表明,蒺藜主要黄酮类成分是其主要皂苷类成分的1.5倍,并且在心脑血管方面同样具有显著作用,具有增加血流量、抗缺氧、阻滞血小板凝集的作用,其功效和潜在药用价值不可忽视[5]。
我国是世界上使用和出口中药材最多的国家,且80%以上来源于药用植物,随着中药现代化发展,药用植物资源日渐匮乏,因此利用细胞全能性,使植物外植体在离体无菌条件下通过人工调节实现脱分化和再生已成为解决药用植物资源可持续发展的重要途径。药用植物有效成分主要是次生代谢产物,利用组织培养技术培养愈伤组织可直接生产活性成分,这不仅具有短周期、快速生长、不受自然条件影响的特点,还以降低生产成本、提高次生代谢产物产量及利于自动化的独特优势和经济、社会效益成为研究热点[6]。
本研究利用组织培养技术,通过对蒺藜不同外植体、培养基种类、培养温度和激素配比等实验,确定诱导蒺藜愈伤组织的最佳条件;并通过不同影响因子筛选出蒺藜愈伤组织增殖最佳培养配方,首次建立了稳定的蒺藜愈伤组织培养体系,为蒺藜组织扩大培养和次生代谢产物的工业化生产提供科学参考,同时也为药用植物蒺藜生物工程技术的进一步研究奠定基础。
1 材料与方法 1.1 材料样品采自长春中医药大学药植园,经吉林农业大学中药材学院杨世海教授鉴定为蒺藜Tribulus terrestris L.种子。槲皮素(批号150302)、山柰酚(批号150414)、异鼠李素(批号141119)对照品购自成都普菲德生物技术有限公司,质量分数均大于98.50%。
2 方法 2.1 蒺藜无菌苗培养挑选当年成熟饱满干燥的蒺藜种子,去刺温水浸泡2 h,不去种皮采用的消毒剂为75%乙醇浸泡30 s,无菌水清洗3次,每次2 min,0.1%升汞浸泡不同时间,无菌水再次清洗5次,每次2 min,洗净后无菌纸吸干表面水分,接种在不添加任何激素的1/2 MS固体培养基中,置于光照强度2 000 lx、光照条件12 h/d、湿度60%的25 ℃恒温培养箱中培养,7 d后按以下公式统计种子污染率和发芽率。去种皮处理,只采用75%乙醇进行消毒处理,方法同上。萌发获得的蒺藜无菌幼苗,作为诱导愈伤组织的外植体备用。

|
在超净工作台中取蒺藜叶片剪成约0.5 cm×0.5 cm大小的叶盘,根和茎段切成长约0.5 cm的小段,用镊子轻轻接种于添加不同激素配比的1/2 MS、MS、B5、N6、White 5种诱导培养基中,并置于不同温度的恒温培养箱中暗培养,10 d后统计愈伤组织诱导率,筛选出诱导蒺藜愈伤组织的最佳培养基配方。将生长状态优良、黄绿色且有光泽的愈伤组织接种到上述筛选所得的新鲜培养基中,进行蒺藜愈伤组织的继代培养,为蒺藜愈伤组织体系的建立打下坚实基础。蒺藜愈伤组织诱导率按以下公式计算。

|
利用培养药用植物愈伤组织直接获取次生代谢产物,其目标产物的积累不仅受温度、光照、pH值、碳源等因素的影响,而且植物生长调节剂的种类及质量浓度配比亦会显著影响次生代谢产物的积累量[6]。以MS为基础培养基,选取3种碳源蔗糖、麦芽糖、葡萄糖,加入一定质量浓度2,4-D、6-BA、玉米素(ZT)以不同光照条件培养,测定其增长量并确定适宜培养基配方。利用正交助手软件设计正交试验,25 mL三角瓶中加入一定质量的小块愈伤组织,25 ℃下恒温培养。通过筛选培养基pH值、碳源、光照条件、生长周期及不同浓度植物生长调节剂配比,优化蒺藜愈伤组织培养条件;每个影响因子设3组平行试验,建立最佳蒺藜愈伤组织培养体系。以上述培养条件为基础,测定蒺藜愈伤组织中总黄酮醇苷量,并与蒺藜种子和全草中总黄酮醇苷量相对比。
2.4总黄酮醇苷的测定参考相关文献方法[7-10],采用HPLC法测定蒺藜种子、全草和愈伤组织中总黄酮醇苷的量。
3 结果与分析 3.1 蒺藜种子灭菌方法用75%乙醇30 s和0.1%升汞对未去种皮的蒺藜种子灭菌,仅用75%乙醇对去种皮种子灭菌,接种到不添加任何激素的1/2 MS固体培养基中,7 d后,结果见表 1。
|
|
表 1 不同处理方法对种子发芽率和污染率的影响 Table 1 Effects of different treatments on germination and contamination rates of seeds |
通过实验数据统计发现,不去种皮直接用灭菌剂处理接种后,发芽率低,污染率高。原因是蒺藜种皮较硬并且表面凹凸不平,使用灭菌剂很难达到理想的灭菌效果。剥去种皮后,只经过无菌水处理,发芽率即可达到100.0%,但是污染率较高;分别用75%乙醇处理5、10、15、20 s发现,随着处理时间的增加,污染率降低,但发芽率也相应降低;在处理10 s时发芽率可达到100.0%,污染率为10.4%,而处理15 s时发芽率为96.3%,污染率可降至5.4%,但根据实际的无菌苗生长情况,处理10 s的苗子叶正常,而处理15 s萌发正常,子叶展开时间较慢,所以选择75%乙醇处理10 s。综上分析,获得蒺藜无菌苗的种子处理条件为剥去种皮后用75%乙醇处理10 s,无菌水洗净后吸干表面水分,接种在不添加任何激素的1/2 MS固体培养基中。
3.2 蒺藜愈伤组织的诱导 3.2.1 外植体的筛选理论上单个细胞或任意一部分外植体在适宜条件下均可利用细胞全能性进行脱分化而形成愈伤组织。但实践中不同外植体诱导愈伤组织的能力及其条件要求却有显著差异,这与外植体供体的遗传因素、基因型和外植体本身生理生化状态密切相关。选取蒺藜无菌苗叶片、茎段和根为外植体,接种到MS+2,4-D 0.5 mg/L+6-BA 0.1 mg/L固体培养基中,25 ℃恒温暗培养,10 d后统计愈伤组织诱导率,结果见图 1。

|
图 1 不同外植体对蒺藜愈伤组织诱导的影响 Fig.1 Effect of different explants on callus induction of T. terrestris |
据图 1可知,不同外植体对蒺藜愈伤组织诱导有明显差异。茎段和叶片诱导率分别为93.13%和54.17%,茎段和叶片诱导率显著大于主根,主根无分化能力,因此茎段为诱导蒺藜愈伤组织的最适宜外植体材料,以下实验均以茎段为外植体。
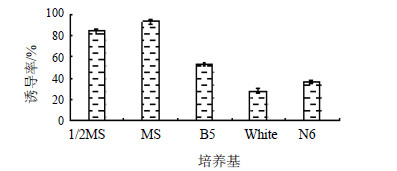
3.2.2 培养基种类筛选培养基种类对愈伤组织诱导也有较大影响,以蒺藜无菌苗茎段为外植体,配制含有3%蔗糖和0.6%琼脂粉的1/2 MS、MS、B5、N6、White 5种诱导培养基,并选择2,4-D 0.5 mg/L+6-BA 0.1 mg/L激素质量浓度配比,每瓶接入5个外植体,每组样品设3组平行试验,25 ℃恒温暗培养,10 d统计愈伤组织诱导率,见图 2。
|
图 2 不同培养基对蒺藜茎段愈伤组织诱导的影响 Fig.2 Effect of different media on callus induction of T. terrestris stems |
据图 2可知,培养基种类对蒺藜茎段愈伤组织诱导率有明显作用,诱导率从大到小依次为MS>1/2 MS>B5>N6>White,MS和1/2 MS培养基愈伤组织诱导率显著高于其他3种培养基,诱导率分别为93.11%和84.00%;B5培养基对愈伤组织诱导率也明显好于N6培养基;White培养基中诱导率最低,为28.22%,比N6培养基低了8.22%。因此本实验中选用的诱导培养基为MS(3%蔗糖+0.6%琼脂粉)。
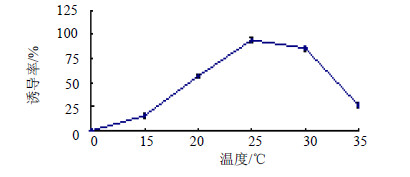
3.2.3 培养温度的影响培养温度可影响植物细胞生长、分化,从而影响愈伤组织诱导率及次生代谢产物积累[11]。将蒺藜外植体接种于MS+2,4-D 0.5 mg/L+6-BA 0.1 mg/L的弱酸性(pH 6.5)固体培养基中,置于15、20、25、30、35 ℃恒温培养箱中暗培养,10 d统计愈伤组织诱导率,结果见图 3。
|
图 3 不同温度对蒺藜愈伤组织诱导的影响 Fig.3 Effect of different temperature on callus induction of T. terrestris |
由图 3可知,蒺藜愈伤组织诱导率随温度升高呈先升高后下降的趋势,温度在0~15 ℃,外植体细胞分裂比较缓慢,愈伤组织数量较少,诱导率在15.50%;在15~25 ℃时,诱导率急剧增加,并在25 ℃时诱导率达到94.50%;25~30 ℃时,愈伤组织进入分裂末期,诱导率缓慢降低至85.83%;30~35 ℃时,愈伤组织诱导率急剧下降,并且颜色由黄绿色变为褐色,直至死亡。所以25 ℃为诱导蒺藜愈伤组织的最佳培养温度。
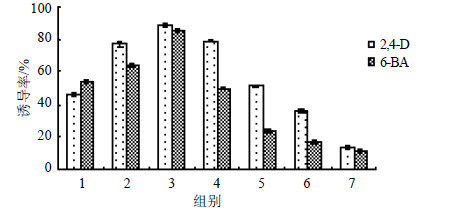
3.2.4 植物生长调节剂筛选诱导愈伤组织成败关键在于植物生长调节剂,用于诱导愈伤组织形成的生长素一般为2,4-D、NAA、IAA;常用细胞分裂素为KT、6-BA、ZT。一般情况下,单独使用2,4-D就可以诱导愈伤组织,但配合细胞分裂素使用,二者的联合作用更有利于愈伤组织发生及次级代谢产物积累[12]。本实验采用单因素和双因素对比方法进行蒺藜愈伤组织诱导的激素及配比筛选。将外植体接种在只添加0.20、0.40、0.60、0.80、1.00、1.20、1.40 mg/L 2,4-D或0.05、0.10、0.15、0.20、0.25、0.30、0.35 mg/L 6-BA及二者联合使用的MS固体培养基中,25 ℃恒温暗培养,10 d统计愈伤组织诱导率,由软件正交助手设计双因素正交试验,数据由SPSS 17.0分析,结果见图 4和表 2。
|
图 4 不同质量浓度2,4-D和6-BA对蒺藜愈伤组织诱导的影响 Fig.4 Effect of 2,4-D and 6-BA on callus induction of T. terrestris |
|
|
表 2 不同激素配比对愈伤组织诱导的影响 (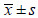 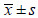 |
由图 4可知,2,4-D和6-BA单独使用均可发生蒺藜愈伤组织的形成,2,4-D对蒺藜愈伤组织的诱导起主要作用。在一定范围内,愈伤组织诱导率均随二者质量浓度增加而升高,当超出最适质量浓度时诱导率不断降低,甚至出现严重褐化现象。因此筛选出2,4-D和6-BA最佳质量浓度为0.60 mg/L和0.15 mg/L,诱导率分别为88.89%和85.17%。
根据上述结果可知,2,4-D和6-BA联合使用更能刺激愈伤组织形成,且最佳质量浓度较单独使用时发生了微小变化,这可能是由于细胞分裂素与植物生长素发生了联合作用,影响了植物细胞的分裂,有助于外植体脱分化形成愈伤组织。第5组激素配比为2,4-D 0.5 mg/L+6-BA 0.10 mg/L,蒺藜愈伤组织诱导率最高,达到93.15%,且比单独使用2,4-D和6-BA时诱导率高,颜色呈浅黄绿色且有光泽,质地均匀,适合进一步的继代培养,是蒺藜愈伤组织诱导的最佳激素配比。由SPSS 17.0分析,第5组与其他组别间存在极显著差异(P<0.01)。
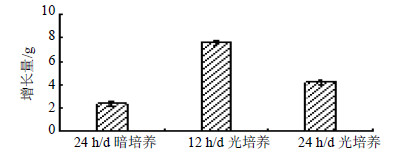
3.3 外蒺藜愈伤组织培养体系建立及优化 3.3.1 光照条件对愈伤组织增长量影响光照条件虽不是诱导愈伤组织的必要条件,但却影响愈伤组织分化和次生代谢产物合成,即光照条件不同,愈伤组织生长分化和次生代谢产物的累积就不同。据研究,延长光照时间或增加光照强度有利于黄酮类物质的量提高[13-14]。在超净工作台中,将蒺藜愈伤组织切成约0.3 cm3的小块,接种于MS+2,4-D 1.0 mg/L+6-BA 0.2 mg/L+ZT 1.0 mg/L固体培养基中,温度25 ℃,pH值6.2,设置24 h/d暗培养、24 h/d光培养、12 h/d光培养3种光照条件,每瓶接种0.5 g,各样品设3组平行,35 d后测定愈伤组织增长量,见图 5。
|
图 5 不同光照时间对蒺藜愈伤组织增长量的影响 Fig.5 Effects of different light time on growth of T. terrestris callus |
如图 5所示,由于24 h/d暗培养过程中无光照来源,细胞无法供给愈伤组织生长所需,愈伤组织增长量很少,并且严重褐化甚至死亡;24 h/d光培养较暗培养增长量有明显提高且褐化现象减轻,但可能由于光照时间的延长,培养环境中温度升高抑制细胞分化,愈伤组织增长量仍未达到理想状态;12 h/d光培养时,愈伤组织生长状态最佳,呈淡黄绿色,颗粒均匀疏松,增长量达到7.63 g。
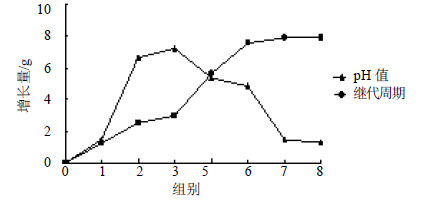
3.3.2 继代周期和pH值对愈伤组织增长量影响接种0.5 g愈伤组织接种于MS+2,4-D 1.0 mg/L+6-BA 0.2 mg/L+ZT 1.0 mg/L的固体培养基中,每7、14、21、28、35、42、49 d继代1次,编号1~7组;设置pH值5.2、5.8、6.2、6.8、7.2、7.8、8.2,编号1~7组,25 ℃、12 h/d光培养,研究不同继代周期和pH值对愈伤组织增长量的影响,结果见图 6。由图 6可知,继代周期在7~21 d时,愈伤组织增长缓慢且呈浅黄色,少量褐化;21~35 d愈伤组织增长迅速,愈伤组织浅黄绿色且有光泽,35 d时增长量达到7.59 g;35~49 d,虽然愈伤组织仍在增殖,但增长量很小,仅比35 d时增长了0.4 g左右,并且愈伤组织逐渐褐化,变为黄褐色,最后停止生长,故35 d为愈伤组织增殖的最佳继代周期。愈伤组织增长量随pH值增加而先增大后减小,pH值小于5.2或大于7.8都不利于愈伤组织的生长发育,愈伤组织严重褐化;pH值为6.2时,增长量最大为7.25 g,愈伤组织呈淡黄色,固弱酸性培养基适于蒺藜愈伤组织增殖。
|
图 6 不同继代周期和pH值对蒺藜愈伤组织增长量的影响 Fig.6 Effects of different culture periods and pH values on growth of T. terrestris callus |
3.3.3 增殖培养基激素筛选
据以上优化所得培养条件,配制固体MS培养基,选择2,4-D、6-BA、ZT利用软件正交助手进行正交试验,以MS0(未添加激素MS培养基)为对照,每瓶接种量0.5 g,每组设3组平行,温度25 ℃,pH值6.2,12 h/d光培养,35 d后测定愈伤组织增长量,结果见表 3。
|
|
表 3 不同激素配比对蒺藜愈伤组织增长量的影响 (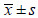 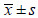 |
结果显示,不同种类激素及其配比,对蒺藜愈伤组织增殖存在明显差异。由SPSS 17.0分析所得,对照组增长量极小,愈伤组织深红褐色;第1组较第2、3组愈伤组织增长量小,且颜色呈现深黄褐色,这说明在6-BA质量浓度相同时2,4-D和ZT对愈伤组织增长起促进作用;第2组和第3组间差异不显著;第4组和第6组不存在显著性差异;第5组除与第8组差异非极显著外,与其余处理间均差异极显著(P<0.01),增长量最高为7.26 g,愈伤组织淡黄绿色且生长状态最佳,是蒺藜愈伤组织增殖优化阶段最佳激素处理组合。
3.4 蒺藜总黄酮醇苷测定 3.4.1 总黄酮醇苷标准曲线绘制精密吸取槲皮素、异鼠李素、山柰酚混合对照品溶液2、4、6、8、10 μL进样,以峰面积(Y)对进样量(X)进行线性回归,得回归方程分别为槲皮素:Y=90 175 X-18 616,R2=0.999 7;山柰酚:Y=64 537 X-18 616,R2=0.999 7;异鼠李素:Y=27 108 X-3 537.7,R2=0.999 7。
结果表明,槲皮素在0.040 0~10.000 0 μg,峰面积与进样量有良好的线性关系;山柰酚在0.020 8~10.400 0 μg,峰面积与进样量有良好的线性关系;异鼠李素在0.010 2~10.200 0 μg,峰面积与进样量有良好的线性关系。
3.4.2 总黄酮醇苷的测定取蒺藜种子、蒺藜全草、蒺藜愈伤组织为供试品材料,参考文献方法[7-10],进行槲皮素、山柰酚、异鼠李素混合对照品溶液和供试品溶液的制备,测定蒺藜种子、全草及愈伤组织3种样品中总黄酮醇苷的量。

|
结果表明,蒺藜种子、全草及愈伤组织中总黄酮醇苷量分别为1.46%、2.01%、5.22%。其中,蒺藜全草中总黄酮醇苷量是蒺藜种子的总黄酮醇苷量1.37倍,蒺藜愈伤组织培养体系中的总黄酮醇苷量最高,是蒺藜种子的总黄酮醇苷量3.57倍,这说明利用外植体进行蒺藜愈伤组织培养可直接产生更多的次生代谢产物,稳定高效的蒺藜愈伤组织培养体系为蒺藜总黄酮类活性成分的工业化生产奠定了基础。
4 讨论植物组织培养中由于种子表面凹凸不平,常以联合使用灭菌剂的方法诱导无菌苗,但蒺藜种子表面有刺、种皮坚硬,不利于种子灭菌及萌发;另外升汞对种子损伤较大易残留,又损害人体、污染环境[15],因此本实验将蒺藜种子去种皮后用75%乙醇处理10 s于1/2 MS培养基上培养长势优良的无菌苗。愈伤组织生长状态、色泽及诱导率受外植体类型影响,因此选择正确的外植体部位对愈伤诱导极其重要,另外,外植体污染是制约组织培养发展的首要难题,且外植体自身带菌是影响污染的主要因素[16]。本实验选取无菌苗茎段、叶片、主根为诱导愈伤组织的外植体,阻隔了空气、风尘、雨雪等污染源与外植体接触,有效地避免外植体自身带菌情况。实验结果表明,茎段是诱导蒺藜愈伤组织最佳外植体。这与叶下珠研究结果一致[17],与夏枯草研究结果相反[18],可能是由于植物基因型不同造成外植体分化能力存在差异性。主根无分化能力。这不同于蒺藜科植物四合木研究结果[19],可能是因为供体所处环境基质与激素种类配比不适宜诱导蒺藜主根的愈伤组织,同时证明了即使同一科属植物同一外植体在相同介质中也会体现出不同的实验结果。
除营养物质以外,为了诱导愈伤组织及其增殖,通常还有必要在培养基中加入一种或一种以上生长调节物质,促进外源激素传递遗传物质进行脱分化并配合内源激素共同影响植物生长发育[16]。本实验单独添加2,4-D和6-BA的培养基上均能诱导出愈伤组织,且2,4-D对外植体茎段诱导有较大影响,推测是因2,4-D与外植体受伤细胞所释放的损伤激素更能促进蒺藜细胞分裂。实验结果表明,2,4-D与6-BA配合使用更能强烈地刺激愈伤组织形成,诱导率达93.15%且愈伤组织质地疏松、有光泽、活性强适于增殖培养,这一实验结果与石云平等[20]诱导白芨愈伤组织结果一致,因此蒺藜愈伤组织最佳诱导培养基配方确定为MS+2,4-D 0.5 mg/L+6-BA 0.1 mg/L。ZT是从高等植物中分离得到的首个天然细胞分裂素,是类似于激动素的细胞分裂促进物质,可促进愈伤组织生长,与细胞生长素协同使用效果更佳。本实验研究表明,将长势优良的愈伤组织以每瓶0.5 g接种于MS+2,4-D 1.0 mg/L+6-BA 0.2 mg/L+ZT 1.0 mg/L固体增殖培养基中,愈伤组织增长量达7.26 g,颜色淡黄绿色,适于愈伤组织分化根和芽。
人工培养条件下植物离体细胞均具有“母体”细胞全能性,即细胞合成有效成分能力[21]。本实验为促使蒺藜愈伤组织更快速地高产目标产物,从诱导无菌苗及选取适宜外植体开始,设定了影响有效产物积累量的最适环境条件,以合适的营养基质配比奠定愈伤组织增殖生长基础,有效地添加植物生长调节剂,诱导所得蒺藜愈伤组织中所含总黄酮醇苷量高于蒺藜全草及其药典入药部位蒺藜种子中的总黄酮醇苷量。这与其他植物愈伤中有效成分量高于供体的研究结果相似[22],并说明在适宜人工培养条件下,愈伤组织能更低成本、短周期、安全经济的积累有效药用成分,具良好的医药工业产业化生产前景。
本实验建立了稳定的蒺藜茎段愈伤组织培养体系,为获得大批量总黄酮醇苷提供理论依据,为蒺藜稳定高产悬浮培养体系奠定了良好基础,同时也为蒺藜愈伤组织再生和进一步遗传转化体系建立提供了科学依据。
| [1] | 中国科学院中国植物志编委会. 中国植物志[M]. 北京 : 科学出版社 , 1998 . |
| [2] | 范冰舵. 蒺藜地上部分化学成分研究[D]. 北京:北京中医药大学, 2014. |
| [3] | 杨莉, 王国栋, 韩梅. 蒺藜的活性成分积累和动态分布的研究[J]. 中草药, 2013,44 (9) :1186–1189. |
| [4] | 桂海水. 蒺藜茎叶化学成分及含量测定研究[D]. 北京:北京中医药大学, 2013. |
| [5] | 高文远. 中药生物工程 [M]. 上海 : 上海科学技术出版社 , 2014 . |
| [6] | 房慧勇, 朱虹, 丁海麦, 等. 影响愈伤组织中次生代谢产物含量的因素研究进展[J]. 中国中药杂志, 2014,39 (15) :2846–2850. |
| [7] | 张静赟, 李炜, 杨飞快, 等. 蒺藜全草中甾体皂苷和总黄酮醇苷量的研究[J]. 中草药, 2010,41 (5) :829–832. |
| [8] | 李炜, 杨飞快, 朱清风, 等. 心脑舒通胶囊中总黄酮醇苷的含量测定[J]. 西北药学杂志, 2009,24 (1) :10–11. |
| [9] | 杨飞快, 张曼玲, 权秀丽, 等. HPLC对蒺藜不同药用部位总黄酮醇苷含量的测定和比较[J]. 现代中医药, 2014,34 (4) :61–64. |
| [10] | 中国药典[S]. 一部. 2015. |
| [11] | 钱丽华, 毛碧增. 光温条件对三叶青愈伤生长及黄酮积累的影响[J]. 浙江农业学报, 2013 (9) :1098–1099. |
| [12] | 王慧英. 影响植物愈伤组织形成的因素研究[J]. 聊城大学学报, 2010,23 (2) :51–53. |
| [13] | Mathur A, Kumar A M, Gangwar A, et al. Anthocyanin production in a callus line of Panax sikkimensis Ban[J]. In Vitro Cell Dev Biol-Plant, 2010, 46 (1) :13–21 . |
| [14] | Shinde A N, Malpathak N, Fulzele D P. Determination of isoflavone content and antioxidant activity in Psoralea corylifolia L. callus cultures[[J]. Food Chem, 2010, 118 (1) :128–132 . |
| [15] | 刘群, 肖波, 李天祥, 等. 紫花鄂北贝母愈伤组织诱导及总生物碱的测定[J]. 中草药, 2015,46 (12) :1836–1839. |
| [16] | 龙华, 胡雪峰, 黄衡宇. 獐牙菜的组织培养[J]. 中草药, 2009,40 (3) :462–466. |
| [17] | 常莉, 薛建平. 叶下珠愈伤组织的诱导与培养[J]. 中草药, 2008,39 (11) :1723–1726. |
| [18] | 盛玮, 常莉, 张爱民, 等. 夏枯草愈伤组织诱导和植株再生技术的研究[J]. 中国中药杂志, 2010,35 (7) :830–833. |
| [19] | 何丽君. 濒危植物四合木组织培养的研究[J]. 内蒙古草业, 2001 (2) :7–10. |
| [20] | 石云平, 赵志国, 唐凤銮, 等. 白芨愈伤组织诱导、增殖与分化研究[J]. 中草药, 2013,44 (3) :349–353. |
| [21] | 徐中东. 植物组织培养生产药物研究进展[J]. 生物学杂志, 2001,18 (6) :13–14. |
| [22] | 姚晓, 步达, 陈建伟, 等. 南方红豆杉愈伤组织培养及其紫杉烷二萜类成分的分析[J]. 中草药, 2014,45 (18) :2696–2702. |
 2016, Vol. 47
2016, Vol. 47


