2. 哈尔滨商业大学药学院, 黑龙江哈尔滨 150076
2. College of Pharmacy, Harbin University of Commerce, Harbin 150076, China
西洋参为五加科(Araliaceae)植物西洋参Panax quinquefolius L. 的干燥根,味苦,性凉,具有补肺阴、清火、养胃生津之功效[1],主产于美国、加拿大、法国,目前我国已引种栽培多年[2],形成了吉林、黑龙江、北京、山东、陕西等栽培区,皂苷类成分是西洋参中主要活性物质,现代药理学研究表明皂苷类成分具有抗动脉粥样硬化、抗疲劳、增强记忆和提高学习能力的作用。综合文献报道发现,人参皂苷Rgl、Re、Ro、F11、Rh1、Rg2、Rbl、Rc、Rb2、Rb3、Rd为西洋参质量分数较高的11种皂苷,其质量分数占总皂苷的90%以上[3]。皂苷类成分为紫外检测器的末端吸收成分,易出现基线漂移现象。利用HPLC-ELSD检测西洋参中人参皂苷类成分有一定报道[4, 5, 6],但UPLC方法明显减少了分析时间及溶剂使用量,提高了灵敏度和分离效率[7]。本实验对不同产地28个批次的西洋参中10种人参皂苷的量进行测定比较,并建立一种同时测定西洋参中人参皂苷Rgl、Re、Ro、F11、Rg2、Rbl、Rc、Rb2、Rb3、Rd的UPLC法,进一步采用相似度分析(SA)、聚类分析(HCA)及主成分分析(PCA)等化学计量学方法对指纹图谱的测定结果进行了深入分析。结果显示,不同产地西洋参的皂苷类成分存在差异,UPLC-UV-ELSD指纹图谱结合化学计量学分析可用于不同产地西洋参药材的质量评价。
1 仪器与材料 1.1 仪器美国Waters Acquity TM UPLC色谱系统,包括二元超高压泵系统(ACQUITY UPLC Binary Solvent Manager)、样品管理器(ACQUITY UPLC Sample Manager)、TUV检测器(ACQUITY UPLC TUV Detector)、ELSD 2420蒸发光散射检测器(ACQUITY UPLC ELS Detector)、柱温箱以及WATERS Empower 2色谱工作站、电子分析天平(梅特勒-托利多仪器上海有限公司,AL204-IC)、高功率数控超声波清洗器(昆山市超声仪器有限公司,KQ-400KDE)、高纯氮气发生器(北京京高气体有限公司)。
1.2 材料色谱乙腈(美国,MERCK公司),色谱甲醇(美国,Fisher公司),超纯水(法国,Milli-Q Advantage A10超纯水系统);人参皂苷Rg1(批号110703-201128)、人参皂苷Re(批号110754-201324)、人参皂苷Rb1(批号110704-201223)、人参皂苷Rc(批号11021-14-0)、人参皂苷Rb2(批号111715-201203)、人参皂苷Rb3(批号11686-201203)、人参皂苷Rd(批号111818-201302)对照品购自中国食品药品检定研究院;对照品人参皂苷Ro(批号131102)、人参皂苷F11(批号131125)、人参皂苷Rg2(批号131115)购自成都普菲德生物技术有限公司,质量分数大于98%。
西洋参样品材料于2012年9月至2013年10月间根据主产区及近年新增种植区,直接从产地采集共计28批西洋参药材(表 1),经中国医学科学院药用植物研究所谢彩香教授鉴定,所有生药样品凭证标本存于中国医学科学院药用植物研究所标本室。
| 表 1 西洋参药材样品来源 Table 1 Origins of P. quinquefolius roots |
色谱柱ACQUITY UPLC® BEH C18(50 mm×2.1 mm,1.7 μm),柱温30 ℃。ACQ-TUV检测波长203 nm,ACQ-ELSD检测器:增益100,喷雾器为加热模式,动力级别50%,漂移管温度50 ℃,气体压力275.8 kPa(40 psi)。进样量5 μL,样品温度30 ℃。流动相为乙腈和水,梯度洗脱条件见表 2。每一进样针结束后均以弱洗(乙腈-水2∶8)600 μL、强洗(乙腈-水8∶2)200 μL清洗进样针。
| 表 2 流动相梯度洗脱条件 Table 2 Gradient elution of mobile phase |
精密称定人参皂苷Rg1、Re、Ro、F11、Rg2、Rb1、Rc、Rb2、Rb3、Rd共计10种对照品适量,置于5 mL量瓶中,用色谱纯甲醇溶解后稀释定容至刻度,摇匀,作为对照品溶液,2 ℃冰箱贮存备用。
2.3 供试品溶液的制备精密称取西洋参样品粉末(过四号筛)1 g,置具塞的三角瓶中,精密加入甲醇25 mL,密塞并称质量,浸泡4 h,超声提取30 min,放置至室温后,重新称质量,用甲醇补足损失的质量,滤过,取续滤液并用0.22 μm微孔滤膜滤过,滤液作为供试品溶液。
2.4 方法学考察 2.4.1 精密度试验取样品(S4)供试品溶液连续进样6次,按样品分析条件项UPLC色谱条件测定,计算各主要色谱峰的相对峰面积和保留时间。结果相对峰面积的RSD均小于5%,相对保留时间的RSD均小于0.5%,符合指纹图谱要求。
2.4.2 稳定性试验将样品(S4)供试品溶液分别在0、4、8、12、16、20、24 h进样分析,计算各主要色谱峰的相对峰面积和相对保留时间。结果相对峰面积的RSD均小于5%,相对保留时间的RSD均小于0.6%,说明西洋参样品溶液在24 h内稳定。
2.4.3 重复性试验取样品(S4)共6份,按供试品溶液制备方法制备供试品溶液,分别进行UPLC测定,计算各主要色谱峰的相对峰面积和保留时间。结果相对峰面积的RSD均小于5%,相对保留时间的RSD均小于1.5%,说明重复性良好,符合指纹图谱要求。
2.5 指纹图谱的建立及共有指纹峰的确定通过对28批样品的测定,应用“中药色谱指纹图谱特征图谱相似度评价系统(2004版)”建立西洋参药材皂苷类成分UPLC-UV-ELSD特征图谱,各主要色谱峰的出峰时间基本一致,分别确定了UV和ELSD检测条件下峰面积较大的12个峰,其中11个峰为其共有色谱峰,西洋参药材皂苷类成分UPLC-ELSD和UPLC-UV特征色谱图见图 1。在相同的色谱条件下,测定人参皂苷Rg1、Re、Ro、F11、Rg2、Rb1、Rc、Rb2、Rb3、Rd对照品混合溶液,并与样品指纹图谱中相应色谱峰进行比较,确定样品指纹图谱中的1~10号峰分别为人参皂苷Rg1、Re、Ro、F11、Rg2、Rb1、Rc、Rb2、Rb3、Rd色谱峰。
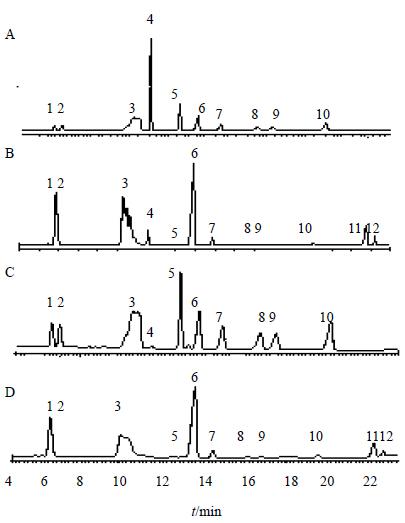 | 1-人参皂苷Rg1 2-人参皂苷Re 3-人参皂苷Ro 4-人参皂苷F11 5-人参皂苷Rg2 6-人参皂苷Rb1 7-人参皂苷Rc 8-人参皂苷Rb2 9-人参皂苷Rb3 10-人参皂苷Rd 11-未知成分1 12-未知成分2 1-ginsenoside Rg1 2-ginsenoside Re 3-ginsenoside Ro 4-ginsenoside F11 5-ginsenoside Rg2 6-ginsenoside Rb1 7-ginsenoside Rc 8-ginsenoside Rb2 9-ginsenoside Rb3 10-ginsenoside Rd 11-unknown ingredient 1 12-unknown ingredient 2图 1 UPLC-ELSD检测对照品 (A)、样品 (B) 和UPLC-UV检测对照品 (C)、样品 (D) 色谱图 Fig.1 UPLC-ELSD chromatogram of reference substances (A) and sample 25 (B), and UPLC-UV chromatogram of reference substances (C) and sample (D) |
本研究利用“中药色谱指纹图谱相似度评价系统(2004版)”对28批样品进行相似度评价,以S21批西洋参药材色谱图作为参照图谱,基于中位数法,时间窗设置为0.1 min,通过多点校正生成对照图谱(R),计算多个批次西洋参药材共有色谱峰的相似度。由相似度评价结果可知,S5~S12批次的西洋参样品相似度较差,其他批次西洋参药材的相似度为0.766~0.904,表明吉林产区西洋参药材具有多样化特点,内在质量存在着一定差异。
2.7 系统聚类分析将28批西洋参药材皂苷类成分的UPLC指纹图谱各色谱峰的峰面积相对药材称样量之比,即单位质量药材峰面积进行量化,得到的原始数据矩阵,运用“SPSS 16.0”软件对其进行系统聚类分析,采用组间联接,欧式距离平方法,聚类分析结果将28批西洋参样品分为2类,其中ELSD分析结果显示吉林地区聚为一大支,陕西、山东、美国样品聚为一小支,北京、黑龙江样品聚为一小支,并聚为一大支;UV聚类分析结果显示,陕西、北京、黑龙江聚为一大支,美国、山东、吉林聚为一大支(图 2)。
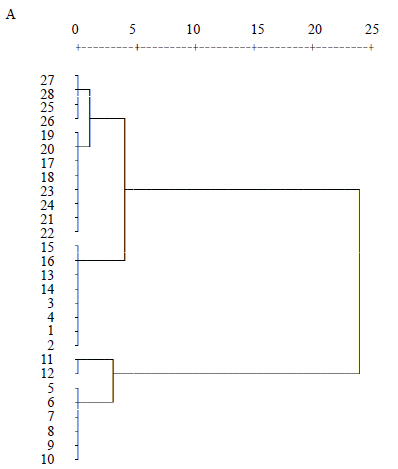 | 图 2 ELSD (A) 和UV (B) 检测皂苷类成分聚类分析图 Fig.2 Cluster analysis of ingredients saponin by ELSD (A) and UV (B) |
从UPLC-ELSD特征图谱和UPLC-UV特征图谱中选取峰面积较大的皂苷类成分(人参皂苷Rg1、Re、Ro、F11、Rg2、Rb1、Rc、Rb2、Rb3、Rd、未知1、未知2)进行主成分分析(图 3),28批西洋参样品中ELSD峰面积PCA分析载荷图结果中,第一主成分中人参皂苷Rg1、Re、Rc、F11、Rb3贡献值最大,为ELSD检测法主要特征性成分;UV峰面积PCA分析载荷图结果中,第1主成分中人参皂苷Rg1、Re、Rc、Rb2、Rb3贡献值最大,为UV检测法主要特征性成分。结合PCA载荷图及PCA散点图(图 4)结果显示,人参皂苷Rg1、Re、Rc、Rb2、Rb3的贡献值最大,北京、吉林、黑龙江地区的西洋参中Rg1、Re、Rc、Rb2、Rb3等皂苷类成分要区别于美国和山东、陕西地区的西洋参;而人参皂苷Rg2、Rb1、Rd则对美国和山东、陕西产区的贡献值大,表明美国和山东、陕西产区人参皂苷Rg2、Rb1、Rd要区别北京、吉林、黑龙江地区,正是这种皂苷成分的差异,呈现不同的品质分型。
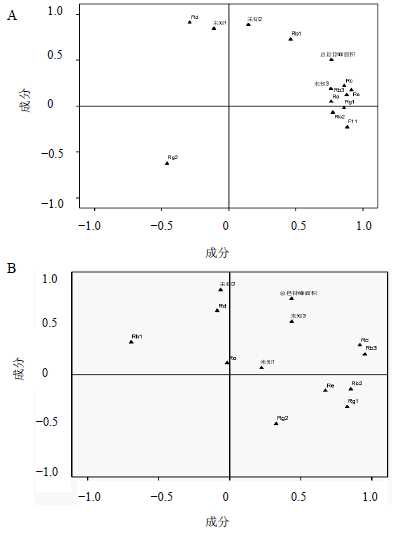 | 图 3 不同产地西洋参皂苷成分ELSD-PCA (A) 和UV-PCA (B) 载荷图 Fig.3 Loading diagram of saponins in P. quinquefolius by ELSD-PCA (A) and UV-PCA (B) |
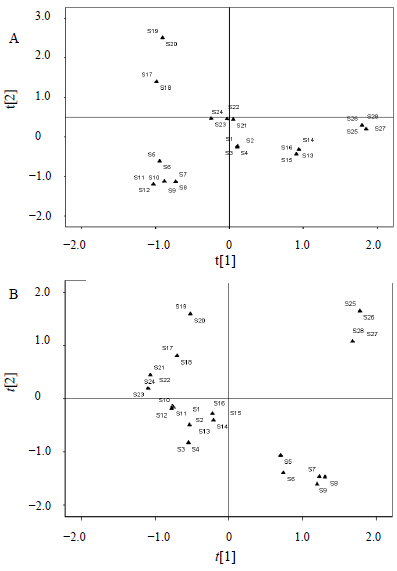 | 图 4 不同产地西洋参皂苷成分ELSD (A) 和UV (B) 散点图 Fig.4 Scatter plot of saponins in P. quinquefolius from different habitats by ELSD (A) and UV (B) |
经上述模式识别研究,选取药材质量比较稳定的24批西洋参样品建立西洋参药材皂苷类成分的标准指纹图谱(图 5),24批西洋参批号为S1~S6、S11~S28。将24批样品数据导入“中药色谱指纹图谱相似度评价系统”(2004版),以S21色谱图作为参照图谱,基于中位数法,时间窗为0.1 min,多点校正生成对照图谱(R),所得24批西洋参样品相似度均在0.90以上,符合指纹图谱要求。
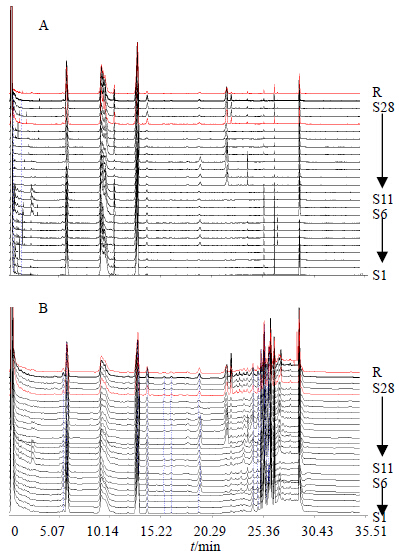 | 图 5 不同产地西洋参ELSD (A) 和UV (B) 指纹图谱 Fig.5 Fingerprints of P. quinquefolius from different habitats by ELSD (A) and UV (B) |
首次将UPLC-UV-ELSD方法应用于西洋参药材皂苷类成分的指纹图谱研究,方法学各项考察结果均符合指纹图谱研究的技术要求,可见UPLC色谱在全面控制西洋参药材的质量方面有着非常广阔的前景。
采用UV-ELSD串联检测器对西洋参药材皂苷类成分指纹图谱进行了紫外及ELSD 2种检测方法,结果显示,紫外检测器在203 nm条件下皂苷类成分整体峰形、分离度良好,且出峰数多,选择该波长作为检测波长,ELSD检测器在增益100,喷雾器为加热模式,动力级别50%,漂移管温度50 ℃,气体压力275.8 kPa(40 psi)条件下灵敏度较高。
ELSD检测器为质量通用型检测器,拟人参皂苷F11类成分无紫外吸收,可采用UPLC-ELSD法进行检测,该方法不依赖于样品的光学特性,不受官能团的影响,分离度及重复性好且结果准确,故适用于拟人参皂苷F11的测定,而紫外检测器灵敏度较好,样品人参皂苷Rg2、Rb2、Rb3由于量较低在蒸发光上检测灵敏度较差,响应值较小,用紫外进行定量测定结果较为准确,故测定10种皂苷类成分时串联使用2种检测器。紫外检测器基线易漂移,蒸发光散射检测器基线平稳但出峰不多;对2种检测器均有响应的皂苷类成分,出峰时间基本一致,蒸发光散射检测器下所得色谱峰峰面积明显高于紫外检测器。
本实验应用系统聚类分析和主成分分析2种化学计量学方法,对西洋参UPLC指纹图谱的色谱积分数据进行了模式识别的研究。聚类分析选择组间联接、欧氏距离平方法作为测度,这种聚类方法在指纹图谱研究中比较常用[8, 9, 10, 11, 12],其中北京怀柔及黑龙江样品聚为一类,山东和美国样品聚为一类,吉林地区西洋参样品多样性显著,我国引种的西洋参种子主要来自美国及加拿大的不同地区,多为天然混杂品种,非单一纯合种,种源与种质资源混杂及栽培地生态环境多样化,可能为吉林地区西洋参个体之间差异较大的原因[13]。
PCA法研究结果显示,28个批次西洋参样品中ELSD检测器所检测皂苷类成分峰面积值均较大,不同皂苷类成分结果变异度较大,故多个皂苷类成分贡献值较高,而UV检测器灵敏度及稳定性较好,对于在ELSD检测器上灵敏度较差的Rb2、Rb3类成分均有较好的响应,故在PCA散点图结果中,不同地区散点图在2种检测器的结果存在差异性。总体分析结果显示,在北京、吉林、黑龙江地区的西洋参中人参皂苷Rg1、Re、Rc、Rb2、Rb3等皂苷类成分要区别于美国、陕西、山东地区的西洋参;而美国、陕西、山东地区的西洋参中Rg2、Rb1、Rd类成分要区别北京、吉林、黑龙江地区,说明各西洋参样品之间不同产地的西洋参中存在相应的特征性成分,有待进一步深入研究。
| [1] | 王蕾,王英平,许世泉,等.西洋参化学成分及药理活性研究进展[J].特产研究, 2007(3):73-77. |
| [2] | 黄林芳,索风梅,宋经元,等.中国产西洋参品质变异及生态型划分[J].药学学报, 2013, 48(4):580-589. |
| [3] | 陈军辉.西洋参活性成分及其指纹图谱研究[D].南昌:南昌大学, 2005. |
| [4] | 王桂英. HPLC法测定西洋参中五种皂苷方法研究[J].光明中医, 2014(4):890-893. |
| [5] | 董梁,张翠英,陈士林.西洋参药材皂苷类成分HPLC-UV-ELSD特征图谱及模式识别研究[J].药学学报, 2011, 46(2):198-202. |
| [6] | 蔡艳,郭文胜. HPLC-ELSD测定西洋参中人参皂苷含量[J].陕西中医学院学报, 2009(1):64-65. |
| [7] | 段宝忠,黄林芳,陈士林. UPLC-ELSD法同时测定伊贝母中贝母辛和西贝母碱的含量[J].药学学报, 2010, 45(12):1541-1544. |
| [8] | 尤春雪,张振秋,李峰,等. HPLC波长切换技术对葛根中8种成分的测定及指纹图谱研究[J].中草药, 2013, 44(5):616-621. |
| [9] | 吴昊,田燕华,郭平干.多元统计学在参麦注射液指纹图谱中的应用[J].中成药, 2002, 24(1):3-6. |
| [10] | 郝子博,王丽莉,张铁军.落花生茎叶HPLC指纹图谱研究[J].中草药, 2012, 43(10):2050-2054. |
| [11] | 刘玉峰,杨秀伟.款冬花药材的HPLC化学成分指纹图谱研究[J].药学学报, 2009, 44(5):510-514. |
| [12] | 靳怡然,杜英峰,田婷婷,等. HPLC-PDA指纹图谱结合主成分分析评价不同产地冬凌草药材的质量[J].中草药, 2015, 46(15):2291-2295. |
| [13] | 屈新运.陕西留坝西洋参药材质量评价研究[D].西安:陕西师范大学, 2006. |
 2016, Vol. 47
2016, Vol. 47


