2. 华侨大学园艺系, 福建厦门 351021;
3. 广西壮族自治区药用植物园, 广西南宁 530023;
4. 古农堂生物科技有限公司, 福建泰宁 354400
2. Department of Horticulture, Huaqiao University, Xiamen 351021, China;
3. The Medicinal Botanical Garden of Guangxi Zhuang Autonomous Region, Nanning 530023, China;
4. Gunongtang Biological Technology Co., Ltd., Taining 354400, China
金线莲Anoectochilus roxburghii (Wall.) Lindl即花叶开唇兰,别名金蚕、金线兰等,是兰科(Orchidaceae)开唇兰属Anoectochilus Bl. 的一种多年生草本植物。金线莲是我国传统的珍贵药材和室内观叶珍品,以全草入药,其性味平、甘,具有清热凉血、祛风利湿之功效[1]。随着野生金线莲资源大量采挖,金线莲种质资源正面临着逐渐枯竭的局面。同时,金线莲生产上所用品种多为不同企业或部门的自选、自育和自留品种,不同产区之间存在着严重的“同物异名、同名异物”现象[2]。因此,摸清我国不同地区金线莲种质资源的“家底”,鉴定其相应的亲缘关系,建立金线莲种质核心资源库和规范金线莲品种选育程序,对于解决目前金线莲资源濒危状态和提高其产量和品质显得尤为必要。随机扩增多态DNA(random aplified polymorphism DNA,RAPD)的原理是设计10 bp的随机引物对基因组进行PCR扩增,通过分析PCR产物多态性来研究基因排布与外在性状表现的一门技术。RAPD分析可在没有基因组信息条件下进行,所用随机引物不受物种的限制,对DNA质量要求不高,操作简便、快捷。此外,由于RAPD引物序列较短、退火的温度较低,使RAPD还表型出易扩增、扩增位点丰富、多态性强等优点[3]。然而,RAPD标记却存在假阳性高、稳定性和重复性差等缺点,但将RAPD所产生的特异性条带转化为SCAR标记则可以克服这些缺点,兼具RAPD优点[4]。SCAR标记目前在牛膝、地黄、五味子、铁皮石斛等药用植物已经被广泛应用,虽然在金线莲中ISSR、SRAP、RAPD等标记已被广泛开发利用[4, 5, 6],但SCAR标记目前并未见报道。
本研究在20个金线莲种质资源的基础上,开发金线莲多态性RAPD标记,并将特异条带转化为相应SCAR标记,鉴定其特异性。本研究为揭示金线莲种质资源的亲缘关系和建立金线莲分子标记辅助育种体系提供了重要的基础数据[7, 8, 9, 10]。
1 材料和方法 1.1 金线莲种质资源的搜集在全国范围内广泛收集具有显著区域特点的20个金线莲Anoectochilus roxburghii (Wall.) Lindl种质资源,均由福建农林大学王建明实验师鉴定,种植于福建农林大学中药材GAP研究所田间隔离池内(表 1和图 1),同时,在组培条件下对每个资源进行离体培养和保存。
| 表 1 不同金线莲种质资源样品 Table 1 Samples of A. roxburghii from different germplasm resources |
 | “+”代表叶片正面 “−”代表叶片背面 “+” representative blade front “−” represents the back of the blade图 1 不同种质资源的金线莲外观差异比较 Fig.1 Comparison on appearance difference of A. roxburghii from different germplasm resources |
每个种质资源随机取10株金线莲植株的嫩叶,于−80 ℃冰箱贮存。将所收集的同一种质资源的所有叶片(10株不同单株)进行等量混合,经液氮研磨后,采用改良CTAB法提取DNA。同时,每个资源分别随机选取5个单株,单独提取DNA用于SCAR个体验证。1%琼脂糖凝胶电泳检测所提DNA的质量和完整性,微量分光光度计ND2000进行定量。
1.3 RAPD引物多态性筛选从OP系列10核苷酸随机引物库中(http://www.operon.com/),随机筛选100条RAPD预选引物。利用所搜集的20个资源验证RAPD引物多态性。RAPD-PCR扩增体系为20 μL,包括:1 μL DNA模板(50 ng/μL)、1 μL随机引物(10 μmol/L)、0.3 μL(1.5 U)Taq酶、1 μL dNTP、Mg2+ 2.5 μL、ddH2O补足至20 μL。PCR扩增程序:94 ℃预变性6 min;94 ℃变性50 s,36 ℃退火30 s,72 ℃延伸90 s,进行40个循环;72 ℃延伸6 min,4 ℃保存RAPD图谱制成0-1矩阵,即在相同位置上“有带”记为“1”,“无带”记为“0”,使用NTSYSpc2.1软件的UPGMA方法进行系统地聚类分析。
1.4 特异性片段的回收和测序从RAPD图谱中挑选显著特异性的条带回收,与pMD-18T载体连接过夜,转入Trans-5α感受态细胞中,均匀涂布在含有IPTG、X-gal、AMP的LB平板上,37 ℃恒温培养14 h。挑选白斑接种至500 μL含AMP的LB液体培养基中,250 r/min,37 ℃条件下震荡培养14 h,挑选单菌落进行PCR验证。
1.5 SCAR引物设计根据所挑选的RAPD特异片段的测序结果,使用Primer5软件设计SCAR正、反向引物。设计引物时在原RAPD引物序列基础上,分别向内延伸10~20 bp,调节引物延伸长度,使正、反向引物退火温度(Tm)值趋于相同。
1.6 SCAR-PCR的特异性条带验证以不同资源金线莲的单株DNA为模版进行SCAR标记特异性个体验证,扩增体系为20 μL,包括:1 μL DNA模板(50 ng/μL)、0.5 μL上游引物(5 μmol/L)、0.5 μL下游引物(5 μmol/L)、0.3 μL(1.5 U)Taq酶、1 μL dNTP、Mg2+ 2.5 μL、ddH2O补足至20 μL。PCR反应程序:94 ℃预变性6 min;94 ℃变性50 s,退火30 s(根据各引物退火温度上下浮动5 ℃),72 ℃延伸90 s,进行40个循环;72 ℃延伸6 min,4 ℃保存。鉴定单个SCAR标记在不同资源中特异性时,在每个资源中至少验证5个单株,若SCAR标记在每个单株中中均能扩增出一致的结果,说明所设计的SCAR标记在该资源中具有相应特异性。统计SCAR在所有资源中扩增结果,获取SCAR特异性谱。
2 结果与分析 2.1 RAPD引物多态性筛选与分析将所筛选的100条RAPD随机引物在20个金线莲种质资源中进行扩增。结果有57条引物可以在不同种质资源中扩增出清晰条带,其中,28条RAPD引物具有明显的多态性,共扩增出267条条带,其中,具有多态性的条带有135条,占总扩增条数的50%(表 2和图 2)。将28条多态性引物在不同资源中的扩增谱统计,并进行聚类分析。结果显示:当遗传相似系数为0.748时,20个品种分为6大类,其中Ar12、Ar13、Ar14可归为A类;Ar19可归为B类,Ar15可归为C类,Ar18 可归为D类;Ar3、Ar16、Ar5、Ar17可归为E类;Ar1、Ar6、Ar11、Ar2、Ar4、Ar7、Ar20、Ar8、Ar9、Ar10可归为F类(图 3)。
| 表 2 多态性RAPD引物 Table 2 RAPD primers with polymorphism |
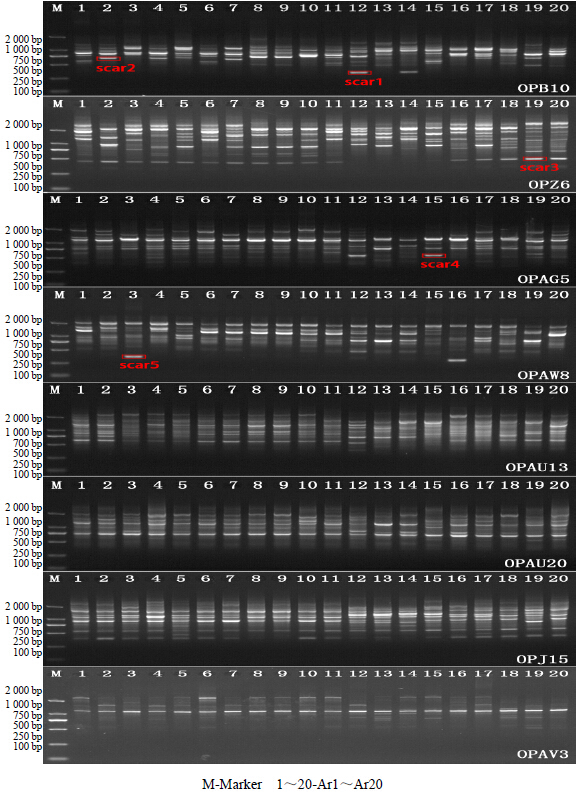 | 图 2 RAPD标记在不同种质资源中的扩增结果 Fig.2 Amplification of RAPD marker among different germplasm resources |
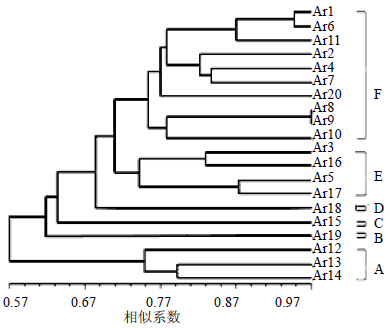 | 图 3 RAPD基础上不同金线莲种质资源亲缘关系聚类图 Fig.3 Genetic cluster of A. roxburghii from different germplasm using RAPD markers |
根据不同RAPD引物在不同资源中的扩增信息,在RAPD图谱中筛选到的5条特异性条带作为转化SCAR备选序列。进一步将5个条带进行切胶、回收,转化后,获取5条特异条带序列信息,初步转化为SCAR标记。其中,SCAR1、SCAR2转化自随机引物OPB10的多态性条带,测序长度分别为377 bp和837 bp;SCAR3则来自于OPZ6的多态性条带,测序长度为443 bp,SCAR4转化自OPAG5,长度为541 bp;SCAR5转化自OPAW8,长度为345 bp(图 2)用BlastN和BlastX工具对5条序列进行同源搜索,结果均未发现同源序列。5条特异性序列的测序结果见图 4(划线部分为OP随机引物序列)。
 | 图 4 特异性序列 Fig.4 Specific sequences |
在5条RAPD序列基础上,设计特异的SCAR标记引物,并进行特异性验证(表 3)。PCR扩增结果表明,5对引物均能在相应的种质资源中扩增出单一的条带。其中,SCAR1仅在Ar12、Ar14、Ar17中扩增出条带;SCAR2仅在Ar2、Ar4、Ar7、Ar13中扩增出条带;SCAR3仅在Ar13、Ar14、Ar15、Ar18中条带缺失,其他种质资源均能扩增出条带;SCAR4仅在Ar11、Ar15中扩增出条带;SCAR5仅在Ar2、Ar10、Ar15、Ar19中条带缺失(图 5)。此外,5对SCAR引物在同资源不同单株间的扩增结果完全相同,表明本研究所筛选的标记具有明显的资源特异性,而非单株间误差,说明RAPD标记成功转化成SCAR标记(图 6)。
| 表 3 SCAR引物序列 Table 3 Sequences of SCAR primers |
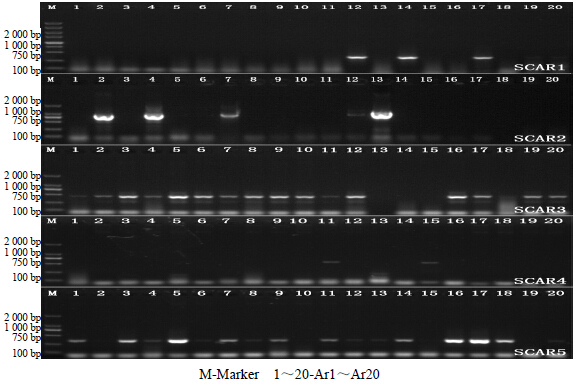 | 图 5 SCAR标记在不同种质资源中的扩增结果 Fig.5 Amplification of SCAR marker among diferent germplasm resources |
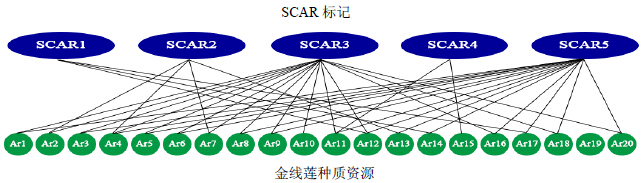 | 图 6 SCAR标记在不同种质资源金线莲中的特异性分析 Fig.6 Specific analysis of SCAR marker among different germplasm resources |
分子标记辅助育种体系已经在不同粮食作物中被广泛运用,在粮食增产、品质改善和育种效率的提高及遗传性状的改良等方面具有重要意义。相对于常规粮食而言,大多数药用植物仍然采用常规育种,仅凭外观性状和经验进行自选自育,导致育种效率低、品种退化快及杂种优势不明显。因此,在药用植物育种中,开发高效分子标记体系,从根源
上鉴定不同种质资源间的亲缘关系,选配出较高配合力的杂种优势群,对于药用植物的品种选育而言具有重要意义[11]。金线莲和大多数药用植物一样,种质资源亲缘关系模糊、缺乏正规的育种体系。在金线莲的生产实践中,一些常见的分子标记已经被广泛的开发和利用,比如顾慧芳等[9]用RAPD标记方法比较组培和野生金线莲,证明金线莲组培苗可以代替野生品种。张铁等[12]采用RAPD技术对4个金线莲品种进行区分,用16条引物扩增出108个条带,其中有95个多态性条带,证明RAPD方法可以区分干燥的金线莲药材。胡珊梅等[2]运用RAPD方法,发现RAPD技术不仅能鉴别种间差异,而且能揭示同种不同产地植物的遗传变异。将RAPD标记转换为SCAR标记,将原有RAPD复杂的标记统计模式转换为较少条带,能够显著提高其稳定性、特异性和准确性。因此,RAPD-SCAR标记体系在药用植物中开发和利用,已成为一种趋势[4]。
本研究从100条RAPD随机引物中筛选出特异性强、重复性高、条带清晰的28条引物,对20个不同资源的金线莲进行RAPD实验,共获取267个条带,其中有135条特异性条带。RAPD聚类分析显示当遗传系数为0.748时,将20个品种共分为6类。从聚类结果来看,来自同一地区的种质资源基本可以聚为一类,如A类均为广东地区的种质资源,B类为台湾地区的种质资源,D类为云南地区的种质资源,F类均为福建地区的种质资源。而归为C类的Ar15与其他广东种质资源差异较大,独立归为一类。与其他亲缘分类,E类则有广西来源的资源Ar17与部分福建资源Ar3、Ar16、Ar5,初步推测广西尖叶可能是由福建地区引种而来。此外,结合表型和亲缘关系聚类结果可以看出即使在同一分类中,表型存在着明显差异,这可能是由于地域隔离,气候差异导致其在基因上的表观变异。
为了筛选出金线莲资源鉴定所需的特异SCAR标记,本研究从多态性RAPD标记中获取5条特异位点的片段信息。对所获取的特异性片段序列进行注释发现5条序列均未找到同源序列,这可能一方面与金线莲在公共数据库中遗传信息极少有关,另外一方面这些序列可能处于基因间隔区、内含子区域或其他非编码区域[13]。将所获取的SCAR标记对不同金线莲进行鉴定,显示5条SCAR标记对某一类种质资源具有明显特异性。比如,SCAR1能有效鉴定出Ar12、Ar14、Ar17;SCAR2能有效鉴定出Ar2、Ar4、Ar7、Ar13;SCAR3能有效区分出Ar13、Ar14、Ar15、Ar19;SCAR4能有效区分出Ar11、Ar15;SCAR5能有效区分Ar2、Ar10、Ar15、Ar19。从鉴定结果可以看出对5条SCAR标记进行组合,可以更准确地鉴定某个种质资源,如SCAR1、SCAR3、SCAR5均能在Ar12中扩增出条带。因此,这3个SCAR标记在Ar12重复扩增能够减少单一标记鉴定的假阳性结果,更精确地鉴定相应种质资源。同时,对不同标记的有效组合则更广泛地鉴定不同金线莲资源。比如SCAR1标记能够鉴定Ar12、Ar14、Ar17,但不能鉴定Ar15;但Ar15则能被SCAR4特异鉴定。因此,SCAR1和SCAR4组合则大大提高SCAR标记鉴定群体。本研究所开发的SCAR标记为特异地鉴定某一类或某一种金线莲资源提供了快速、高效、准确的分子检测手段。
| [1] | 孔祥海. "药王"金线莲的自然资源初步研究[J].中草药, 2001, 32(2):155-157. |
| [2] | 胡珊梅,张启国,周涵韬. RAPD法在金线莲的鉴别研究中的应用[J].中草药, 2002, 33(10):949-950. |
| [3] | 汪小全,邹喻苹,张大明. RAPD应用于遗传多样性和系统学研究中的问题[J].植物学报, 1996, 11(12):954-962. |
| [4] | 杨春勇,李戈,王艳芳,等.福建金线莲DALP遗传多样性分析[J].中草药, 2014, 45(19):2824-2828. |
| [5] | 卢家仕,卜朝阳,吕维莉,等.不同产地石斛属种质资源的ISSR遗传多样性分析[J].中草药, 2013, 44(1):96-100. |
| [6] | 周鹏.地黄RAPD-SCAR标记及其生物信息学分析[D].郑州:河南师范大学, 2012. |
| [7] | 张福生,郭顺星.金线莲ISSR反应体系的建立与优化[J].中草药, 2011, 42(1):137-142. |
| [8] | 吴佳溶.不同地理种源金线莲有效成分含量测定及SRAP标记[D].福州:福建农林大学, 2012. |
| [9] | 顾慧芬,庄意丽,梅其春.野生与组培金线莲有效成分的比较及RAPD分析[J].中成药, 2011, 33(8):1364-1367. |
| [10] | 邹继军,杨庆凯,陈受宜.大豆灰斑病抗病基因RAPD标记的分子特征及抗、感种质的SCAR标记鉴定[J].科学通报, 1999, 44(23):2544-2550. |
| [11] | 邓启云,袁隆平,梁凤山.野生稻高产基因及其分子标记辅助育种研究[J].杂交水稻, 2004, 19(1):6-10. |
| [12] | 张铁,李洪超,刘伟.文山野生金线莲的RAPD鉴别[J].中药材, 2009, 32(3):347-348. |
| [13] | 包雷.基因芯片数据分析与药效基因组的生物信息学研究[D].北京:清华大学, 2002. |
 2016, Vol. 47
2016, Vol. 47


