三七Notoginseng Radix et Rhizoma系五加科(Araliaceae)植物三七Panax notoginseng (Burk.) F. H. Chen的干燥根,生三七粉和熟三七粉是三七最常用的2种饮片形式,传统认为三七具有生消熟补的作用。三七经加工炮制为熟三七粉后,具有补血强身作用,多用于治疗贫血[1]。蒸三七滋养血液,
能增加贫血状态下血细胞数量[2]。三七含有一系列活性物质,包括三萜皂苷(人参皂苷、三七皂苷)、多糖、黄酮类和氨基酸等,其中皂苷类是其主要活性物质[3, 4]。文献研究表明,人参皂苷Rgl和Rg2均具有抗凝血活性,人参皂苷Rg2活性高于Rg1[5]。三七蒸制过程中原人参二醇型(PPD)皂苷官能团(如人参皂苷Rb1、Rd)易选择性消除C-20位的糖链生成人参皂苷Rg3,三七中原人参三醇型(PPT)皂苷官能团(三七皂苷R1和人参皂苷Rf、Rg1、Re),先在C-20位脱糖基,随后在C-6位脱糖基,生成人参皂苷Rg2或Rh1。人参皂苷Rh1在C-20位进一步脱水转化为人参皂苷Rk3和Rh4[6, 7]。上述研究表明三七蒸制过程中皂苷类成分会发生明显变化,因此本实验研究三七蒸制前后皂苷类成分变化以及主要活性成分药动学和抗凝血活性的差异,以探索三七蒸制的科学性。
1 材料 1.1 仪器AcquityTM超高效液相色谱系统、Acquity Xevo TQD质谱系统、Masslynx 4.1色谱工作站、Waters e 2695型高效液相色谱仪(美国Waters公司);Milli-Q超纯水机(美国Millipore公司);Sartorious Bp211D电子天平(德国Satrorius公司);Vortex-Genie 2漩涡混合器(美国Scientific Industries公司);高速冷冻离心机、SpeedVac离心浓缩仪(美国Thermo Scientific公司);高压灭菌器(Sanyo);减压干燥器(上海博讯实业有限公司);PAPE-I型血小板聚集/血凝测定仪(北京世帝科学仪器有限公司)。
1.2 药品及主要试剂三七药材购于云南文山,经南京中医药大学药学院刘圣金鉴定为五加科植物三七Panax notoginseng (Burk.) F. H. Chen的干燥根;三七皂苷R1对照品(批号110745-200617,质量分数>98%)、地高辛对照品(批号130609,质量分数>98%),均购于中国食品药品检定研究院;人参皂苷Rg1、Rb1、Re、Rd、Rf、Rg2、Rh1、F2、Rg3对照品(吉林大学有机化学教研室,质量分数>98%);人参皂苷Rk3、Rh4对照品(成都普菲德生物技术有限公司,批号130529、131128,质量分数>98%);阿司匹林肠溶片(拜耳医药保健有限公司,每片含100 mg阿司匹林,批号J20130078);胶原(5 mg,来源于大鼠,Sigma公司)。
醋酸乙酯、正丁醇、无水乙醇(南京化学试剂有限公司);乙腈、甲醇(德国Merck公司);羧甲基纤维素钠(CMC-Na,国药集团化学试剂有限公司);柠檬酸钠(上海久亿化学试剂有限公司);超纯水(Milli-Q超纯水机制备)。
1.3 动物SD大鼠,雄性,体质量180~220 g,扬州大学实验动物中心,动物许可证号SCXK(沪)2013-0006,给药前12 h禁食不禁水。
2 方法与结果 2.1 三七蒸制样品的制备取三七(产地云南,60头,批号130901,质量标准符合《中国药典》2010年版一部)适量,破碎,分别于120 ℃高压蒸制0、2、4、8 h。称取不同蒸制时间的三七样品,加入70%乙醇回流提取3次,每次1 h,滤液减压回收乙醇并浓缩,减压干燥成粉末。
2.2 蒸制前后主要活性成分变化 2.2.1 溶液的制备(1)混合对照品溶液的制备:精密称取三七皂苷R1、人参皂苷Rb1、Rg1、Rd、Rg2、Rk3、F2、Rh4、Rg3、Rh1、Re、Rf对照品适量,甲醇配成质量浓度分别为0.45、0.295、0.477、0.23467、0.273 5、1.163 5、0.305 3、0.227 4、0.148、0.231 5、0.476、1.042 mg/mL的混合对照品贮备液。
(2)供试品溶液的制备:取不同蒸制时间的三七粉末20 mg,精密称定,置10 mL量瓶中,加入适量甲醇,摇匀,超声3 min(频率100Hz、功率60 W)溶解,放冷至室温,精密加入甲醇至刻度,密塞,摇匀,用0.22 μm微孔滤膜滤过,得供试品溶液。
2.2.2 色谱条件Thermo C18色谱柱(250 mm×4.6mm,5 μm),柱温35 ℃;流动相为乙腈(A)-水(B),梯度洗脱程序:0~25 min,20% A;25~30 min,20%~24% A;30~42 min,24%~46% A;42~52 min,46%~55% A;52~61 min,55%~68% A;61~68 min,68%~80% A;检测波长203 nm;进样量10 μL;体积流量1 mL/min。
2.2.3 线性关系考察采用外标一点法定量,将对照品与供试品溶液多次在相同条件下进样,测得峰面积平均值。i组分水平的计算公式如下:
Wi=Ai∙Wis/Ais
Wi、Ai分别是供试品溶液中所含i组分的质量及峰面积,Wis、Ais分别是混合对照品溶液中所含i组分的质量及峰面积;使供试品与对照品峰面积接近,以避免工作曲线线性不好或截距不为0造成的误差
2.2.4 精密度试验精密吸取“2.2.1”项下的同一供试品溶液10 μL,连续进样5次,各成分的RSD均小于2.00%,表明仪器精密度良好。
2.2.5 稳定性试验精密吸取“2.2.1”项下同一供试品溶液10 μL,分别在0、2、4、8、12、24 h进样,测定峰面积。各成分RSD均小于1.90%,表明样品溶液在24 h内稳定。
2.2.6 重复性试验取同一蒸制时间(2 h)样品,按“2.2.1”项方法平行制备供试品溶液5份,测定峰面积。各成分RSD均小于2.00%,表明本法重复性良好。
2.2.7 加样回收率试验精密称取已知质量浓度的样品5份(蒸制2 h),分别精密加入三七皂苷R1及人参皂苷Rb1、Rg1、Rd、Rg2、Rk3、F2、Rh4、Rg3、Rh1、Re、Rf对照品,按“2.2.1”项下方法制备供试品溶液后,在“2.2.2”项色谱条件下进样,计算回收率,各组分平均回收率均为95.00%~105.00%,RSD均小于2.00%,表明回收率良好。
2.2.8 样品测定取蒸制不同时间的三七样品,按“2.2.1”项方法制成供试品溶液,按“2.2.2”项色谱条件进行测定,平行测定3份。分别计算三七蒸制前后各成分水平变化,结果见表 1。
| 表 1 三七蒸制前后各成分水平变化 $\left( {\bar x \pm s,n = 3} \right)$ Table 1 Changes of components betweenraw and steamed Notoginseng Radix et Rhizoma $\left( {\bar x \pm s,n = 3} \right)$ |
(1)混合对照品溶液的制备:精密称定三七皂苷R1及人参皂苷Rg1、Re、Rb1、Rg3、Rg2对照品适量,甲醇配成质量浓度分别为6.639、6.360、6.347、7.867、8.200、7.893 μg/mL的混合对照品贮备液。
(2)内标溶液的制备:精密称取地高辛对照品,配制成8μg/mL内标储备液,临用前甲醇稀释到0.8 μg/mL。
2.3.2 分组给药及血样采集20只大鼠,随机分为4组,分别ig不同蒸制时间(0、2、4、8 h)的三七样品液(蒸制不同时间的三七粉末溶于0.5%的CMC-Na中配成25mg/mL的溶液)500 mg/kg,给药前禁食12 h,每只大鼠眼眶取0.25 mL空白血浆,给药后分别于0.08、0.25、0.5、0.75、1、1.5、2、3、4、6、8、12、24、48 h眼眶取血0.25 mL,5 000 r/min离心5min,分离血浆,−80 ℃保存备用。
2.3.3 血浆样品处理精密量取100 μL大鼠含药血浆样品,加入0.8 μg/mL内标地高辛溶液10 μL,涡旋30s,加入1 mL的萃取试剂水饱和正丁醇-醋酸乙酯(3∶1),涡旋3 min,6 000 r/min离心5 min,取800μL上清液,45 ℃离心浓缩仪挥干,进样前加入80 μL流动相复溶,14 000 r/min离心10 min,取上清液,备用。
2.3.4 色谱与质谱条件(1)色谱条件:AcquityTM UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7μm),柱温40 ℃;流动相为1 mmol/L甲酸铵水溶液(A)-乙腈(B),梯度洗脱程序:0~4 min,10%~35% B;4~8 min,35%~70% B;8~9 min,70%~10% B;9~10 min,10% B;体积流量0.25 mL/min;进样量5 μL。
(2)质谱条件:电喷雾离子化(ESI)负离子方式检测,多重反应监测(MRM)模式扫描;毛细管电压3.0 kV;离子源温度150 ℃;锥孔气体积流量50 L/h;脱溶剂温度450 ℃;脱溶剂气体积流量1 000 L/h;各待测成分及内标检测参数见表 2;采用DAS3.2.6软件进行数据处理。
| 表 2 三七中主要皂苷、代谢产物和地高辛的MRM检测模式参数 Table 2 MRM parameters of mainsaponins,metabolites,and digoxin in Notoginseng Radix et Rhizoma |
取混合对照品储备液,按倍数稀释成一系列不同质量浓度的混合对照品溶液。取大鼠空白血浆100 μL,加入不同质量浓度的混合对照品溶液10 μL,按“2.3.3”项方法处理,取20 μL上清按照“2.3.4”项条件进样,记录各对照品和内标的峰面积,以对照品质量浓度(X)与对照品和内标峰面积比值(Y)作线性回归。三七皂苷R1及人参皂苷Re、Rg1、Rb1、Rg3、Rg2回归方程分别为:Y=2.217 6 X-0.026 9,r=0.998 9;Y=1.447 3 X+0.057 1,r=0.997 0;Y=1.137 8 X+0.0402,r=0.997 6;Y=1.306 8 X+0.016 6,r=0.997 8;Y=1.3858 X+0.029 3,r=0.996 2;Y=0.876 2 X-0.0048,r=0.9946。线性范围分别为0.036~6.639、0.050~6.347、0.050~6.360、0.031~7.867、0.032~8.200、0.031~7.893 μg/mL。
2.3.6 精密度与准确度试验取大鼠空白血浆100 μL,加入不同质量浓度的混合对照品溶液10 μL,配制成低、中、高3个质量浓度的质控样品(根据线性范围设置,高浓度为线性范围最高点的80%,低浓度为线性范围最低点的3倍以内,中浓度选取中间浓度),按“2.3.3”项下血样处理方法处理,每个浓度制备6份为1批,平行处理3批,按照“2.3.4”项条件进样,记录各质控样品和内标的峰面积,带入标准曲线的回归方程,计算质控样品的质量浓度,考察批内、批间精密度。结果显示,低、中、高3个质量浓度的质控样品批内RSD小于10%,批间RSD小于15%。批内、批间准确度分别为88.12%~110.13%、86.13%~114.11%。均符合生物样品分析的要求。
2.3.7 稳定性试验取大鼠空白血浆100 μL,加入不同质量浓度的混合对照品溶液10 μL,配制成低、中、高3个质量浓度的质控样品,按“2.3.3”项血样处理方法处理。进行室温、冰冻(−80 ℃)、反复冻融3次的稳定性考察。结果显示,各待测成分在室温下至少能稳定12 h,在冷冻条件下至少能稳定4周,在冻融3次的条件下能够保持稳定。
2.3.8提取回收率 取大鼠空白血浆100 μL,加入不同质量浓度的混合对照品溶液10 μL,配制成低、中、高3个质量浓度的质控样品,按“2.3.3”项血样处理方法处理,进样检测,以测得的峰面积与与未经处理的相应质量浓度的对照品溶液峰面积的比值,计算提取回收率,每个质量浓度平行处理5份。结果测得回收率为51.22%~95.11%,RSD为3.14%~13.81%。回收率大于50%,符合生物样品定量要求。
2.3.9 基质效应取大鼠空白血浆100 μL,按“2.3.3”项下血样处理方法处理,挥干样品后,用流动相配制的含低、中、高质量浓度对照品的溶液复溶,进样检测,记录峰面积(A1)。用流动相配制的含低、中、高浓度的对照品溶液直接进样分析,记录峰面积(A2)。2次峰面积的比值(A2/A1)计算基质效应。结果表明,测得成分的基质效应为92.03%~114.21%,RSD为1.92%~13.26%。
2.3.10 蒸制前后主要活性成分大鼠体内药动学变化三七皂苷R1及人参皂苷Rg1、Rb1、Re、Rg3、Rg2平均药时曲线见图 1,药动学参数见表 3~6。结果表明三七中主要皂苷经脱糖基生成新的成分(人参皂苷Rb1脱糖基产物人参皂苷Rg3)后,其tmax较原皂苷减小,Cmax较原皂苷增大,表明其更易吸收入血。随着蒸制时间延长,原型皂苷AUC(0-∞)逐渐减小,可能与蒸制过程中三七中成分水平改变有关。
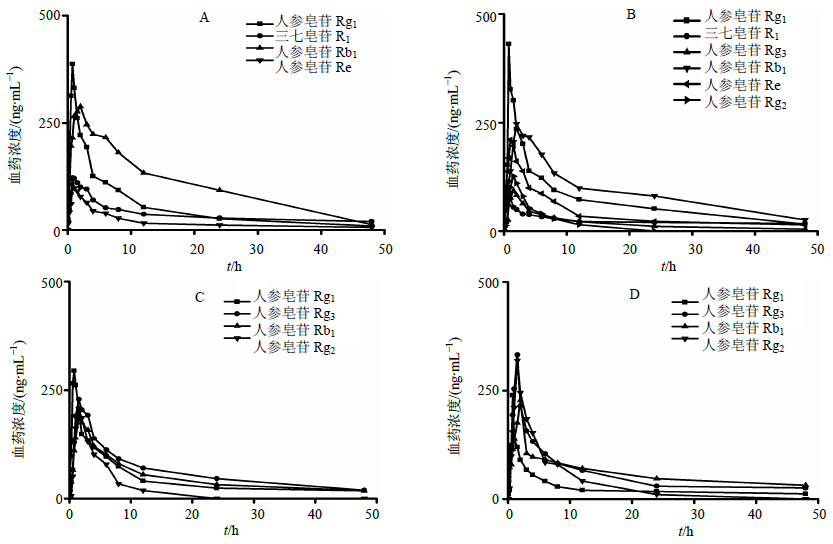 | 图 1 蒸制0 (A)、2(B)、4 (C)、8 (D) h的三七中主要活性成分的药时曲线 $\left( {\bar x \pm s,n = 5} \right)$ Fig.1 Plasma concentration-time curves of steamed Notoginseng Radix et Rhizoma at time points of 0 (A),2 (B),4 (C),8 (D) h $\left( {\bar x \pm s,n = 5} \right)$ |
| 表 3 生三七ig给药后主要活性成分药动学参数 $\left( {\bar x \pm s,n = 5} \right)$ Table 3 Pharmacokineticparameters of raw NotoginsengRadix et Rhizoma after ig administration $\left( {\bar x \pm s,n = 5} \right)$ |
| 表 4 蒸制2 h三七ig给药后主要活性成分药动学参数 $\left( {\bar x \pm s,n = 5} \right)$ Table 4 Pharmacokinetic parameters of steamed Notoginseng Radix et Rhizoma at 2 h after ig administration $\left( {\bar x \pm s,n = 5} \right)$ |
| 表 5 蒸制4 h三七ig给药后主要活性成分药动学参数 $\left( {\bar x \pm s,n = 5} \right)$ Table 5 Pharmacokinetic parameters of steamed Notoginseng Radix et Rhizoma at 4 h after ig administration $\left( {\bar x \pm s,n = 5} \right)$ |
| 表 6 蒸制8 h三七ig给药后主要活性成分药动学参数 $\left( {\bar x \pm s,n = 5} \right)$ Table 6 Pharmacokineticparameters of steamed Notoginseng Radix et Rhizomaat 8 h after igadministration $\left( {\bar x \pm s,n = 5} \right)$ |
大鼠36只,随机分为6组:对照(0.5% CMC-Na)组、阿司匹林(25 mg/kg,阿司匹林肠溶片2片去薄膜衣研成粉末溶于0.5% CMC-Na中,配成5 mg/mL的溶液)组、不同蒸制时间三七样品液(500 mg/kg)组,各组ig给药。给药110 min后眼眶取4 mL血液,置于含有0.44 mL 3.8%柠檬酸钠的试管中,混匀后分别按不同的离心速度制备富血小板血浆(PRP)和贫血小板血浆(PPP)。800r/min离心10 min后吸取上层血浆得PRP;将剩余血液2 500 r/min离心10 min后吸取上层血浆得PPP。取250 μL PPP加入PAPE-I型血小板聚集/血凝测定仪测试杯中,放入测试孔中定标。取250 μL PRP加入测试杯中,在37 ℃预温槽中预热1 min,立即加入2 μg/mL诱导剂胶原25 μL测定血小板最大聚集率。每次测定3个通道,计算平均最大聚集率。运用SPSS 16.0统计分析软件,t检验进行数据处理,结果表明,蒸三七比生三七有更明显的抗血小板聚集活性(P<0.05、0.001),且随着蒸制过程的延长,抗血小板聚集活性更强。结果见表 7。
| 表 7 生三七与蒸三七对大鼠体外血小板聚集的影响 $\left( {\bar x \pm s,n = 6} \right)$ Table 7 Effectsof raw and steamed NotoginsengRadix et Rhizoma onplatelet aggregation inrats $\left( {\bar x \pm s,n = 6} \right)$ |
HPLC-UV测定三七蒸制前后成分变化,随着蒸制过程的延长,皂苷脱糖基更彻底,生成脱糖基代谢物的量越多。蒸制过程中,三七中原型皂苷(三七皂苷R1及人参皂苷Rg1、Rd、Rb1、Re)随着时间延长,水平逐渐降低。蒸制4 h后,三七皂苷R1水平明显降低。而原型皂苷脱糖基产生的代谢产物(人参皂苷Rg2、Rg3、Rh1、F2、Rk3、Rh4)随着时间的延长,水平逐渐增加。蒸制8 h后,Rk3、Rh4急剧增加。以上结果表明,随着蒸制时间延长,三七中原型皂苷水平降低,而PPD、PPT型皂苷官能团脱糖基产物水平增加。
三七蒸制过程降低了某些生物活性物质(三七皂苷R1及人参皂苷Rg1、Rd、Rb1、Re)的水平,并产生了新的皂苷类成分(人参皂苷Rg2、Rg3、Rh1、F2、Rk3、Rh4),且其水平随着蒸制时间的延长不断增加,上述变化可能是蒸三七抗凝血活性增强的主要原因。体内药动学实验结果表明,随着蒸制时间延长,人参皂苷Rb1和Rd的脱糖基代谢产物人参皂苷Rg3的AUC(0-∞)增加,且人参皂苷Rg3与Rb1比较tmax略有降低。抗血小板聚集实验表明,蒸三七比生三七抗血小板聚集活性更强,且蒸制时间越长,抗血小板聚集活性越强。文献研究表明,人参皂苷Rh1、Rf等对钙通道有抑制作用,三七对血小板聚集的抑制作用可能与此有关。三七皂苷R1、人参皂苷Rg1、Rg2均有抗血小板聚集活性[8, 9],三七中原型皂苷与脱糖基代谢产物的抗血小板聚集活性的比较有待进一步研究。综合分析表明,三七蒸制后,皂苷类成分脱糖基后可能产生活性更强的成分(PPT型皂苷脱糖基生成Rg2或Rh1),某些脱糖基代谢产物更易吸收入血[10],可能导致抗凝血活性增强。
由于检测条件限制,PPT型皂苷(三七皂苷R1及人参皂苷Rg1、Rf、Re)脱糖基代谢产物Rh1,及其进一步代谢产物人参皂苷RK3、Rh4未能测定。蒸三七抗凝活性与其成分的量效关系有待进一步研究。
| [1] | 周新惠,龙丽莉,李春梅,等.生三七与蒸制熟三七部分药理作用的比较研究[J].环球中医药, 2014, 7(6):420-426. |
| [2] | 中华人民共和国国家中医药管理局.中华本草精选本[M].上海:上海科学技术出版社, 1996. |
| [3] | 赵国强,王秀训.三七止血成分dencichine[J].中草药, 1986, 17(6):34-35. |
| [4] | 王莹,禇扬,李伟,等.三七中皂苷成分及其药理作用的研究进展[J].中草药, 2015, 46(9):1381-1392. |
| [5] | 王海波.人参、西洋参和三七抗凝血活性及与药性关系的研究[D].长春:吉林农业大学, 2011. |
| [6] | Wang C Z, Aung H H, Ni M, et al. Red American ginseng:ginsenoside constituents and antiproliferative activities of heat-processed Panax quinquefolius roots[J]. Planta Med, 2007, 73(7):669-674. |
| [7] | Sun S, Qi L W, Du G J, et al. Red notoginseng:higher ginsenoside content and stronger anticancer potential than Asian and American ginseng[J]. Food Chem, 2011, 125(4):1299-1305. |
| [8] | 田建明,宋丽晶,李浩,等.人参皂苷Rg2对大鼠体内血栓形成及血小板聚集的影响[J].上海中医药杂志, 2009, 43(11):79-80. |
| [9] | 王永.三七总皂苷对内毒素休克大鼠心肌保护作用机制的研究[D].福建:福建中医学院, 2008. |
| [10] | Hu Z Y, Yang J L, Li C, et al. Combinatorial metabolism notably affects human systemic exposure to ginsenosides from orally administered extract of Panax notoginseng roots(Sanqi)[J]. Drug Metab Dispos, 2013, 41(7):1457-1469. |
 2016, Vol. 47
2016, Vol. 47


