2. 成都中医药大学附属医院, 四川成都 610072;
3. 江西中医药大学现代中药制剂教育部重点实验室, 江西南昌 330004
2. Affiliated Hospital, Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China;
3. Key Laboratory of Modern Preparation of TCM, Jiangxi University of Traditional Chinese Medicine, Ministry of Education, Nanchang 330004, China
煎煮作为附子重要的控毒因素之一,是确保临床用药安全的重要手段。制附子是当今中医临床主要使用的附子类型[1],合格的制附子毒性低,安全性程度较高,水煎液无法测出其半数致死量(LD50)[2],属于小毒或微毒药物。因此,制附子有无久煎的必要一直备受争论。一些医生的临床经验认为附子久煎有温阳、固汗、镇痛之效,一般煎煮主要起振奋阳气、温化寒湿的作用[3],也有一些医生认为制附子先煎1 h后效果较差,小量附子不必久煎[4]。相关的动物实验也表明,生附子发挥镇痛效果的最佳煎煮时间是15~30 min[5],发挥抗炎效果的最佳煎煮时间是60 min[6],而发挥温阳功效的最佳煎煮时间是6 h[7]。总体而言,不同的研究对象与研究方法,其研究结论并不一致。鉴于此,整体把握煎煮过程中制附子化学成分群的变化规律具有重要意义。目前,代谢组学技术已广泛应用于中药物质基础及作用机制研究[8],该方法具有集整体性、动态性、综合性分析于一体等特点[9],理想地适用于区别不同中药化学特征成分群。通过对差异性特征成分群进行综合比较,可以发现成分的功效、毒性等差异。
本实验首先对制附片进行了定性定量分析,其次采用代谢组学的设计原理与相关方法,利用超高效液相色谱-四级杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time of fight/mass spectrometry,UHPLC-Q-TOF/MS)技术结合主成分分析(principal component analysis,PCA)与偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),从化学计量学角度对不同煎煮时间制附子化学成分开展系统评价,以期全方位揭示煎煮过程中附子化学成分的变化规律,发掘差异成分,对于确定制附片合理的煎煮时间,探寻附子的药效物质基础具有重要的参考意义。
1 仪器与材料1200型高效液相色谱仪(四元泵、自动进样器及UV检测器),1290 Infinity UPLC超高效液相色谱仪,iFunnel 6550 Q-TOF LC/MS四级杆串联飞行时间质谱,美国Agilent公司;Gradient A10 Mill-Q超纯水器,法国Millipore公司;Sartorius-BS110S万分之一分析天平,德国赛多利斯公司;实验室pH计,Mettler Toledo公司;HC-3018R高速冷冻离心机,安徽中科中佳科学仪器有限公司。江油鲜附子样品经解放军第三〇二医院肖小河研究员鉴定为毛茛科乌头属植物乌头Aconitum carmichaelii Debx. 的子根,样品保存于全军中药研究所。
2 方法与结果 2.1 制附片的制备方法本实验所用制附片是本课题组最新研制的新型附片规格[10],具有炮制工艺简单可控、安全性高、药效成分损失少、规格均一、成分煎出率高、质量均一性好等特点,已申报中国发明专利[11]。具体制备方法为取江油鲜附子,洗净去泥,切成3 mm薄片,在100 ℃条件下鼓风干燥10 h,即得。制得的制附片颜色焦黄,有焦香气,味淡。
2.2 制附片的质量控制 2.2.1 供试品溶液的制备取本品制附片粉末(过3号筛)约2 g,精密称定,置具塞锥形瓶中,氨试液3 mL,精密加入异丙醇-醋酸乙酯(1∶1)混合溶液50 mL,称定质量,超声处理(功率300 W,频率40 kHz,水温在25 ℃以下)30 min,放冷,再称定质量,用异丙醇-醋酸乙酯(1∶1)混合溶液补足减失的质量,摇匀,滤过。精密量取续滤液20 mL,通风橱中回收溶剂至干,残渣精密加入异丙醇-二氯甲烷(1∶1)混合溶液3 mL溶解,过0.22 μm微孔滤膜,即得供试品溶液。
2.2.2 色谱条件参照文献方法[10],色谱柱为Phenomenex Gemini C18柱(250 mm×4.6 mm,5 μm),流动相:A相为乙腈-0.04 mol/L醋酸铵水溶液(浓氨溶液调pH 10.0,1∶3),B相为乙腈-0.04 mol/L醋酸铵水溶液(浓氨溶液调pH 10.0,65∶35),线性梯度洗脱程序:0~20 min,10%~22% B;20~30 min,22%~37% B;30~40 min,37%~47.5% B;40~45 min,47.5%~52% B;45~65 min,52%~60% B;65~75 min,60%~75% B;75~80 min,75%~95% B;体积流量0.8 mL/min;检测波长235 nm;柱温30 ℃;进样量10 μL。
2.2.3 定性定量控制制附片的HPLC图谱见图 1。定量测定结果提示,制附片中未检测出新乌头碱与乌头碱,其余4种生物碱:苯甲酰新乌头原碱(BMA,benzoylmesaconine)、苯甲酰乌头原碱(BAC,benzoylaconitine)、苯甲酰次乌头原碱(BHA,benzoylhypacoitine)、次乌头碱(HA,hypaconitine)的质量分数分别为0.646、0.113、0.293、0.083 mg/g,毒性成分双酯型生物碱的总量为0.083 mg/g,药效成分单酯型生物碱的总量为1.052 mg/g,均符合《中国药典》2015年版规定。
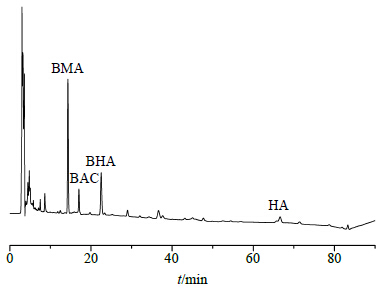 | 图 1 制附片HPLC图谱 Fig.1 HPLC of processed acotine |
称取制附片样品20 g,加入去离子水200 mL回流煎煮,分别于0.5、1.0、2.0、4.0 h取样1 mL,作为代谢组学的分析样本,同时补足去离子水1 mL,平行5份测定。另取制附片若干份,同法煎煮,监测煎煮过程中提取液pH值及干膏率的变化。结果发现,制附片提取液在0.5、1.0、2.0、4.0 h的pH值分别为5.87、5.75、5.72、5.59,干膏率分别为12.36%、15.54%、17.92%、18.38%。由此可知,随着煎煮时间的延长,煎煮液的pH值有降低趋势,干膏率有升高趋势。
2.4 样品的代谢组学分析 2.4.1 样品制备取上述煎煮样品,12 000 r/min离心10 min。取上清液适量,加入去离子水稀释100倍,过0.22 μm微孔滤膜,制得供试品。
2.4.2 色谱条件色谱柱Zorbax RRHD 300SB-C18柱(100 mm×2.1 mm,1.8 μm,Agilent Technology,美国),柱温30 ℃;流动相A为水(含0.1%甲酸),流动相B为乙腈(含0.1%甲酸),线性梯度洗脱程序:0~1 min,2% B;1~2 min,2%~5% B;2~5 min,5%~11% B;5~10 min,11%~15% B;10~15 min,15%~30% B;15~20 min,30%~40% B;20~24 min,40%~50% B;体积流量0.3 mL/min,进样量1 μL。
2.4.3 质谱条件电喷雾电离离子源(electrospray ionization,ESI),正离子模式,质量范围m/z 100~900,毛细管电压3 500 V,锥孔电压1 000 V,干燥气温度200 ℃,干燥气体积流量12 L/min,鞘气温度350 ℃,鞘气体积流量14 L/min,采用参比溶液(混合有质荷比为121.050 9和922.009 8的参比离子)确保高精度的采集结果,各样品典型质谱图见图 2。
 | 图 2 不同煎煮时间样品典型质谱图 Fig.2 Mass spectrum of different decoction time limit |
采用Agilent Mass Hunter ProfinderB.06.00版本软件对正离子模式下的质谱原始数据进行处理。数据过滤参数:质量范围m/z 100~1 000,校正误差0.100,保留时间窗口0.3 min。多元分析采用SIMCA-P 11.0软件,以Pareto(Par)方式对数据进行标准化处理,采用无监督的PCA方法观察样本整体分布趋势,有监督的PLS-DA方法对有差异样本进行判别分析。统计分析采用SPSS 22.0软件,P<0.05被认为有显著性差异,作图软件采用Origin 8.5软件。
2.5 多元统计分析结果质谱原始数据经过Profinder软件处理后,得到1 553个成分数据,为了增加数据的可靠性,对得到的数据进一步进行处理,参照文献方法[12]剔除缺失值过多的变量,最后得到768有效变量数据。建立4个不同煎煮时间制附片煎煮液样本的PCA模型,模型参数RX2=0.746,Q2=0.652,该模型可靠;由得分图(图 3)可以看出,不同煎煮时间的制附片样本能够较好的分离,说明随着煎煮时间的延长,煎煮液中的成分群发生了规律性变化。
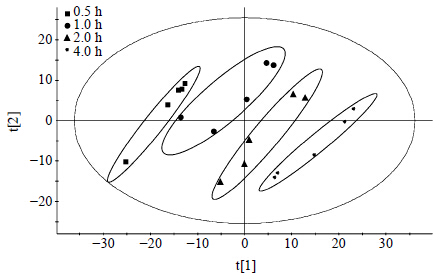 | 图 3 不同煎煮时间样品PCA得分图 Fig.3 Score plot of different decoction time of samples distinguished by PCA |
为了更好地寻找煎煮过程中出现差异的成分,将煎煮时间为1.0、2.0、4.0 h的样品分别与煎煮时间为0.5 h的样品建立PLS-DA模型。PLS-DA模型是一种有监督的预测模型,在处理高维数据很容易出现过拟合现象,为防止模型的过度拟合,验证模型可靠性,进行外部模型验证,设定变量y的随机排列次数为99次,对随机化产生的R2及Q2值与原始累积的R2及Q2值进行线性回归[13]。结果显示,模型质量好,具体参数见表 1。图 4中A、D、G分别展示的是煎煮时间为1、2、4 h样品与0.5 h样品比较的得分散点图,可以看出,不同时间点的样品均能与0.5 h样品明显区分。图 4-C、F、I展示的是768个变量因子的载荷图。图 4-B、E、H则展示的为S-plot,贡献度越大的成分离原点越远,且分布在两端,分别筛选出VIP值大于1.5的差异成分,将各自筛选得到的结果进行t检验(P<0.05),最终筛选到15个具有显著差异标志物,通过数据库比对及文献资料推断所筛选成分,具体鉴定结果见表 2。
| 表 1 PLS-DA模型参数 Table 1 Parameters of PLS-DA models |
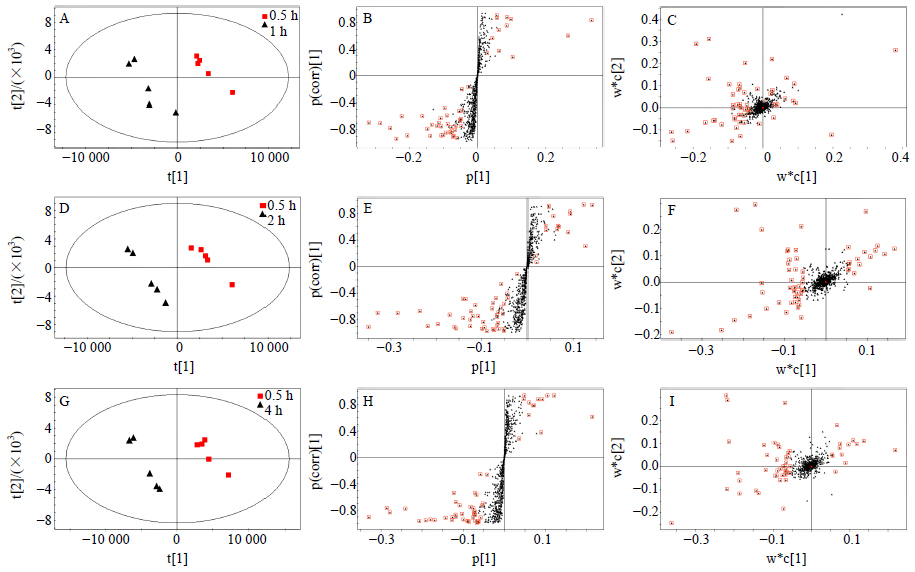 | VIP值>1.5的离子用方框标注;A、B、C为0.5 h和1.0 h组PLS-DA模型结果;D、E、F为0.5 h和2.0 h组PLS-DA模型结果;G、H、I为0.5 h和4.0 h组PLS-DA模型结果 ions with VIP value > 1.5 marked with a square; A,B,C result of PLS-DA model using data from 0.5 and 1.0 h groups; D,E,F result of PLS-DA model using data from 0.5 and 2.0 h groups; G,H,I result of PLS-DA model using data from 0.5 and 4.0 h groups图 4 PLS-DA得分图 (A、D、G)、S-plot (B、E、H)和载荷图 (C、F、I) Fig.4 PLS-DA Score plot (A,D,G) displayed with first two components,S-plots at first component (B,E,H),and Loading plot (C,F,I) |
| 表 2 15个差异显著化学标志物鉴定结果 Table 2 Fifteen chemical markers identified with significant differences |
将15个化学标志物,以其离子响应强度峰面积为纵坐标,不同煎煮时间样品为横坐标,通过Origin 8.5软件制作箱图(图 5),可以看出,双酯型生物碱次乌头碱随煎煮时间延长离子强度大幅降低,且在煎煮时间为4.0 h时,其强度几乎下降为零;单酯型生物碱苯甲酰次乌头原碱、苯甲酰新乌头原碱、苯甲酰乌头原碱均随随煎煮时间延长离子响应强度增加,其中,苯甲酰次乌头原碱增加明显,而苯甲酰新乌头原碱、苯甲酰乌头原碱在煎煮前1.0 h内增加较为明显,往后到4.0 h时增加幅度减小;原型碱新乌头原碱和乌头原碱均随着煎煮时间的延长而增加,次乌头原碱可能由于本身的量太低而未被筛选为化学标志物。其他C-19、C-20型生物碱,除雷乌宁较明显下降外,其余的多根乌头碱、卡米查林、塔拉定、宋果灵、附子灵、尼奥林、附子亭、塔拉乌头胺均呈现上升趋势或先上升后稳定的趋势。
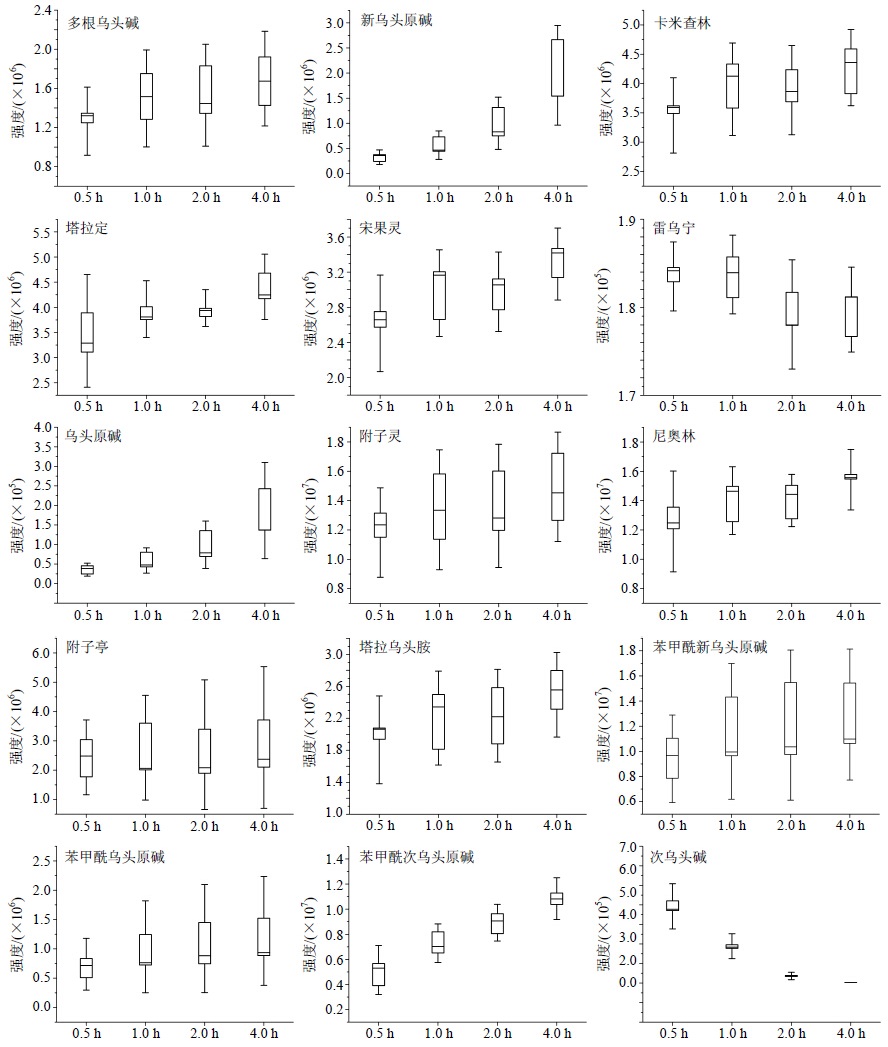 | 图 5 15个化学标志物离子响应强度随煎煮时间变化 Fig.5 Ion intensity peak area variation of 15 chemical markers with decoction time changing |
从上述化学标志物的离子强度变化规律来看,制附片的煎煮过程可大致分为2个阶段:一是成分的煎煮溶出过程,即各种成分从药材中提取转移到汤剂中,为前0.5~1.0 h;二是成分的转化过程,即一些受热易降解的成分发生转化的过程,为0.5~4.0 h。从标志物的种类来看,第2个阶段主要是双酯型生物碱转变为单酯型生物碱,继而转变为醇胺类原碱的过程,图 6中展示了3类生物碱的母核结构及相应化合物的变化情况,而多根乌头碱、宋果灵、附子灵等酯性生物碱具有较好的热稳定性,在长时间加热过程中并不发生明显的变化。因此,从化学成分群看,制附片久煎的显著变化在于单酯型生物碱向原碱的降解转化,煎煮时间越长,原碱的量越高。研究单酯型生物碱与醇胺类原碱的活性差异,探寻最佳比例,是揭示制附片久煎必要性与科学性的关键。
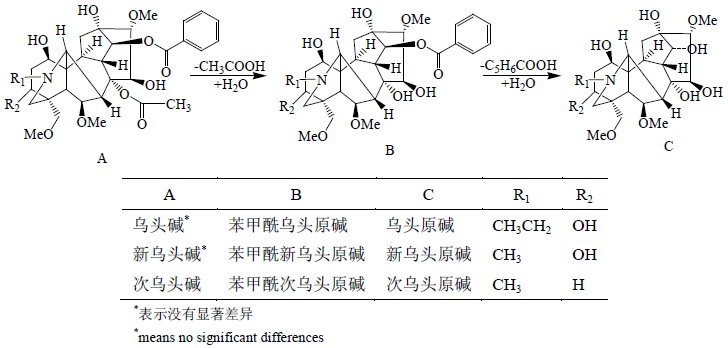 | 图 6 煎煮过程中生物碱结构变化 Fig.6 Chemical structure changes of alkaloids during decoction |
通过代谢组学技术分析,本实验筛选了煎煮过程中成分的量变化明显15个重要的化学标志物。由于这些成分的分离条件与分离量限制,不少组分的活性与毒性尚不十分明确。通过查阅Pubmed Toxnet Home Database,获得基础毒性数据;查阅相关文献[14, 15, 16, 17, 18, 19, 20],从强心、抗心律失常、镇痛、抗炎作用等方面对15个组分的毒性与活性进行了归纳,结果见表 3。
| 表 3 15个化学标志物的毒性活性分析 Table 3 Analysis on toxicity for 15 chemical markers |
从毒性来看,次乌头碱毒性最强,其次为单酯型的苯甲酰乌头原碱、苯甲酰次乌头原碱与苯甲酰新乌头原碱,其毒性仅为乌头碱的1/50~1/500,毒性大大降低。其余成分,如塔拉乌头胺、尼奥林、卡米查林、乌头原碱、宋果灵等,与苯甲酰新乌头原碱毒性相当或更弱,从化学物质的毒性分级来看,除次乌头碱属于剧毒成分外,其余成分均属于低毒物质。
从强心活性来看,次乌头碱、乌头原碱、新乌头原碱对于离体蛙心具有确切的强心作用[14];尼奥林、附子灵对于离体蛙心的强心作用并不明显,但不同浓度的尼奥林、附子灵对戊巴比妥钠所致心衰细胞具有明确的保护作用,能增强心肌细胞的搏动节律,提高细胞的存活率[15]。需要指出的是,3种单酯型生物碱作为附子有效性的质控指标,其是否具有明确的强心效果尚缺乏直接的药效学证据,尽管有一些构效关系分析[16]及含单酯型生物碱的提取物强心活性[17]的文献支持。上述结果提示,附子中不同组分的强心作用可能是多方面的,需要从细胞-器官-整体多层次、正常与病证多状态证实双酯型-单酯型-醇胺类原碱的活性差异。
从抗心律失常活性看,塔拉乌头胺是一种选择性的电压门控钾离子(Kv)通道阻断剂,通过占据选择性区域来抑制钾离子的流出,从而阻断Kv通道功能,具有保护心肌细胞活力的效应,发挥抗心律失常的作用[18]。课题组采用液质联用分析表明塔拉乌头胺在药材中的量约为0.1%,丰度较高,是否将其作为控毒成分的代表,值得深入研究。
从镇痛抗炎活性看,次乌头碱具有良好的镇痛抗炎活性,单酯型生物碱仍具有一定的镇痛活性,而进一步水解为醇胺类生物碱后,其镇痛作用几乎消失[19]。此外,宋果灵具有明确的镇痛作用,起效机制与体内阿片受体的特异结合有关[20]。
3.3 煎煮时间对制附片活性的影响分析综合上述信息,制附片本身毒性极低,减毒并非煎煮的主要目的。煎煮时间的长短对于汤剂化学成分群的组成比例具有一定影响,煎煮0.5~1.0 h后成分基本溶出,随后趋于稳定,长时间煎煮主要是丰度较高的单酯型生物碱向醇胺类原碱的转化。临床治疗过程中,制附片若以发挥镇痛抗炎作用为主,建议常规煎煮0.5 h即可;若以发挥强心作用为主,还需要对单酯型生物碱与醇胺类原碱的强心活性进行系统比较,方能确定久煎的必要性与科学性;此外,若临床超大剂量给予制附片,还应注意剂量因素对多个低毒成分累积性中毒的影响。
| [1] | 邓家刚,范丽丽.从对附子的争议来探讨有毒中药毒性问题[J].河南中医, 2010, 30(9):925-927. |
| [2] | 谢晓芳,彭成,易进海,等.附子不同炮制品提取物急性毒性的比较研究[J].中药与临床, 2012, 3(3):29-33. |
| [3] | 张学义.附子用量、煎法不同,功用也相异[J].中医杂志, 1992, 33(12):6-7. |
| [4] | 陈国恒.小量附子不必久煎[J].中医杂志, 1992, 33(12):5-6. |
| [5] | 考玉萍,张化为.大剂量食用附子安全性和有效性研究[J].陕西中医, 2013, 34(4):478-480. |
| [6] | 张宏,彭成,余成浩.附子煎煮时间、给药剂量与温阳功效的相关性研究[J].中国中药杂志, 2007, |
| [7] | 赵珊,王鹏程,冯健,等.代谢组学技术及其在中医药研究中的应用[J].中草药, 2015, 46(5):756-765. |
| [8] | 赵珊,王鹏程,冯健,等.代谢组学技术及其在中医药研究中的应用[J].中草药, 2015, 46(5):756-765. |
| [9] | 黄晓晨,宿树兰,郭建明,等.代谢组学在中医药若干科学问题研究中的应用与思考[J].中草药, 2014, 45(2):147-153. |
| [10] | 陈东安,易进海,黄志芳,等.附片指纹图谱研究及6种酯型生物碱含量测定[J].中国中药杂志, 2010, 35(21):2829-2833. |
| [11] | 张定堃,韩雪,周永峰,等.附子精标饮片的研制(I):规格大小与质量均一性研究[J].中国中药杂志, 2015, 40(17):3488-3495. |
| [12] | Bijlsma S, Bobeldijk I, Verheij E R, et al. Large-scale human metabolomics studies:a strategy for data(pre-) processing and validation[J]. Anal Chem, 2006, 78(2):567-574. |
| [13] | Bijlsma S, Bobeldijk I, Verheij E R, et al. Large-scale human metabolomics studies:a strategy for data(pre-) processing and validation[J]. Anal Chem, 2006, 78(2):567-574. |
| [14] | Slupsky C M, Rankin K N, Wagner J, et al. Investigations of the effects of gender, diurnal variation, and age in human urinary metabolomic profiles[J]. Anal Chem, 2007, 79(18):6995-7004. |
| [15] | 王璐,丁家昱,刘秀秀,等.附子中胺醇型二萜生物碱的鉴定及其强心活性研究[J].药学学报, 2014, 49(12):1699-1704. |
| [16] | Xiong L, Peng C, Xie X F, et al. Alkaloids isolated from the lateral root of Aconitum carmichaelii[J]. Molecules, 2012, 17(8):9939-9946. |
| [17] | 王慧玉,孙晖,陆欣,等.乌头属中药成分的构效关系研究进展[J].世界科学技术-中医药现代化, 2011, 13(6):1022-1026. |
| [18] | 王立岩,张大方,曲晓波,等.附子炮制前后有效部位强心作用的实验研究[J].中国中药杂志, 2009, 34(5):596-599. |
| [19] | Wang Y, Song M, Hou L, et al. The newly identified K+ channel blocker talatisamineattenuates beta-amyloid oligomers induced neurotoxicity in cultured cortical neurons[J]. Neuro Sci Lett, 2012, 518:122-127. |
| [20] | Nesterova Y V, Povet'yeva T N, Suslov N I, et al. Analgesic activity of diterpene alkaloids from Aconitum Baikalensis[J]. Bull Exp Biol Med, 2014, 157(4):488-491. |
| [21] | Nesterova Y V, Povet'yeva T N, Suslov N I, et al. Analgesic activity of diterpene alkaloids from Aconitum Baikalensis[J]. Bull Exp Biol Med, 2014, 157(4):488-491. |
 2016, Vol. 47
2016, Vol. 47


