2. 南京海昌中药集团有限公司 江苏省企业研究生工作站, 江苏 南京 210061
2. Graduate Workstation of Enterprises in Jiangsu Province, Nanjing Haichang Chinese Medicine Group Corporation, Nanjing 210061, China
气血双补酒是江苏省中医院名老中医孟景春教授的临床验方,是由人参、黄芪、当归、白芍、陈皮、玉竹、黄精、制首乌、枸杞子9味中药组成的复方制剂,具有补益气血、抗疲劳、增强免疫、抑制肿瘤生长,治疗和缓解糖尿病症状的作用,同时也具有扩张血管、抗急性心肌缺血、降血压、抗衰老等作用[1]。
目前,尚没有关于气血双补酒提取工艺的研究报道,而且用其中某一成分作为评价指标较为单一,很难全面地评价该制剂的提取工艺。为了建立更加全面的气血双补酒的提取工艺,提高其临床疗效,经查阅文献选取单味药中药效明显的成分,按君臣 佐使关系将人参皂苷Rb1、毛蕊异黄酮葡萄糖苷、阿魏酸、二苯乙烯苷、芍药苷、橙皮苷及浸出物的质量浓度分配权重系数综合评分,作为评价指标来考察影响渗漉提取工艺中乙醇体积分数、溶剂倍量、渗漉体积流量3个主要因素。考虑到影响渗漉提取工艺的因素皆为连续性变量,对于变量是连续性的多因素试验分析,Box-Behnken响应面法分析是最佳选择[2, 3]。因此,本实验引入Box-Behnken响应面法优选气血双补酒的渗漉提取工艺,为进一步开发利用该处方提供参考依据。
1 仪器与材料Shimadzu LC-20AD高效液相色谱系统,日本岛津公司,包括岛津LC-Solusion工作站、在线脱气机、SIL-20A自动进样器、SPD-20A紫外-可见光检测器、CTO-20A柱温箱;BS2242S电子天平,北京赛多利斯仪器系统有限公司;RE-52旋转蒸发仪,瑞士BUCHI公司。
人参皂苷Rb1、毛蕊异黄酮葡萄糖苷、阿魏酸、二苯乙烯苷、芍药苷、橙皮苷对照品购自南京森贝伽生物科技有限公司,批号分别为0762-131210、0460-130312、0001-131002、0362-130517、0834- 131089、0369-131023,上述对照品质量分数均≥98%。甲醇、氯仿、正丁醇,分析纯,南京化学试剂有限公司;乙腈,色谱纯,美国天地公司;水,杭州娃哈哈公司。
所用药材饮片购自南京海源中药饮片有限公司,并经南京中医药大学陈建伟教授鉴定,人参为五加科植物人参Panax ginseng C. A. Mey. 的干燥根和根茎,当归为伞形科植物当归Angelica sinensis (Oliv.) Diels. 的干燥根,黄芪为豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao. 的干燥根,白芍为毛茛科植物芍药Paeonia lactiflora Pall. 的干燥根,制首乌为蓼科植物何首乌Polygonum multiflorum Thunb. 干燥块根的加工炮制品,玉竹为百合科植物玉竹Polygonatum odoratum (Mill.) Druce的干燥根茎,黄精为百合科植物滇黄精Polygonatum kingianum Coll. et Hemsl. 的干燥根茎,陈皮为芸香科植物橘Citrus reticulata Blanco的干燥成熟果皮,枸杞子为茄科植物宁夏枸杞Lycium barbarum L. 的干燥成熟果实。
2 方法与结果 2.1 指标成分的定量测定 2.1.1 色谱条件色谱柱为Merck C18柱(250 mm×4.6 mm,5 μm);检测波长203 nm;柱温35 ℃;体积流量1.0 mL/min;进样量10 μL;流动相为乙腈-0.05%磷酸水溶液,梯度洗脱:0~12 min,1%~13%乙腈;12~16 min,13%~18 %乙腈;16~50 min,18%~31%乙腈;50~60 min,31%~42%乙腈;60~70 min,42%~90%乙腈;对照品及样品的色谱图见图 1。
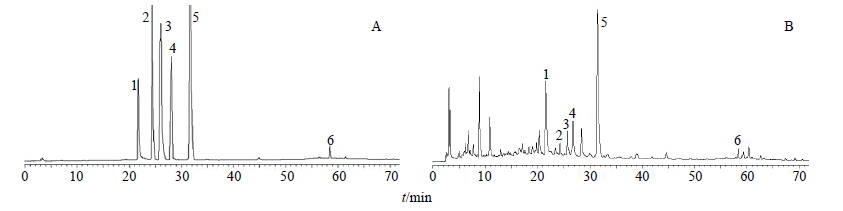 |
1-芍药苷 2-毛蕊异黄酮葡萄糖苷 3-二苯乙烯苷 4-阿魏酸 5-橙皮苷 6-人参皂苷Rb1 1-paeoniflorin 2-calycosin 7-O-β-D-glucopyranoside 3-stilbene glucoside 4-ferulic acid 5-hesperidin 6-ginsenoside Rb1 图 1 混合对照品 (A) 和气血双补酒样品 (B) 的HPLC图Fig. 1 HPLCof mixed reference substances (A) and Qixue Shuangbu Tinctura sample (B) |
称定,置10 mL量瓶中,加甲醇溶解并稀释至刻度,即得含人参皂苷Rb1 104.4 μg/mL、毛蕊异黄酮葡萄糖苷44.91 μg/mL、阿魏酸20.53 μg/mL、二苯乙烯苷89.07 μg/mL、芍药苷72.03 μg/mL、橙皮苷111.7 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备将各药材粉碎过24目筛,精密称量人参9 g、当归6 g、黄芪6 g、白芍6 g、陈皮3 g、黄精9 g、玉竹6 g、制首乌6 g、枸杞子6 g,平行称量17份,进行渗漉提取,收集渗漉液定容即得气血双补酒。精密量取酒样品50 mL,水浴蒸至无醇味,加入三氯甲烷振摇萃取2次,每次20 mL,弃去三氯甲烷液。水液加入水饱和正丁醇振摇萃取2次,每次20 mL,合并正丁醇液减压蒸干,残渣加甲醇溶解定容至5 mL量瓶中,摇匀,用0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.1.4 线性关系考察取“2.1.2”项下混合对照品溶液,按1、2、4、6、8、10、20 μL进样,在高效液相色谱仪上分析。结果表明,人参皂苷Rb1线性方程为Y=49 822 X+49 741,r=0.999 8,线性范围104.4~2 088.0 μg;毛蕊异黄酮葡萄糖苷线性方程为Y=761 212 X+39 459,r=0.999 9,线性范围44.91~898.20 μg;阿魏酸线性方程为Y=990 870 X-261 251,r=0.999 9,线性范围20.53~410.60 μg;二苯乙烯苷线性方程为Y=727 957 X+204 946,r=0.999 9,线性范围89.07~1 781.00 μg;芍药苷线性方程为Y=347 626 X+662 323,r=0.999 8,线性范围72.03~1 441.00 μg;橙皮苷线性方程为Y=2 000 000 X-356 284,r=0.999 9,线性范围111.7~2 234.0 μg。
2.1.5 精密度试验精密吸取混合对照品溶液10 μL,连续进样6次,记录HPLC色谱图。人参皂苷Rb1、毛蕊异黄酮葡萄糖苷、阿魏酸、二苯乙烯苷、芍药苷、橙皮苷的色谱峰面积RSD均小于1.4%,表明仪器精密度良好。
2.1.6 重复性试验取1号试验样品,制备6份供试品溶液,进行测定,记录HPLC色谱图。人参皂苷Rb1、毛蕊异黄酮葡萄糖苷、阿魏酸、二苯乙烯苷、芍药苷、橙皮苷的质量浓度RSD均小于1.9%,表明重复性良好。
2.1.7 稳定性试验取1号试验样品制备成的供试品溶液,分别在0、2、4、6、8、10、12、24 h进行HPLC色谱分析。人参皂苷Rb1、毛蕊异黄酮葡萄糖苷、阿魏酸、二苯乙烯苷、芍药苷、橙皮苷的色谱峰面积RSD均小于1.7%,表明供试品溶液在24 h内稳定。
2.1.8 加样回收率试验取1号试验样品50 mL,精密加入“2.1.2”项下混合对照品溶液2 mL,制备成供试品溶液,平行操作6份。进样测定,6种成分的平均回收率在99.56%~100.89%,RSD在1.24%~1.98%。
2.1.9 浸出物的测定精密移取“2.1.3”项下气血双补酒10 mL,置已干燥至恒定质量的蒸发皿中,水浴上蒸干后,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速精密称定质量。
2.2 单因素试验[4, 5]经查阅文献和预试验确定影响渗漉提取工艺的因素主要包括乙醇体积分数、溶剂倍量、渗漉体积流量,综合评分设定满分为100分,根据君臣佐使关系划分人参皂苷Rb1、毛蕊异黄酮葡萄糖苷、阿魏酸、二苯乙烯苷、芍药苷、橙皮苷及浸出物权重系数分别为30、15、15、10、10、10、10。在此基础上进行总加权评分,利用综合评分值(P)对试验结果进行分析:以Y表示试验中指标成分的测定值,以各指标的最大值(Ymax)作为参照对同一指标的各数据进行标准化处理,D表示试验中该指标成分测定值的标准化数据(D=Y/Ymax),综合评分P=D人参皂苷Rb1×30+D毛蕊异黄酮葡萄糖苷×15+D阿魏酸×15+D二苯乙烯苷×10+D芍药苷×10+D橙皮苷×10+D浸出物×10。
2.2.1 乙醇体积分数按照“2.1.3”项下方法称取一定量的复方组成的药材粉末,分别加入体积分数为30%、40%、50%、60%、70%的10倍量乙醇,以渗漉体积流量为2 mL/min提取,分别取一定量渗漉液同法制备成供试品溶液,按照“2.1.1”项下色谱条件测定,综合评分结果表明乙醇体积分数为40%~60%提取率最好,故选择乙醇体积分数50%作为中心点。
2.2.2 溶剂倍量在选择乙醇体积分数50%为中心点的基础上,按照“2.1.3”项下称取一定量的复方组成的药材粉末,分别加入6、8、10、12、14倍量乙醇,以渗漉体积流量为2 mL/min提取,分别取定量渗漉液同法制备成供试品溶液,按照“2.1.1”项下色谱条件测定,综合评分结果表明溶剂倍量为8~12倍最佳,故选10倍量溶剂为中心点。
2.2.3 渗漉体积流量在选择乙醇体积分数中心点为50%、溶剂倍量中心点为10倍量的基础上,分别以体积流量为0.5、1.0、1.5、2.0、2.5 mL/min渗漉提取,分别取定量渗漉液同法制备成供试品溶液,按照“2.1.1”项下色谱条件测定,综合评分结果表明渗漉体积流量1.0~2.0 mL/min最佳,故选渗漉速度1.5 mL/min为中心点。
2.3 响应曲面优化试验设计及结果[6, 7]根据Box-Behnken中心组合试验设计原理,综合单因素影响试验结果,选取乙醇体积分数(X1)、溶剂倍量(X2)和渗漉体积流量(X3)作为考察对象,采用Design Expert 8.0统计分析软件的响应面分析法安排试验,以获取最适工艺参数。采用3因素3水平的响应面分析法进行试验设计,试验设计与结果见表 1。
| 表 1 响应面法试验设计方案及结果 Table 1 Design and results of response surface method |
使用统计软件Design Expert 8.0对表 1中各指标性成分量的综合权重数据进行多元回归拟合,得到综合评分对编码自变量X1、X2、X3的二次多项回归方程Y=−721.018+15.569 X1+57.749 X2+169.005 X3+0.051 7 X1X2-1.275 X1X3-6.863 X2X3-0.013 92 X12-2.476 X22-14.775 X32。方差分析及回归系数显著性检验结果见表 2。所建立的二次多项式模型具有高度的显著性(P<0.001),模型决定系数R2=0.973 6,表明模型拟合度良好。将因变量与另外两因素拟合为三维曲面图,因只能表达含2个因素变量的函数,故固定3个因素之一为中值,将中心点值代入二次回归模型方程得到新方程,根据新模型方程得到响应面三维图,结果见图 2,经过中心组合设计优化提取条件,得到最佳提取工艺条件:乙醇体积分数为48.04%,溶剂倍量为10.12,渗漉体积流量为1.42 mL/min。
| 表 2 方差分析 Table 2Analysis of variance |
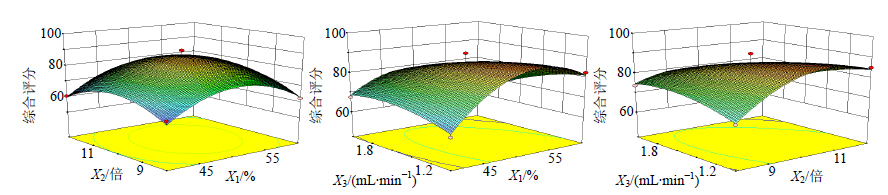 | 图 2 三维效应面图Fig. 2 3D response surface |
根据Design-Expert软件计算出最佳提取工艺为乙醇体积分数为48.04%,溶剂倍量为10.12,渗漉体积流量为1.42 mL/min,考虑实验条件可操作性,精密平行称定5份一定比例复方药材粉末按乙醇体积分数为48%,溶剂倍量为10,渗漉体积流量为1.4 mL/min检验试验结果的可靠性,综合评分结果见表 3,与理论值的相对误差为2.5%,说明验证值与回归方程预测值吻合较好,优化后的渗漉提取工艺对实际工业生产具有一定的指导意义。
| 表 3 提取工艺验证结果 Table 3 Varification of extracting process |
对于评价指标及权重系数的选择依据,君药人参补气养血,其有效成分主要为人参皂苷;臣药为具有补血功效的当归和具有补气作用的黄芪,其指标性成分分别为阿魏酸、毛蕊异黄酮葡萄糖苷;佐药为制首乌、黄精、白芍、玉竹、枸杞子;使药为具有行气、引药入经作用的陈皮。复方中玉竹、黄精、枸杞主要成分为多糖,植物多糖具有较强抗疲劳、增强免疫作用,且浸出物是中药复方的药效物质基础,浸出物量的变化会影响有效成分的量,并最终影响药物的临床疗效[8]。故按君臣佐使关系对所选取指标成分进行权重系数分配,使得用综合评分去评价提取工艺更加合理,且能全面反映提取物有效成分的信息,更符合中医用药的整体观。
本实验对渗漉提取工艺中乙醇体积分数、溶剂倍量、渗漉速度3个因素进行考察,但这3个因素皆为连续性变量,对于变量是连续性的多因素试验分析,Box-Behnken响应面法分析是最佳选择。Box- Behnken响应面法通过非线性模型拟合得出最优提取条件更接近客观实际,避免了传统的正交设计和均匀设计法的不足,具有实验精度高、模型预测性好的优点,为气血双补酒工业化大生产提供科学的依据。
| [1] | Chen L W, Qin K M, Wang Q, et al. Determination of major and minor elements in Qixue Shuangbu Tincture by ICP-AES with microwave digestion [J]. Lat Am J Pharm, 2015, 34 (2): 370-376. |
| [2] | 吴 振, 李 红, 陈 岗, 等. 星点设计-响应面优化大黄酚葡聚糖复合物的制备工艺 [J]. 中草药, 2014, 45(11): 1540-1544. |
| [3] | 周 欣, 陈华国, 黄志金, 等. 响应面法优选虎耳草抗前列腺癌活性部位提取工艺 [J]. 中草药, 2013, 44(13): 1768-1773. |
| [4] | Banerjee C, Singh R, Jha A, et al. Effect of inulin on textural and sensory characteristics of sorghum based high fibre biscuits using response surface methodology [J]. J Food Sci Technol, 2014, 51(10): 2762-2768. |
| [5] | 鲁劲松, 王红芬, 李云霞. 藿香正气水中陈皮渗漉工艺的优化 [J]. 中草药, 2014, 45(8): 1096-1101. |
| [6] | Xu Q, Shen Y, Wang H, et al. Application of response surface methodology to optimise extraction of flavonoids from fructus sophorae [J]. Food Chem, 2013, 138(4): 2122-2129. |
| [7] | 林小玲, 田成旺, 张铁军. 星点设计-效应面法优选参芪消岩颗粒渗漉提取工艺 [J]. 中草药, 2013, 44(4): 430-433. |
| [8] | Lu J M, Yao Q, Chen C. Ginseng compounds: An update on their molecular mechanisms and medical applications [J]. Curr Vasc Pharmacol, 2009, 7(3): 293-302. |
 2015, Vol. 46
2015, Vol. 46


