2. 云南信通植物药业有限公司, 云南 蒙自 661100;
3. 云南农业大学, 云南 昆明 605201;
4. 江苏省中国科学院植物研究所, 江苏 南京 210014
2. Yunnan Xintong Botanic Pharmaceutical Co., Ltd., Mengzi 661100, China;
3. Yunnan Agricultural University, Kunming 605201, China;
4. Jiangsu Institute of Plant, Chinese Academy of Sciences, Nanjing 210014, China
通关藤Marsdenia tenacissima (Roxb.) Wight et Arn. 为萝藦科(Asclepiadaceae)牛奶菜属Marsdenia R. Br. 植物[1],始载于《滇南本草》,称奶浆藤,具有通乳、利尿、祛痰、清火的功效,我国主要分布于云南、贵州、广西、四川等地[2],其主要含有甾体皂苷、黄酮、多糖、生物碱及油脂等化学成分[3, 4, 5, 6, 7]。目前,国内外学者对于通关藤的研究主要集中在化学成分、药理作用[8, 9, 10]以及分子生物学和资源的差异化鉴别[11, 12, 13]等方面,而对通关藤种子的研究尚未见文献报道。本实验通过研究通关藤种子的萌发特性,了解通关藤的生长发育规律,以期为通关藤的人工栽培育种以及规范化种植提供科学依据。
1 材料和方法 1.1 材料本实验所用材料通关藤种子采自云南省文山壮族苗族自治州马关县(2013年3月),经南京农业大学中药材研究所郭巧生教授鉴定为通关藤Marsdenia tenacissima (Roxb.) Wight et Arn. 的种子,于(4.0±0.5)℃冰箱贮藏备用。
1.2 方法 1.2.1 适宜发芽床的确定选取饱满、大小一致的通关藤种子,室温条件下自来水浸种24 h,吸水纸吸干种子表面水分,分别置种于以下5个发芽床,(1)纸上:在发芽盒中铺2层湿润的滤纸,然后放置种子;(2)纸间:发芽盒中放入2层湿润的滤纸褶纸,于褶沟处放入种子;(3)棉上:发芽盒中铺入湿润的1层棉纱,然后放置种子;(4)棉间:发芽盒中铺入湿润的1层棉纱,然后放置种子,于种好的种子上盖1层湿润的棉纱;(5)砂中:发芽盒中铺入4 cm厚的湿润细砂(砂水体积比为4∶1),然后放置种子。于30 ℃恒温条件作3 300 lx光照(16 h光照,8 h黑暗)发芽。
1.2.2 适宜浸种时间的确定选取饱满、大小基本一致的通关藤种子,室温条件下自来水浸种0、12、24、36 h,吸水纸吸干表面水分。以上述砂中为发芽床,于30 ℃恒温条件作3 300 lx光照(16 h光照,8 h黑暗)发芽。
1.2.3 适宜发芽温度的确定选取饱满,大小一致的通关藤种子,室温条件下自来水浸种24 h,吸水纸吸干种子表面水分,以砂中为发芽床,分别于15、20、25、30、35 ℃,3 300 lx光照(16 h光照,8 h黑暗)条件下,恒温培养。
1.2.4 发芽光照的确定经室温条件下自来水浸种24 h,吸水纸吸干种子表面水分。以砂中为发芽床,于30 ℃恒温条件下作3 300 lx光照(16 h光照,8 h黑暗)和24 h全黑暗处理。
1.2.5 发芽适宜pH值的确定选取饱满、大小一致的通关藤种子,室温条件下自来水浸种24 h,吸水纸吸干种子表面水分,分别置于pH值为4、6、7、8、10的砂中,以自来水(pH值为7.5)浸润砂床为对照(CK),于30 ℃恒温条件下,3 300 lx光照(16 h光照,8 h黑暗)发芽。
以上发芽试验,每处理3次重复,每重复100粒种子。
1.3 指标测定 以种子根茎处胚芽伸出2mm时的天数作为初次计数时间,以种子萌发数达到最高,以后再无萌发种子出现时的天数作为末次计数时间。4 d时统计发芽势,10 d时统计发芽率、发芽指数、根茎长以及分根数。
种子发芽势=发芽高峰时正常发芽种子数/供试种子数
种子发芽率=正常发芽种子粒数/供试种子数
种子发芽指数=∑Gt/Dt
Gt为在第t天的发芽种子数,Dt为相应的发芽天数
1.4 数据分析采用Microsoft Excel 2007软件对数据进行处理和绘图,采用SPSS Statistics 20.0分析软件对数据进行差异显著性检验。统计的数据均以3次重复的x±s表示。
2 结果与分析 2.1 发芽床对种子萌发的影响由表 1可知,通关藤种子在纸床、棉床、砂床上均能发芽,且发芽率都在80.00%以上。可见,纸床、棉床、砂床都比较适合通关藤种子萌发。砂床的发芽势及发芽率最高,纸上与棉间的发芽势及发芽率其次,纸间的发芽率和发芽势都最低。由表 1可知,砂床与纸床和棉床之间的发芽势、发芽率、发芽指数等都存在显著性差异,尤其是发芽势和发芽率以及分根数,砂床明显优于纸床和棉床。
| 表 1 不同发芽床通关藤种子发芽情况(x±s,n=3) Table 1 Seed germination of M. tenacissima under different ground substances (x±s,n=3) |
由表 2可知,浸种12 h和24 h的种子发芽势和发芽率都显著提高,浸种24 h的发芽率最高,根茎长以及分根数都明显增加;浸种36 h的种子,发芽势和发芽率都显著低于浸种12、24 h,且比浸种0 h的种子发芽率和发芽势都低。
| 表 2 浸种时间对通关藤种子发芽的影响(x±s,n=3) Table 2 Effects of different soaking times on seed germination of M. tenacissima (x±s,n=3) |
由表 3可知,10 ℃处理下的通关藤种子几乎不发芽;15 ℃时,发芽势和发芽率分别为14.00%和58.00%;20 ℃时,发芽势和发芽率分别为42.67%和88.67%;25 ℃时,发芽势和发芽率分别为80.00%和91.67%;在30 ℃时,发芽率、发芽势最高,都在90.00%以上;35 ℃时,发芽势和发芽率分别为20.00%和50.00%。方差分析表明,在20~30 ℃内,种子发芽率不存在显著性差异,但是发芽势以及分根数的差异显著。
| 表 3 不同温度通关藤种子发芽情况(x±s,n=3) Table 3 Seed germination of M. tenacissima under different temperatures(x±s,n=3) |
由图 1可知,15 ℃时,9 d发芽率方可达到稳定状态;20 ℃时,发芽率8 d可达到稳定状态;25 ℃时,发芽率7 d可达到稳定状态;30 ℃时,发芽率4 d即可达到稳定状态;35 ℃时,发芽率7 d达到稳定状态。20~30 ℃不同温度处理下的种子最终发芽率的差别不大,但是在前4 d的发芽势上明显有很大差异。
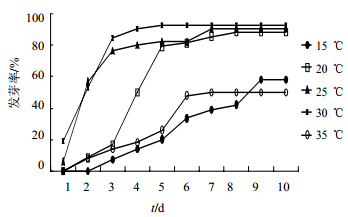 | 图 1 不同温度下通关藤种子的发芽率与时间的关系Fig. 1 Relationship between seed germination rate and time of M. tenacissima under different temperatures |
由图 2可知,10 ℃时,光照和黑暗处理下,通关藤种子发芽率都为0;15~35 ℃,相同条件处理下的通关藤种子在光照条件下的发芽率都高于黑暗条件下的发芽率。15、20、35 ℃时,黑暗处理和光照处理下的通关藤种子发芽率差异显著;25、30 ℃处理下的种子的发芽率差异不显著。
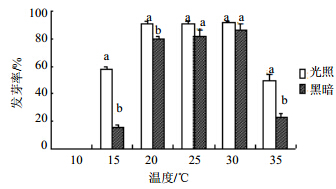 | 图 2 光照对通关藤种子发芽率的影响Fig. 2 Effects of different illumination conditions on seed germination of M. tenacissima |
由表 4可见,pH值4~10内,通关藤种子的发芽率随pH值的增加呈先上升后下降的趋势。pH值为7时,与CK(pH为7.5)的发芽势和发芽率差异不大,根茎长有显著差异;在pH值<7.0时,即环境为酸性时,根茎长以及分根数与CK都有一定的差异;而当pH值>7.0时,即环境为碱性时,种子最终都发生烂根、烂叶的情况,以至于最终统计的发芽率为发芽中期的发芽率,而发芽结束时,几乎没有存活的种子。
| 表 4 不同pH值对通关藤种子萌发的影响(x±s,n=3) Table 4 Effects of different pH values on seed germination of M. tenacissima (x±s,n=3) |
研究表明,通关藤种子在砂床处理下的发芽势、发芽率、发芽指数以及根茎长、分根数都明显高于纸床和棉床。这可能是由于通关藤种子个体较大,大粒种子往往只有与滤纸和棉床接触的部分可以吸收到水分,从而影响种子的正常发芽,而在砂床中的种子为半覆盖状态,能够从各个面上吸收到水分,且砂床的空隙大,有利于种子的呼吸作用。水分以及透气性是种子萌发初期的必需因素,故砂床更适合通关藤种子的萌发。
3.2 浸种时间对通关藤种子萌发的影响通关藤种子外围有一层坚硬的种皮,适当的浸种处理可以使得种子吸胀,从而使得种皮软化,改变其渗透势[14],提供足够的氧气而促进种子的发芽。同时,浸种时间过长可能会使得种子的细胞壁过分吸水,使得种子内水分过多而引起一些活力较差的种子因为缺氧而霉烂,所以使得发芽率和发芽势都明显下降。
3.3 温度对通关藤种子萌发的影响通过对通关藤种子的不同温度发芽处理,结果显示,15 ℃处理的种子发芽最差,30 ℃处理的通关藤种子发芽最好,即高温处理有利于通关藤种子萌发,这与自然状态下,通关藤种子在夏季气温30 ℃左右时出苗并旺盛生长的规律是相一致的。这可能是由于通关藤主要分布在亚热带地区[15],长期在高温环境下生长,因此种子对于较高的温度具有更好的适应性[16]。
3.4 光照对通关藤种子萌发的影响通关藤种子光照培养下的发芽势和发芽率显著高于黑暗条件。有学者研究[17],光照对于种子萌发的影响是依据种子的性质而定的,一些情况下,光照可以促进种子萌发,比如链荚豆、无芒虎尾草等,这样的种子称为需光型种子;而有的时候,光照反而会抑制种子萌发,只有黑暗环境才能促进种子萌发,比如地三叶等,这样的种子称为光敏型种子[18]。本实验表明,在适宜温度下,通关藤种子的发芽率受光照条件的影响较小;温度不适时,光照为影响种子发芽的主要因素。同时表明,通关藤种子是需光型种子,光照对幼苗胚根生长、子叶伸长和子叶转绿都有显著影响,但光照不是影响通关藤种子发芽率的主要因素。在实际应用生产中应该结合30 ℃温度并配合光照条件较适宜通关藤种子萌发。
3.5 pH值对通关藤种子萌发的影响本实验可以看出,通关藤种子的生长发育与土壤环境关系密切。相关研究表明[19],良好的土壤环境对植物尤其是种子萌发初期,影响植物从土壤吸收营养物质。土壤的酸碱性对种子的表皮活性有一定的影响[20],从而影响种子的发芽率以及出苗的质量。本实验可以看出,pH值对通关藤种子的发芽有一定的影响。实验结果表明,碱性环境比酸性的环境对通关藤种子的伤害更大,通光藤种子在碱性环境下的存活时间不超过5 d。
能使种子在最短时间具有最高发芽率的条件就是种子发芽的最适条件。从以上实验可知,通关藤种子的最佳发芽条件为浸种24 h、30 ℃、pH 7.0~7.5的砂床环境下3 300 lx光照培养。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 周海钧. 中国民族药志 [M]. 北京: 人民卫生出版社, 2006. |
| [3] | Luo S Q, Lin L Z, Cordell G A, et al. Polyoxypregane from Marsdenia tenacissima [J]. Phytochermistry, 1993, 34(6): 1615-1620. |
| [4] | Mohammed A. A new homotriterpene from the roots of Marsdenia tenacissima [J]. Pharmazie, 2004, 59(9): 735-736. |
| [5] | Deng J, Liao Z X, Chen D F. Two new C21 steroidal glycosides from Marsdenia tenacissima [J]. Chin Chem Lett, 2005, 16(4): 487-490. |
| [6] | 杨 梅, 王文兰, 吴 昊, 等. 通关藤中孕甾醇苷类成分 [J]. 中草药, 2011, 42(8): 1473-1476. |
| [7] | 马明芳, 丁克毅, 丁立生, 等. 通关藤的化学成分 [J]. 中草药, 2009, 40(2): 183-186. |
| [8] | 陈 兵, 李翠萍, 欧阳健, 等. 通关藤提取物体外对人正常免疫细胞及干细胞的影响 [J]. 临床肿瘤学杂志, 2010, 15(10): 887-890. |
| [9] | Huang Z Q, Tan H, Wang C Y, et al. Clinical research of combined xiaoaiping injection with chemotherapy on advanced non-small cell lung cancer [J]. Chin Clin Oncol, 2007, 4(12): 97-99. |
| [10] | Wang W Y, Zhou Y, Zhang X J, et al. A random study of xiao-ai-ping injection combined with chemotherapy on the treatment of advanced non-small cell lung cancer [J]. Chin Clin Oncol, 2009, 3(14): 936-938. |
| [11] | Li C, Yang S C, Guo Q S, et al. Determining the geographical origin of the medicinal plant Marsdenia tenacissima with multi-element analysis and data mining techniques [J]. Chem Intel Lab Syst, 2014, 136(15): 115-120. |
| [12] | Zheng K Y, Zhang G H, Jiang N H, et al. Analysis of the transcriptome of Marsdenia tenacissima discovers putative polyoxypregnane glycoside biosynthetic genes and genetic markers [J]. Genomics, 2014, 104(3): 186-193. |
| [13] | Li C, Guo Q S, Yang S C, et al. Determination of multiple elements in samples of the medicinal plant Marsdenia tenacissima and estimation of geographic origin via pattern recognition techniques [J]. J Nat Med, 2014, doi: 10.1007/s11418-014-0860-x. |
| [14] | 张春平, 何 平, 杜丹丹, 等. 决明子种子硬实及萌发特性研究 [J]. 中草药, 2010, 41(10): 1700-1704. |
| [15] | 郑景云, 尹云鹤, 李柄云. 中国气候区划新方案 [J]. 地理学报, 2010, 65(1): 4-12. |
| [16] | 蔡传涛, 兰芹英, 刘洪茂, 等. 灯台树种子萌发特性研究 [J]. 中草药, 2004, 35(1): 86-88. |
| [17] | 任祝三. 双子叶植物中的光敏种子及其生物学特性 [J]. 云南植物研究, 1992, 14(2): 169-178. |
| [18] | 国际种子检验规程 [S]. 1999. |
| [19] | 鱼小军, 师尚礼, 龙瑞军, 等. 生态条件对种子萌发影响研究进展 [J]. 草业科学, 2006, 23(10): 44-49. |
| [20] | 马成仓, 洪法水. pH对油菜种子萌发和幼苗生长代谢的影响 [J]. 作物学报, 1998, 24(8): 509-512. |
 2015, Vol. 46
2015, Vol. 46


