2. 解放军第三〇二医院全军中医药研究所, 北京 100039;
3. 解放军第三〇二医院 药学部, 北京 100039;
4. 首都医科大学附属北京友谊医院, 北京 100050;
5. 中国中医科学院 中药资源中心, 北京 100070
2. China Military Institute of Traditional Chinese Medicine, 302 Military Hospital, Beijing 100039, China;
3. Department of Pharmacy, 302 Military Hospital, Beijing 100039, China;
4. Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China;
5. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100070, China
雷公藤为卫矛科植物雷公藤Tripterygium wilfordii Hook. f. 的干燥根,性苦、寒,临床上多用于治疗类风湿性关节炎,现代研究发现其抗炎镇痛效果显著,有类激素样治疗效果,且无激素的不良反应,广泛用于治疗类风湿性关节炎等自身免疫性疾病,见效快,疗效确切,几乎没有可以完全替代的类似中药[1]。雷公藤全株有毒,其毒性最早记载于《本草纲目拾遗》,为中国植物图谱数据库收录的有毒植物,表现为对肝、肾、心功能有比较严重的毒副反应[2, 3, 4]。近年来雷公藤引起的毒性反应事件被频繁报道,为临床常见的致肝损害中草药之一[5, 6, 7, 8]。
临床上中药肝损害的发生与患者个体差异以及中药质量关系密切。研究发现,雷公藤致肝损害并不是在所有患者身上都发生,较多研究表明雷公藤治疗类风湿性关节炎是较为安全的[9, 10, 11],但同时雷公藤致肝损害也不在少数。雷公藤在南方还存在地方习用品昆明山海棠Tripterygium hypoglaucum (Lévl.) Hutch.。不同产地来源的雷公藤是否由于质量差异导致不同强度的毒性,因而引发临床肝损害,针对这个问题,本研究根据第4次全国中药资源普查提供的样品,尝试建立雷公藤肝细胞毒价检测方法,对雷公藤主要产区的药材样品及同属植物昆明山海棠的毒性进行评价,以期更准确地表征雷公藤药材的肝毒性作用,为提高其质量控制水平和临床安全用药提供参考依据。
1 材料 1.1 药物与试剂采用第4次全国中药资源普查采集或采购的来自不同产地的18批雷公藤和5批昆明山海棠样品。本实验所有产地采集的样品均采挖于秋季(10月),就地干燥,经解放军第三〇二医院全军中医药研究所肖小河研究员鉴定分别为雷公藤Tripterygium wilfordii Hook. f. 和昆明山海棠Tripterygium hypoglaucum (Lévl.) Hutch. 的干燥根。样品信息见表 1。
| 表 1 雷公藤及昆明山海棠药材来源 Table 1 Sample sources of T. wilfordii and T. hypoglaucum |
Cell Counting Kit-8(CCK-8,日本同仁化学研究所,批号EW728),对乙酰氨基酚(批号100020-200405)购自中国食品药品检定研究院。
1.2 仪器SynergyTM HT多功能酶标仪(美国BioTek公司),实时细胞分析仪(美国Roche公司),E-plate 16检测板(美国Roche公司),IX71型倒置显微镜(日本Olympus公司),AL204微量分析天平(瑞士Mettler Toledo公司),KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司),旋转蒸发仪(德国Heidolph公司),ZK-82B型真空干燥箱(上海市实验仪器总厂),恒温二氧化碳培养箱(美国NAPCO公司)。
1.3 细胞系人正常肝细胞L02细胞系购自中国典型培养物保藏中心,在含有10%胎牛血清的RPMI 1640培养基中,37 ℃、5% CO2进行常规培养,实验均在细胞生长对数期进行。
2 方法 2.1 提取方式的考察将雷公藤药材粉碎,取3份雷公藤粗粉适量,置于3个磨口锥形瓶中。分别加入10倍量75%乙醇,浸泡30 min。其中1份超声处理(功率300 W,频率40 kHz)30 min;1份回流提取30 min;1份冷浸30 min,均提取1次。提取液进行抽滤,减压回收溶剂,真空干燥,得干浸膏,计算得率,备用。
2.2 提取溶剂的考察将雷公藤药材粉碎,取同1批次雷公藤粗粉3份适量,置于3个磨口锥形瓶中,分别加入10倍量95%、75%、50%的乙醇,浸泡30 min,超声处理30 min,提取液进行抽滤,减压回收溶剂,真空干燥,得干浸膏,计算得率,备用。
2.3 细胞生长曲线的测定将L02细胞以1.40×105/mL接种在E-16-plate检测板上,倍比稀释成7.00×104、3.50×104、1.75×104、8.75×103、4.38×103、2.22×103/mL,每个浓度设2个复孔。采用实时细胞分析仪(real-time cell analyzers,RTCA),每20 分钟检测1次。E-16-plate检测板底部具有微电极点阵传感器,细胞贴附于电极后,细胞生长在其上可产生细胞阻抗。若细胞状态如细胞数目、细胞形态及贴壁状态等发生变化,会使E-16-plate检测板底的电流环路电阻相应发生改变。其中电阻与细胞指数(cell index,CI)值具有相关性,通过xCELLigence系统追踪细胞变化情况[9, 10, 11],进行记录。
2.4 药物作用时间的确定雷公藤药材溶解度较差,因此加入适量的DMSO进行溶解,通过对一系列体积分数(4.800%、2.400%、1.200%、0.600%、0.300%、0.150%、0.075%)DMSO进行考察,发现DMSO体积分数为0.3%时能很好地溶解药物,并且对细胞生长无影响,因此选择加入0.3% DMSO溶解雷公藤药材。将L02细胞以3.5×104/mL接种于96孔细胞培养板中,每孔200 μL,在常规条件下培养24 h后,吸弃上清,将雷公藤提取物以生药量的5.000、2.500、1.250、0.625、0.313、0.156 mg/mL给药,每孔200 μL。分别作用12、24、48 h,采用CCK-8法检测样品对细胞生长的抑制率[12],每个时间点设6个复孔。
2.5 雷公藤肝细胞毒价检测将所配雷公藤样品溶液和对乙酰氨基酚对照品溶液,按1∶0.65的间距稀释,以对乙酰氨基酚对照品溶液为对照组(S),不同产地雷公藤样品溶液为供试品组(T),分别测定对照品和供试品对肝细胞的毒性。首先定义对乙酰氨基酚毒价为400 U/g,将对照品溶液和供试品溶液各设高、低剂量组,随机区组设计实验,每个样品平行设5个复孔,以细胞抑制率为效应指标。按照《中国药典》(二部)2010年版附录XIV生物检定统计法项下的量反应平行线法(2∙2)检测雷公藤毒性效价[13]。
2.6 数据统计分析数据组间比较采用SPSS 13.0统计软件进行分析,毒价检测采用国家药典委员会编制的《中国药典生物检定统计程序BS2000》计算。
3 结果 3.1 药材不同提取方式提取效果比较比较回流提取法、超声提取法、冷浸提取法3种常用的提取方法,结果表明不同提取方法得到的样品对肝细胞的抑制作用差异较大(图 1),对肝细胞的抑制作用强度为超声提取>回流提取>冷浸提取,超声提取显著高于回流、冷浸提取(P<0.05)。因此选择超声提取法对药材进行提取,可更完整地体现雷公藤的肝毒性强度。
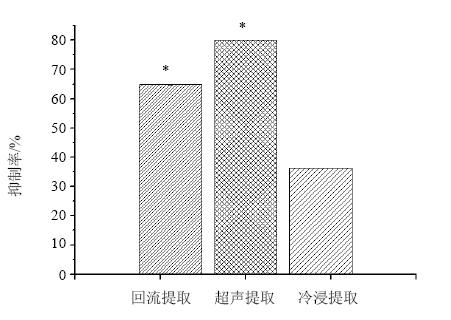 | 与冷浸提取比较:*P<0.05*P < 0.05 vs cold soak extraction图 1 不同提取方法对雷公藤提取物L02细胞抑制作用的影响Fig. 1 Effect of T. wilfordii extract by different extracting methods on inhibition against L02 cells |
比较不同体积分数(95%、75%、50%)乙醇提取的雷公藤提取物对L02细胞生长抑制作用,结果表明用50%乙醇提取时,雷公藤提取物对肝细胞的毒性最大,经方差分析显示,50%乙醇与75%乙醇提取差异不大(P>0.05),与95%乙醇提取相比有显著性差异(P<0.05),考虑到用50%乙醇提取药材更经济,因此选择50%乙醇提取药材。结果见图 2。
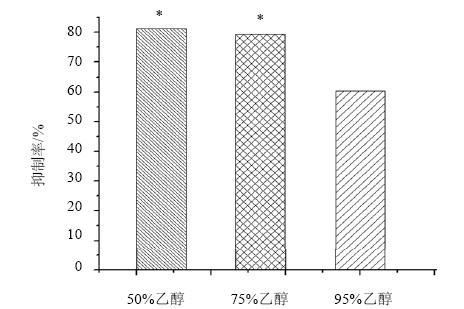 | 与95%乙醇提取比较:*P<0.05*P < 0.05 vs 95% ethanol extraction图 2 不同提取溶剂对雷公藤提取物L02细胞抑制作用的影响Fig. 2 Effect of T. wilfordii extract from different extracting solvents on inhibition against L02 cells |
不同浓度细胞生长曲线见图 3,一般选择在细胞的对数生长期进行药物干预,并且其CI为1左右时更为合适。因此当细胞浓度为1.4×105/mL及7×104/mL时,细胞增长过快,其最佳给药时间在10 h左右,不利于实验时间的安排。当细胞浓度为3.5×104/mL时,最佳给药时间为24 h左右。随着细胞浓度减小,给药时间延长,导致实验周期过长。故选择细胞浓度为3.5×104/mL。
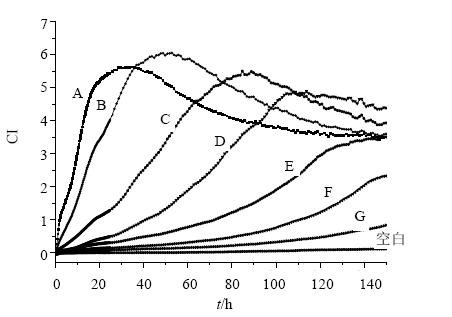 | A-1.40×105∙mL-1 B-7.00×104∙mL-1 C-3.50×104∙mL-1 D-1.75×104∙mL-1 E-8.750×103∙mL-1 F-4.380×103∙mL-1 G-2.22×103∙mL-1图 3 不同接种密度的细胞生长状态曲线Fig. 3 Growth curves of different inoculation density of L02 cells |
不同药物干预时间对细胞抑制作用结果见图 4,细胞抑制率随着药物干预时间的增加而增加,药物孵育24 h与药物孵育12、48 h相比,呈现出更好的量效关系,故选择药物作用时间为24 h。
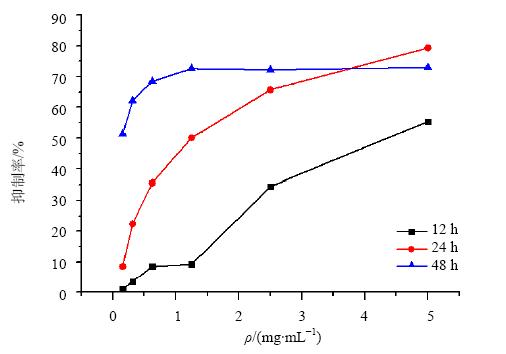 | 图 4 不同作用时间对雷公藤提取物L02细胞抑制作用的影响Fig. 4 Effect T. wilfordii extract indifferent treatment times on inhibition of against L02 cells |
本实验检测了资源普查从16个产地和药材市场收集的18份雷公藤样品和5份昆明山海棠样品的生物毒价,药材采集涉及了雷公藤主要的生产产地及
部分市场采集的药材,在一定程度上较全面地代表了雷公藤药材的实际情况。毒价检测结果(图 5)表明,雷公藤样品肝细胞毒价在17.78~4 131.4 U/g,昆明山海棠样品肝细胞毒价在209.42~7 422.2 U/g。进一步比较不同产地雷公藤样品毒价高低相差超过200倍,昆明山海棠样品毒价高低相差超过30倍,说明不同产地雷公藤及昆明山海棠药材毒价差异很大,其可能的原因为雷公藤种植区域广泛、生产加工储存等因素的影响。此外,产地采集的鲜品雷公藤毒性显著大于市场采集的雷公藤干货样品,即鲜品较干品的毒性大,提示雷公藤储存时间延长可能会降低其毒性。
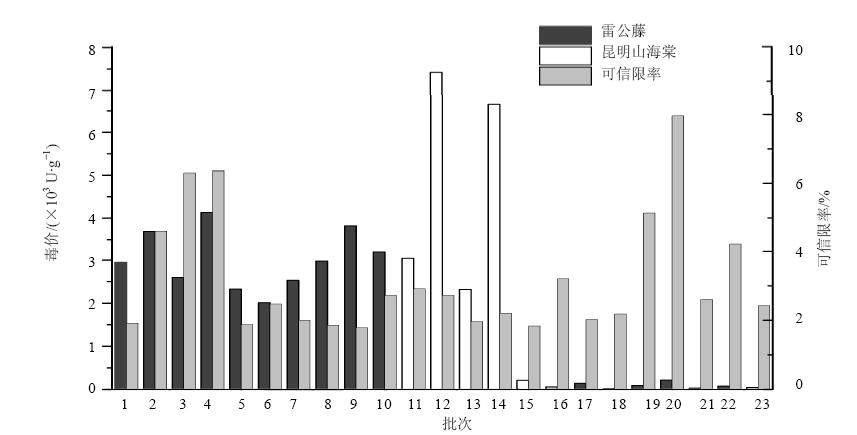 | 图 5 不同产地雷公藤及昆明山海棠药材肝细胞毒价Fig. 5 Hepatotoxic potency of T. wilfordii and T. hypoglaucum from different sources |
药材质量是保证临床疗效和安全性的重要前提。雷公藤因其药材来源广泛、生长环境差异大、生产加工工艺的不同,可能造成药材的质量参差不齐,因而可能导致临床毒副反应发生。服用雷公藤造成肝损伤主要与用药剂量、不同给药部位及给药时间均密切相关。雷公藤有效剂量与中毒剂量接近,并且当前研究结果表明雷公藤有效成分同时又是毒性成分且治疗窗较窄[14, 15],导致其毒性不易控制,药效不稳定,并且雷公藤药材总毒性成分难以去除或降低,据临床观察雷公藤的毒副反应发生率可达50%[16, 17]。雷公藤全植物均有不同程度的毒性,其芽、叶、花和根皮中有毒成分的量最高,据文献报道以嫩芽及叶的毒性最强,花次之,根皮再次之,木质部最小;将不同季节采收的雷公藤提取物进行小鼠急性毒性实验,结果发现夏季采收的毒性较大,以秋季采收毒性相对较小[18, 19]。本研究发现,不同产地的雷公藤药材的肝细胞毒性大小差异显著,毒价高低相差200余倍,并且其同属地方习用品昆明山海棠的毒性比雷公藤相对更高。同时发现产地采集的鲜品雷公藤毒性显著大于市场采集的雷公藤干货样品,即鲜品较干品的毒性大。这些结果提示由于雷公藤质量不同,可能对其临床应用的安全性带来巨大影响。加强雷公藤毒副反应相关的质量控制,对提高雷公藤临床用药安全具有重要意义。
雷公藤所含成分较复杂,目前对雷公藤肝毒性物质基础的研究尚不深入,主要集中在雷公藤甲素[20, 21],而对其他化学成分研究较少。中药的药效和毒性是其内含物质群整体协同作用的结果,雷公藤甲素与雷公藤中其他成分的毒性差异、构毒关系尚不清楚,加强雷公藤肝毒性物质基础的研究十分必要。本实验建立的基于肝细胞毒价检测的雷公藤质量评价方法,直接关联其临床肝脏毒副反应,对从质量控制角度提高雷公藤临床用药安全具有参考价值。进一步以生物毒价为评价指标,找到高效低毒的药材资源,明确雷公藤毒性物质基础、功效物质基础以及二者之间的关系,合理利用炮制、配伍等降低其毒性,对于保证雷公藤安全有效地用药具有重要意义。
| [1] | 薛 璟, 贾晓斌, 谭晓斌, 等. 雷公藤的肝毒性研究及ADME/Tox评价思路 [J]. 中草药, 2009, 40(4): 655-658. |
| [2] | 冯 群, 栾永福, 孙 蓉. 基于功效和物质基础的雷公藤毒性研究进展 [J]. 中国药物警戒, 2013, 10(2): 88-92. |
| [3] | 黄郑隽, 阙慧卿, 朱 惠, 等. 雷公藤甲素对生殖系统毒性的研究进展 [J]. 药物评价研究, 2013, 36(3): 224-227. |
| [4] | 马伟光, 张 滔, 张 超, 等. 有毒药物雷公藤的研究及展望 [J]. 中华中医药杂志, 2006, 21(2): 117-120. |
| [5] | 柴 智, 周文静, 高 丽, 等. 雷公藤肝毒性及其作用机制的研究进展 [J]. 中国实验方剂学杂志, 2011, 17(7): 243-246. |
| [6] | 丁 虹, 吴建元, 童 静, 等. 雷公藤甲素急性毒性及其机制研究 [J]. 中药材, 2004, 27(2): 115-118. |
| [7] | 强春倩, 刘世任, 都本敏. 雷公藤药理研究进展 [J]. 中国中医急症, 2006, 15(2): 198-199. |
| [8] | 张 静, 江 莹, 王 芳, 等. 基于"异类相制"理论探讨雷公藤肝毒性配伍减毒的作用 [J]. 中草药, 2014, 45(18): 2711-2715. |
| [9] | 谷 颖. 雷公藤在免疫性疾病治疗中的临床应用 [J]. 中国医药指南, 2011, 28(9): 241-242. |
| [10] | 郭梦如, 何东仪. 雷公藤治疗类风湿关节炎的研究进展 [J]. 风湿病与关节炎, 2013, 2(2): 58-62. |
| [11] | 向 明, 张程亮. 雷公藤免疫抑制作用研究进展 [J]. 中草药, 2005, 36(3): 458-461. |
| [12] | 熊建文, 肖 化, 张镇西. MTT法和CCK-8法检测细胞活性之测试条件比较 [J]. 激光生物学报, 2007, 16(5): 559-562. |
| [13] | 中国药典 [S]. 一部. 2010. |
| [14] | 薛 璟, 贾晓斌, 谭晓斌, 等. 雷公藤化学成分及其毒性研究进展 [J]. 中华中医药杂志, 2010, 25(5): 726-733. |
| [15] | 骆永伟, 施 畅, 原 野, 等. 雷公藤甲素的毒理学研究进展 [J]. 毒理学杂志, 2009, 23(1): 74-77. |
| [16] | Saag K G, Teng G G, Patkar N M, et al. American college of rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying anti- rheumatic drugs in rheumatoid arthritis [J]. Arthritis Care Res, 2008, 59(6): 762-784. |
| [17] | James Z X, Zhu L J, Jackson J A, et al. Dynamic monitoring of cytotoxicity on microelectronic sensors [J]. Chem Res Toxicol, 2005, 18(2): 154-161. |
| [18] | 郭艳红, 谭 垦. 雷公藤的毒性及其研究概况 [J]. 中药材, 2007, 30(1): 112-117. |
| [19] | 王月敏, 张世良, 夏素霞, 等. 雷公藤的毒性研究及对策 [J]. 四川生理科学杂志, 2008, 30(1): 28-31. |
| [20] | Jessica M B, Huang L, Xie L, et al. A cell- microelectronic sensing technique for profiling cytotoxicity of chemicals [J]. Anal Chim Acta, 2008, 615(1): 80-87. |
| [21] | Ebru U, Haertel U, Styllou M, et al. Real-time xCELLigence impedance analysis of the cytotoxicity of dental composite components on human gingival fibroblasts [J]. Dent Mater, 2010, 26(1): 51-58. |
 2015, Vol. 46
2015, Vol. 46


