2. 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023;
3. 南京市中药微丸产业化工程技术研究中心, 江苏 南京 210029
2. Jiangsu Engineering Research Center for Efficient Delivery System of TCM, Nanjing 210023, China;
3. Nanjing Engineering and Technology Research Center for TCM Pellets, Nanjing 210029, China
中药制剂是在中医理论指导下,以中医方剂为基础,中药饮片为原料,通过提取、分离、纯化获得半成品,再经药剂学方法加工制成各种剂型的药品。按原料性质的不同,中药制剂可以分为具有明确化学结构的中药单体成分制剂,如葛根素(puerarin);有效成分有明确定量范围规定的中药有效部位制剂,如黄芩提取物;中药复方提取后的中药复方提取物制剂,如复方丹参滴丸[1]。其中,中药有效部位制剂和中药复方提取物制剂的成分体系极其复杂,其功效往往是多种成分整体协同作用的综合体现。至今为止,中药制剂中所含的成分在整体方剂中的作用仍不太明确,限制了中药制剂制备工艺的优化及质量标准的构建[2]。因此,辨识中药制剂中与功效密切相关的主要活性成分群并以此优化中药制剂工艺、构建质量评价体系,已成为中药制剂工艺设计与质量控制亟待解决的关键科学问题之一。
本文通过对谱-效相关、中药药动学、血清药物化学和血清药理学、整合效应关联性分析、计算机虚拟筛选以及敲入/敲除对比分析等目前几种指标成分辨识方法的论述,探讨从中药制剂复杂成分群中寻找到与功效相关的主要活性成分群用于构建质量评价体系的研究思路,以期为中药制剂工艺优选与质量评价体系构建提供借鉴。
1 中药制剂指标性成分群辨识方法分析 1.1谱-效相关性分析谱-效相关性分析是指将中药指纹图谱或特征图谱中化学成分的变化与其疗效变化相结合,研究其相关性,找出与药效活性相关的药效物质群,即“谱效关系”研究,目前成为探索中药标志性药效物质基础的主要方法与手段。谱-效相关性分析属于体外辨识方法,其研究思路分为3步:(1)多维联用技术分析“药效检测”信息处理;(2)获取中药指纹图谱和药效数据结果;(3)通过数学处理,建立谱-效数学模型,确定出与药效相关的成分群,用于工艺优选与质量评价。其数学分析方法有相关分析、回归分析、神经网络分析、灰色关联度分析和主成分分析等[3]。
Xu等[4]收集了78批葛根样品并分别获得每一批样品与混合对照品的指纹图谱和抗氧化活性,运用安全独立筛选方法(SIS)联合区间偏最小二乘法(iPLS)建立葛根指纹图谱与抗氧化活性之间的相关关系,再运用逐步回归法和留一法从指纹图谱中筛选出与抗氧化活性相关性大的区间,最终确定5个异黄酮类成分共同决定葛根的抗氧化活性。蒋建兰等[5]基于GC-MS分析,运用正交投影偏最小二乘法和双变量相关分析,建立了姜黄挥发油的化学成分与其抑制人宫颈癌HeLa细胞作用的谱效关系模型,发现9个特征峰与姜黄挥发油抑制HeLa细胞活性显著相关,并鉴定出8个化合物,分别为芳姜黄酮(ar-tumerone)、β-姜黄酮(β-tumerone)、姜烯(zingiberene)、β-榄香烯(β-elemene)、α-姜黄烯(α-curcumene)、α-姜黄酮(α-tumerone)、吉马酮(germacrone)和β-倍半水芹烯(β-sesquiphellandrene)。
谱-效相关性分析方法的特色在于将指纹图谱中的化学成分信息与药效信息相结合,建立特征图谱与药效相关性;并可在已有谱效相关方程的基础上预测中药制剂药效,指导中药制剂工艺优化。该方法同时也存在如下问题:(1)指纹图谱具有模糊性,不能全面显示化学成分信息。中药成分复杂,量相差悬殊,化合物结构不尽相同,现有图谱获取方法无法体现中药成分同时测定的准确性、重复性及微量性。指纹图谱或特征图谱的共有峰均为人为识别,进行相关分析时未能稳定表达的特征峰或响应值低、分离度差的特征成分往往被忽略。(2)现有中药药效指标的选择过于笼统,没有针对性。很多中药制剂来自于中药复方,偏于整体调节,作用广泛,但现阶段缺乏能够较好反映中医证候特点的动物模型以及与该模型匹配的公认、专属、高灵敏度的指标。(3)中药制剂的体内过程较为复杂,使得图谱中成分的量与药效不成线性关系,简单用一级速度过程或线性过程来描述,无法有效得到图谱与真正药效之间的关系[6]。
1.2 中药药动学研究中药制剂的成分虽然极其复杂,但是一定存在着能够对疾病起到治疗作用的物质基础,而这些效应物质在体内必定经过吸收、分布、代谢、排泄(ADME)的动态变化,从而发挥作用。因此,通过研究中药制剂的药动学变化,可以阐明和辨识效应物质基础,为中药制剂工艺评价及质量标准建立提供科学依据。
中药药动学属于体内辨识方法,近年来,研究发现血药浓度法、生物效应法和药动(PK)/药效(PD)学模型结合法等经典药动学研究方法无法系统地揭示中药在体内的众多复杂生理过程,于是提出了中药多组分整合药动学、药动标志物(PK marker)、网络药理学、代谢组学等新理念与研究方法,大大推进了中药药动学研究的进展[7]。
1.2.1 经典中药药动学黄开福[8]在四物汤指纹图谱的基础上,以梓醇(catalpol)为主药,将梓醇、藁本内酯(ligustilide)、阿魏酸(ferulic acid)、芍药苷(paeoniflorin)和川芎嗪(tetramethylpyrazine)进行组合配伍给药,结果表明,配伍后梓醇和阿魏酸在大鼠体内的暴露量明显减少,而川芎嗪暴露量增加。同时,芍药苷、川芎嗪和芍药苷+川芎嗪可以反转梓醇+阿魏酸对藁本内酯达峰时间的影响,亦可以改变阿魏酸在大鼠体内的吸收行为。而梓醇、藁本内酯、阿魏酸和芍药苷则可以改变川芎嗪在大鼠体内的吸收行为,认为梓醇、芍药苷和芍药内酯苷均可作为四物汤的代表性组分。李涛[9]采用体外化学指纹图谱-在体肠肝摄取成分谱-整体动物多成分药代特征的研究思路,对黄芩汤的药动学特征进行研究,对不同给药剂量、不同给药次数和生理、病理状态下的药动学行为进行比较,确定甘草素二糖苷(liquiritinapioside)、甘草苷(liguiritin)、黄芩苷(baicalin)、甘草素(liguiritigenin)、千层纸素A葡萄糖苷(oroxylin A glucoside)、汉黄芩苷(wogonoside)、黄芩素(baicalein)、异甘草素(isoliquiritigenin)、汉黄芩素(wogonin)和千层纸素A(oroxylin A)是黄芩汤发挥药效的物质基础,是黄芩汤潜在的“质量控制标志物(quality control marker,QC marker)”和“药动标志物”,其中黄芩苷是体内潜在的“药物代谢标志物(drug metabolism marker,DM marker)”。
1.2.2 PK-PD相关性Han等[10]应用药动学方法研究泻心汤的药效物质基础,结果发现泻心汤可以促进结肠炎的恢复并通过降低髓过氧化物酶(MPO)水平和肿瘤坏死因子-α(TNF-α)与核因子-κB(NF-κB)p65炎症因子的表达,促进白细胞介素-10(IL-10)的产生,从而减轻溃疡性结肠炎模型大鼠的结肠炎症损伤。大鼠血浆中有5个成分的AUC与泻心汤疗效呈正相关,分别是黄芩苷、小檗碱(berberine)、次黄芩苷(wogonoside)、汉黄芩素、大黄酸(rhein);结肠组织中有6个化合物的浓度也与疗效呈正相关,分别是黄连碱(coptisine)、药根碱(jatrorrhizine)、非洲防己碱(palmatine)、小檗碱、黄芩素和大黄素(emodin),这些成分可能是泻心汤的药效物质基础。
1.2.3 整合药动学Xie等[11]研究了五味子中5种成分对CCl4诱导的肝损伤治疗作用的整合药动学行为,发现整合参数及CYP450酶系CYP3A活性与天冬氨酸转氨酶(ALT)及丙氨酸转氨酶(AST)水平有很好的相关性,说明几种成分的整合药动学参数可以用来评价五味子各种成分的整体体内药动学过程。Xiong等[12]研究了大鼠ig鸡骨草提取物后,3种黄酮碳苷类成分6-C-葡萄糖基-8-C-木糖基洋芹素(vicenin-2)、异夏佛塔苷(isoschaftoside)、夏佛塔苷(schaftoside)的整合药动学和体内分布及其与生物效应的相关性,利用整合双峰值药动学模型发现这3种成分在小肠可能有2个特定吸收部位,且胆汁流量与脚趾肿胀实验表明,药动学和药效学之间有显著相关性。同样,Dong等[13]利用AUC加权平均法对闹羊花中闹羊花素与心脏毒性的相关性进行了整合药动学研究,He等[14]通过给大鼠ig交泰丸,研究了其中的5种原小檗碱型生物碱的单剂量与多剂量的整合药动学,均促进了整合药动学在中药制剂效应物质基础辨识中的应用。
1.2.4 代谢组学中药中有些成分体外不能被吸收或代谢后失活,有些成分在体外无效而在体内代谢转化为活性成分或通过神经体液系统而发挥药效,因此,研究中药不仅要研究其本身的化学成分,还要研究给药后在体内的代谢产物,运用代谢组学结合多元统计学工具进行体液多成分综合分析是一种有效可行的方法[15]。Kim等[16]分别比较了台湾中医药数据库(TCM Database@Taiwan)中14 306个成分和DrugBank 3.0数据库中1 394个成分与京都基因和基因组百科全书(KEGG)中2 889个人体代谢物的相似度,发现中药成分与人体代谢产物的结构相似度很高,于是提出中药成分与人体代谢产物结构相似性是中药诱导人体靶点及作用通路从而发挥药效的假说,并由此提出一种系统研究中药的思路,即从中药中寻找与人体代谢产物结构相似的物质,从而借鉴代谢产物的作用机制分析中药的作用机制,从中药中发现新靶点及新药。Hu等[17]研究po三七提取物后,三七中皂苷类成分的人体药动学特征,发现20(S)-原人参二醇 [20(S)-protopanaxadiol] 和20(S)-原人参三醇 [20(S)-protopanaxatriol] 的氧化代谢产物是人参皂苷在血液中的主要形式,与三七的临床疗效密切相关。
中药药动学能够反映药物在体内的ADME过程及其相关规律。但是目前研究存在以下问题:(1)许多药效成分在复方中的量很低,导致其在全身的暴露水平更低,以至于难以检测;(2)中药复方不仅在体外涉及到多种药物的配伍,而且服用后体内影响因素也非常多,如内源性杂质、降解产物、被吸收入血的其他成分,均可能干扰生物样品的分离测定;(3)中药成分复杂,体内效应与成分之间存在非直接相关性[18]。
1.3 血清药物化学和血清药理学研究血清药物化学是指采用现代分析方法对含药血清中的药源性成分进行定性和定量分析的方法。血清药理学是指将含药血清作用于体外细胞模型进行药效学评价的方法[19]。两者相互验证,均属于体内辨识方法,其核心思想为入血成分可能是中药有效成分,入血成分可为原型成分和代谢产物。其技术路线包括提取物制备及指纹图谱建立、血中移行成分辨识、血中移行成分分离与鉴定、血中移行成分活性测定[20]。
郭辉等[21]对大黄附子汤进行血清药物化学初步研究,在大鼠ig给予大黄附子汤后的血清中发现18个入血成分,其中14个为代谢产物,4个为原型成分,为深入阐述大黄附子汤药效物质基础提供依据。田友清等[22]结合血清药理学与血清药物化学研究香青兰保护心肌细胞缺氧/复氧损伤的物质基础,结果香青兰在血清中出现的4个移行成分能够显著升高总超氧化物歧化酶(T-SOD)活性及细胞活力,明显抑制细胞凋亡,可能为香青兰保护心肌细胞缺氧/复氧损伤的物质基础。王喜军等[23]研究茵陈蒿汤不同配伍对大鼠血中移行成分的影响,发现茵陈蒿汤给药后大鼠血中移行成分有21个,其中在全方配伍时才能被机体吸收且具有较强保肝利胆活性的成分有8个。
血清药物化学研究思路的优势在于从入血成分入手分析药物的效应物质基础,成本较低,易操作,应用面广。存在的问题包括:(1)该方法主要适用于口服中药,且需要有效成分吸收入血,不适用于非口服给药或口服不吸收但通过调节胃肠神经体液起效的药物;(2)某些吸收入血的成分可能因为量低难以检测而被忽略;(3)研究从化学成分指纹图谱的建立开始,需进行植物化学分离、药理活性检测,周期相对较长[20]。
1.4 整合效应关联性分析整体观念是中医的两大基本观念之一,中药制剂发挥药效亦是多成分、多靶点、多环节整体作用的体现,而中药效应物质基础的研究很长一段时间都是在化学分离之后逐个进行活性测试或活性导向下的追踪分离。随着中药物质基础研究的不断深入,逐渐意识到中药“整体作用大于各部分作用之和”的重要性。姜廷良等[24]提出中药及其方剂的终末效应是其相应活性物质群作用于多个靶点的优势、放大、选择、嵌合、适应等作用的综合、聚类、协调、反馈、平衡,即“整合”的结果。而单个活性物质群可以形成一个整合效应,多个整合效应之间亦可发挥协同增效作用,于是提出整合效应关联性分析的概念。目前,除了从拆方与配伍方面研究复方制剂的整合效应之外,亦从效应部位分析中药的整合效应,但研究还相对较少。
刘立等[25]运用整合生物效应评价桃红四物汤及其各分离部位对热板致小鼠疼痛、醋酸致小鼠扭体反应、小鼠痛经模型及离体子宫收缩的影响,探讨效应部位群的物质基础,结果表明桃红四物汤效应部位除整方水煎液(TH-2)和醇沉上清部位(TH-4)外,30%醇洗部分(TH-9)、40%醇洗部分(TH-10)和50%醇洗(部分TH-11)是主要的效应部位群,包括单萜苷类、苯酞类、有机酸类等成分,其中TH-9的效应较强。陈磊等[26]通过文献研究,归纳整理出丹参的活性成分主要为脂溶性的二萜醌类化合物和水溶性的酚酸类化合物,并试图找出丹参中发挥抗肿瘤作用的结构母核,提出以结构母核为基础研究丹参活性成分的整合效应的研究思路。宋宗华等[27]采用正交试验设计对苓桂术甘汤进行拆方配伍研究,对配伍得到的16个处方进行小鼠常压耐缺氧、对抗氯仿所致小鼠心律失常等药理实验,运用HPLC指纹图谱,将所得药理数据和各指纹峰的峰面积相关联,探讨复方苓桂术甘汤的药效物质基础。结果从50个色谱峰中辨识出17个成分作为药效物质基础,其中桂皮酸(cinnamic acid)、甘草酸(glycyrrhizin)和去氢土莫酸(dehydrotumulosic acid)被确定为质量控制指标。
整合效应关联性分析体现了中药复方制剂的整体作用,与中医“君、臣、佐、使”组方原则相吻合,是符合中医药理念的一种方法,有较大的发展前景。但是在“整合”之前必定需要先确定组成“整体”的各个“部分”的整体效应,如今对整体的分割还缺少有说服性的依据。曹俊岭等[28]提出的生物热力学可为中药及复方整合作用研究提供较好的思路和方法,运用生物热力学可以间接了解生物体新陈代谢状态和变化规律,可以高通量筛选和分析药物的生物活性,进一步结合药理、毒理、化学分析手段阐明中药及复方的整合作用。然而整合效应之间的关联性分析还未有人提出合适的数学模型。
1.5 计算机虚拟筛选虚拟筛选是针对重要疾病特定靶标生物大分子的三维结构或定量构效关系(QSAR)模型,从现有小分子数据库中,搜寻与靶标生物大分子结合或符合QSAR模型的化合物,进行实验筛选研究。其目的是从几十到上百万个分子中,发现有潜在可能活性的化合物,集中目标进行攻关。计算机虚拟筛选方法主要有2种:一是基于配体小分子的虚拟筛选,根据现有药物的结构、理化性质与活性关系的分析,建立定量构效关系或药效基团模型,预测筛选新化合物的活性;二是基于受体生物大分子结构的虚拟筛选,即基于分子对接的虚拟筛选方法,是根据实验测定的或同源模建的受体生物大分子的三维结构,通过分子对接的方法,确定小分子与受体的结合构象,并评价其与受体的结合活性[29, 30]。分子对接、反向分子对接相似度搜索、子结构搜索、药效团搜索、类药性筛选及化学成分毒性预测等技术,在中药制剂效应物质基础辨识过程中,为处方优化及新处方设计提供依据[31]。
陈少军等[32]利用分子对接技术,选取149个丹参化学成分作为配体,选取与血栓密切相关的4种蛋白抗凝血酶III、凝血酶、血栓调节蛋白、凝固因子Xa作为受体,运用PyRx 0.8软件Autodock Vina模块进行对接,发现3-(3,4-二羟基苯基)乳酰胺[3-(3,4-dihydroxyphenyl) lactamide]、原儿茶酸(protocatechuic acid)、油酰新隐丹参酮(oleoyl neo cryptotanshinone)、丹参内酯(tanshilactone)分别与抗凝血酶III、凝血酶、血栓调节蛋白EGF(4-5)、凝固因子Xa结合的活性较高。翟西峰等[33]应用分子模拟软件Sybyl-x 2.0软件中的Surflex-Dock模块,以黄芪中已报道的小分子化合物作为配体,分别与糖尿病相关的5种受体进行对接,以亲和力打分判断黄芪中的降血糖活性成分,发现黄芪皂苷I(astragaloside I)、黄芪甲苷(astragaloside A)、5-羟基-4-甲氧基黄酮-7-O-β-D-葡萄糖苷-6″-O-丙二酸酯与α-葡萄糖苷酶的结合活性较高;黄芪异黄烷- 7-O-β-D-葡萄糖苷-6″-O-丙二酸酯与二肽酰多肽酶IV(DPP-IV)的结合活性较高;黄芪紫檀烷-3- O-β-D-葡萄糖苷-6″-O-丙二酸酯与PPARγ的结合活性较高;黄芪皂苷I(astragaloside I)、大豆皂苷I(soyasaponin I)与蛋白酪氨酸磷酸酶1B(PTP1B)的结合活性较高;黄芪甲苷(astragaloside A)、黄芪皂苷VIII(astragaloside VIII)、芒柄花素-7-O-β-D-葡萄糖苷-6″-O-丙二酸酯、2′-羟基-3′,4′-二甲氧基-异黄烷葡萄糖苷与醛糖还原酶的结合活性较高。龙伟等[34]采用计算机虚拟筛选技术以中医组方理论“君、臣、佐、使”为参照,对黄连解毒汤药效分子进行功能分群。经过实验建立的复方分子功能分群标准,发现黄连解毒汤265个化学成分分子中君药分子12个,臣药分子152个,佐药分子48个,使药分子53个。说明中药复方药效成分之间存在“君、臣、佐、使”的功能分群,具有分子微观意义。
计算机虚拟筛选通过计算机技术快速、大量富集活性化合物,减少药物筛选的盲目性,大大缩短研究周期,降低筛选成本,提高药物筛选可行性。与传统直接药理测试筛选相比,计算机虚拟筛选过程不受样品的限制、方便快捷。然而,在中药研究中,计算机虚拟筛选技术只能作为一种辅助工具,仅为随后实验提供一些研究思路和线索,应该合理选择应用。目前国内用于大规模虚拟筛选的服务平台鲜为少见,缺少一个拥有大量中药化学成分的数据库。计算机在筛选药物过程中仅考虑受体和配体的作用,而未考虑药物之间复杂的作用机制,且目前缺乏一种完善有效的评价方法来评价配体,导致该方法易出现假阳性和假阴性结果。
1.6 敲入/敲除比较分析敲入/敲除技术是借鉴“基因诊断治疗”策略,以中药谱效关系为切入点,建立基于成分敲入/敲除的中药“谱-效”关系和“量-效”关系的研究模式,即通过成分敲除的策略分析和辨识中药关键药效组分,通过成分敲入的策略确定关键组分的“量-效(毒)”关系,从而定性、定量地辨识中药制剂效应物质基础[35]。
该方法辨识中药制剂效应物质基础需完成3个步骤:(1)选择性敲除某一中药或其制剂的成分并制备其阴性样品;(2)评价目标成分、阴性样品以及方药总提取物的生物活性;(3)确定关键药效组分及其“量-效”关系。
目前已有研究者基于成分敲入/敲除技术,辨识中药牛黄[35]、金银花[36]和黄连[37]的药效物质基础,研究各药的质量控制模式,进一步揭示了金银花、牛黄和黄连的抗菌活性物质基础,为其质量标准完善奠定了基础。Chen等[38]为了找出龙眼籽提取物抗氧化活性的有效物质,将活性评价测定、FT-ICR-MS和HPLC-ESI-MS分析方法与敲除技术相结合,研究结果表明,鞣花酸(ellagic acid)及其衍生物和p-coumaric acid glycoside对龙眼籽抗氧化活性有重要贡献,而没食子酸(gallic acid)、柯里拉京(corilagin)、(S)- flavogallonic acid、甲基鞣花葡萄糖苷酸(methyl-ellagic acid glucopyranoside)和没食子酸乙酯(ethyl gallate)的贡献值非常小。Liu等[39]使用乙酰胆碱酯酶(AChE)和辐照诱导过的石蒜鳞茎作为实验材料,从石蒜鳞茎中筛选出4个目标峰,通过目标峰的捕获和敲除,结合活性评价,观察到4峰混合物的生物活性与石蒜鳞茎提取物的生物活性相似,并提出应用在线成分捕集制备系统,结合自动化阵列管理,精准定向、自动无损捕获目标候选等效成分群及其剩余部分。Liu等[40]提出通过体外多种药理模型和系统生物学方法评价敲除的“候选成分群”对复方“整体”药效的贡献度,同时评价敲除剩余部分的活性,进行正反验证,再经过多轮筛选与等效性评价,发现能基本达到原方整体药效的等效成分群的方法。应用此方法从复方丹参滴丸中发现18个成分组成的等效成分群,其总量占复方制剂的15.01%,可视作制剂的有效组分“标示量”,且该成分群在细胞模型和大鼠心肌梗死、缺血再灌注模型上均呈现出与复方丹参滴丸相当的药效。
敲入/敲除技术以中药整体为出发点,始终关联药效,注重中药多组分的整合作用,可快速准确地辨识关键药效物质及其相互作用关系,在此基础上,可制定各药效物质“量而又准、关联药效、可控可评”的质量控制标准[41],为打破现行中药质量控制标准的窘局找到了突破口。存在的问题是该技术对分离、分析技术要求较高,且该方法的实用性和操作性仅适用于疗效确切、药理药效作用客观、指标可量化的中药制剂,不适用于化学成分复杂、本底不清的中药及中药复方制剂。
2 中药制剂指标性成分群辨识思路与方法鉴于每种指标性成分群的辨识方法各有长处,因此可选择性地将各种方法联用,取长避短,本文提出中药制剂指标性成分群辨识模式,见图 1。
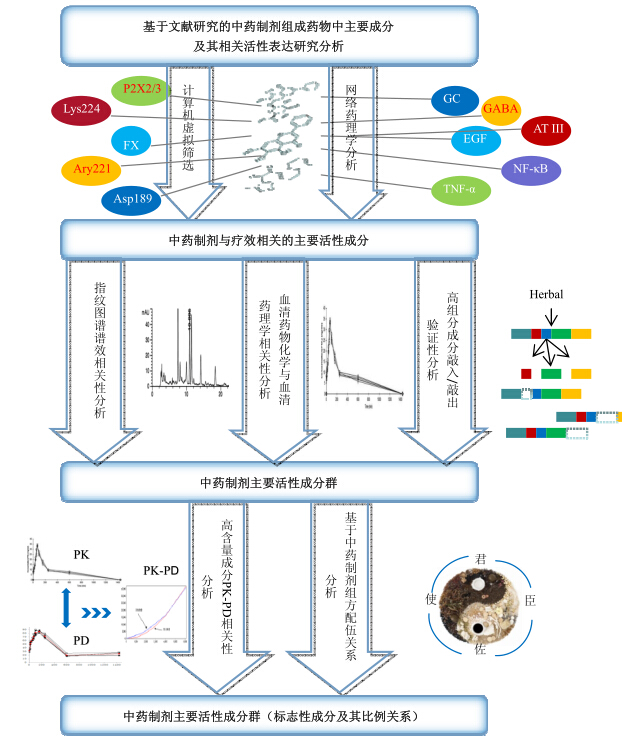 | 图 1 中药制剂指标性成分群辨识模式Fig.1 Identification mode of target components group from CMM preparation |
中药制剂指标性成分群的辨识是中药制剂工艺合理性评价体系构建的工作基础,对避免当前中药制剂工艺合理性评价体系存在的指标成分单一或体系指标性过多依赖化学分析而淡化生物效应关联性的问题具有重要指导意义。本文提到的6种思路方法中谱-效相关、中药药动学研究是中药制剂指标性成分群辨识最常用的思路与方法,血清药物化学和血清药理学尚不能够全面反映药物的作用基础,整合效应关联性分析、计算机虚拟筛选以及敲入/敲除技术属于后起之秀,它们的应用有待进一步验证与发展。这6种思路与方法都可以从不同方面辨识中药制剂指标性成分群,但是各又存在着局限性,其中分离、分析手段、中医药药效指标的选择及其灵敏度问题,是限制各种方法发展的共性问题。近年来,固相萃取技术、固相微萃取技术、液相微萃取技术、分子印记聚合物技术、涡流色谱技术等分离、分析手段正在不断的发展与应用,使得到高纯度与浓度的分离物并能够快速分析成为可能。同时,由于中药往往具有双向调节及偏于整体调节作用,整体动物药效学评价越来越得到认可,但是需要在研究设计中谨慎且全面地选择更为客观的检测指标以及更为规范化的药效学研究作为研究结果可靠、准确的必要条件。
提出的中药制剂指标性成分群辨识模式综合了谱-效相关与中药药动学相结合、谱-效相关与敲入/敲除技术相结合、中药药动学与整合效应关联性分析相结合等,最终在中药制剂处方配伍理论指导下,确定中药制剂指标性成分群,从而为揭示中药制剂物质基础,完善工艺、质量评价体系提供科学有力的依据。
| [1] | 谢 燕, 马越鸣, 王长虹, 等. 改善中药制剂口服生物利用度的研究概况与思考 [J]. 国际药学研究杂志, 2011, 38(3): 195-200. |
| [2] | 梁小银, 陈少旭, 吴 垠. 中药制剂质量控制研究的发展趋势 [J]. 中国药房, 2014, 25(3): 280-283. |
| [3] | 刘 莉, 李文兰, 丁晶鑫. 基于“谱-效”相关的中药药效物质基础研究方法 [J]. 天然产物研究与开发, 2013, 25: 410-415. |
| [4] | Xu J, Xu Q S, Chan C O, et al. Identifying bioactive components in natural products through chromatographic fingerprint [J]. Anal Chim Acta, 2015, 870(4): 45-55. |
| [5] | 蒋建兰, 丁洪涛, 苏 鑫, 等. 基于组效关系的姜黄挥发油抗肿瘤活性成分辨识研究 [J]. 分析化学研究报告, 2012, 40(10): 1488-1493. |
| [6] | 潘学强, 黄菊英, 龚慕辛, 等. 谱效相关分析方法在中药药效物质基础研究中的应用进展 [J]. 北京中医药, 2013, 32(10): 731-735. |
| [7] | 余 健, 辛艳飞, 宣尧仙. 中药药代动力学研究进展 [J]. 中华中医药学刊, 2014, 32(6): 1337-1340. |
| [8] | 黄开福. 四物汤有效成分代表性组分药代动力学相互作用研究 [D]. 北京: 军事医学科学院, 2014. |
| [9] | 李 涛. 黄芩汤物质基础与药代动力学特征研究 [D]. 北京: 中国中医科学院, 2013. |
| [10] | Han X H, Zhong J, Guo J Y, et al. Relationships between pharmacokinetics and efficacy of Xie-xin decoction in rats with experimental ulcerative colitis [J]. J Ethnopharmacol, 2013, 148(4): 182-189. |
| [11] | Xie Y, Hao H P, Kang A, et al. Integral pharmacokinetics of multiple lignan components in normal, CCl4-induced hepatic injury and hepatoprotective agents pretreated, rats and correlations with hepatic injury biomarkers [J]. J Ethnopharmacol, 2010, 131(6): 290-299. |
| [12] | Xiong F, Wang H, Jiang Z, et al. Integrated pharmacokinetics and biodistribution of multiple flavonoid C-glycosides components in rat after oral administration of Abrus mollis extract and correlations with bio-effects [J]. J Ethnopharmacol, 2015, 163: 290-296. |
| [13] | Dong L C, Zhang X H, Ma J, et al. The integrated pharmacokinetics of major rhodojaponins correlates with the cardiotoxicity after oral administration of Rhododendri Mollis Flos extract in rats [J]. J Ethnopharmacol, 2014, 157: 69-78. |
| [14] | He W, Liu G, Cai H, et al. Integrated pharmacokinetics of five protoberberine-type alkaloids in normal and insomnic rats after single and multiple oral administration of Jiao-Tai-Wan [J]. J Ethnopharmacol, 2014, 154(3): 635-644. |
| [15] | Lan K, Xie G X, Jia W. Towards polypharmacokinetics: pharmacokinetics of multicomponent drugs and herbal medicines using a metabolomics approach [J]. Evid Based Complement Alternat Med, 2013, 2013: 1-12. |
| [16] | Kim H U K, Ryu J Y, Lee J O, et al. A system approach to traditional oriental medicine [J]. Nat Biotechnol, 2015, 33(3): 264-268. |
| [17] | Hu Z Y, Yang J L, Cheng C, et al. Combinatorial metabolism notably affects human systemic exposure to ginsenosides from orally administered extract of Panax notoginseng roots (Sanqi) [J]. Drug Metab Dispos, 2013, 41(6): 1457-1469. |
| [18] | 刘孝昌. 中药药代动力学研究的难点和热点 [J]. 药学学报, 2005, 40(5): 395-401. |
| [19] | 安莉萍, 窦志华, 候金燕. 中药血清药理学、血清药物化学研究进展 [J]. 中南药学, 2013, 11(7): 521-524. |
| [20] | 黄财顺, 向 诚, 李宝才, 等. 基于中药血清药物化学的活性成分筛选的现状和问题 [J]. 中草药, 2014, 45(20): 3009-3014. |
| [21] | 郭 辉, 刘 晓, 蔡 皓, 等. 大黄附子汤血清药物化学初步研究 [J]. 中草药, 2013, 44(5): 528-531. |
| [22] | 田友清, 尚 靖, 何 婷, 等. 基于中药血清化学及血清药理学方法探讨香青兰保护心肌细胞缺氧/复氧损伤物质基础 [J]. 中国中药杂志, 2012, 37(5): 620-624. |
| [23] | 王喜军, 孙文军, 孙 辉, 等. 茵陈蒿汤不同配伍变化对大鼠血中移行成分的影响 [J]. 中国天然药物, 2008, 6(1): 43-47. |
| [24] | 姜廷良, 霍海如. 重视中药多组分整合作用的研究 [J]. 世界科学技术—中医药现代化, 2003, 5(2): 1-4. |
| [25] | 刘 立, 段金廒, 华永庆, 等. 桃红四物汤用于原发性痛经的整合效应评价研究 [J]. 中国中药杂志, 2012, 37(21): 3275-3281. |
| [26] | 陈 磊, 陆 茵, 郑仕中. 丹参药理活性成分的整合效应 [J]. 中草药, 2009, 40(3): 476-479. |
| [27] | 宋宗华, 冯 东, 许俊博, 等. 苓桂术甘汤配伍机制及药效物质基础研究 [J]. 中成药, 2003, 25(2): 132-137. |
| [28] | 曹俊岭, 李祖伦, 付 强, 等. 中药及复方整合作用的研究 [J]. 中草药, 2007, 38(1): 附2-附4. |
| [29] | 朱 伟, 陈可冀, 徐筱杰. 计算机药物虚拟筛选技术在中医药领域中的应用前景 [J]. 中国中西医结合杂志, 2007, 27(3): 263-266. |
| [30] | 叶德举, 罗小民, 沈建华, 等. 先导化合物的发现-整合计算机虚拟筛选、化学合成和生物测试方法 [J]. 中国中西医结合杂志, 2007, 19(12): 1939-1946. |
| [31] | 涂瑶生, 孙冬梅, 陈玉兴, 等. 中药新药筛选新技术及实践 [J]. 世界科学技—中医药现代化, 2014, 16(8): 1696-1702. |
| [32] | 陈少军, 陈宏降, 郭章华. 丹参中抗血栓活性成分的虚拟筛选 [J]. 中药药理与临床, 2013, 29(6): 103-106. |
| [33] | 翟西峰, 张存劳, 冯锁民, 等. 黄芪中降血糖成分计算机虚拟筛选 [J]. 陕西中医, 2015, 36(2): 235-237. |
| [34] | 龙 伟, 刘培勋, 高 静. 计算机虚拟筛选技术对黄连解毒汤药效物质功能分群的研究 [J]. 医药导报, 2008, 27(1): 23-25. |
| [35] | 孔维军. 基于成分敲出/敲入的中药 (牛黄) 物质辨识和质量控制模式的初步研究 [D]. 成都: 成都中医药大学, 2011. |
| [36] | 张甜甜. 基于成分敲出/敲入的中药金银花物质辨识和质量评价研究 [D]. 成都: 成都中医药大学, 2011. |
| [37] | 李俊贤. 基于成分敲出/敲入的中药 (黄连) 物质辨识和质量控制模式的研究 [D]. 昆明: 昆明理工大学, 2013. |
| [38] | Chen J, Ge Z Z, Zhu W, et al. Screening of key antioxidant compounds of longan (Dimocarpus longan Lour.) seed extract by combining online fishing/knockout, activity evaluation, Fourier transform ion cyclotron resonance mass spectrometry, and high-performance liquid chromatography electrospray [J]. J Agric Food Chem, 2014, 62(40): 9744-9750. |
| [39] | Liu Y, Zhou J L, Liu P, et al. Chemical markers fishing and knockout for holistic activity and interaction evaluation of the components in herbal medicines [J]. J Chromatogr A, 2010, 1217(32): 5239-5245. |
| [40] | Liu P, Yang H, Long F, et al. Bioactive equivalence of combinatorial components identified in screening of an herbal medicine [J]. Pharm Res, 2014, 31(7): 1788-1800. |
| [41] | 肖小河, 鄢 丹, 袁海龙, 等. 基于成分敲除/敲入的中药药效组分辨识与质量控制模式的商建 [J]. 中草药, 2009, 40(9): 1345-1348. |
 2015, Vol. 46
2015, Vol. 46


