2. 江苏大学药学院, 江苏 镇江 212013
2. School of Pharmacy, Jiangsu University, Zhenjiang 212013, China
丹参Salviae Miltiorrhiza radix et Rhizoma为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge. 的干燥根及根茎。传统中医谓其味苦,性微寒。具有活血调经、祛瘀止痛、凉血消痈、除烦安神之功效[1]。《妇科明理论》中记载:“一味丹参散,功同四物汤”。现代研究表明,丹参中主要功效物质包括脂溶性的丹参酮类和水溶性的丹酚酸类化学成分。生物活性评价证实[2, 3],丹参酮类化学成分具有抗血栓、抗菌、抗过敏等作用;丹酚酸类化学成分具有抗氧化、抗凝血及保肝等作用,近年来相继发现对肿瘤、HIV具有良好的抑制作用。目前,以丹参药材为原料或主要原料研制上市的系列产品有丹参注射液、丹参酮胶囊、丹参酮IIA磺酸钠注射液、丹参多酚酸盐注射液以及复方丹参口服液、复方丹参注射液、复方丹参胶囊、复方丹参滴丸等产品。
随着社会需求量的不断增长,依赖于自然资源提供的丹参药材产量已不敷应用。近十余年来,丹参药材逐渐通过人工种植生产所替代,且生产面积和产量日益扩大,近年的统计表明丹参每年产量达5 000~7 000 t。然而,采收其根及根茎药用的同时也产生了大量的丹参地上部分等非传统药用部位,其生物量约占丹参植物质量的67%,且大多未被有效利用而废弃,造成资源的巨大浪费和生态环境的污染[4]。研究发现,丹参茎叶中含有酚酸类[5]、糖类[6]等资源性化学物质,具有抗病毒、抗肿瘤、抑菌、抗炎、抗氧化等生物活性[7],可用于原发性或继发性血小板减少性紫癜,以及因临床化疗或放疗引起的白细胞及血小板减少等症。也有以丹参叶外用治疗扁平疣[8]的报道。
本实验在前期研究基础上[9, 10],选取不同生长期丹参植物地上部分的茎叶、花序为研究对象,采用UPLC-TQ/MS联用技术,分析评价丹参茎叶及花序中7种丹酚酸类化学成分的动态积累,探讨其开发利用价值和资源化利用策略,从而为丹参非药用部位的资源化利用提供科学依据。
1 仪器与材料 1.1 仪器Waters ACQUITY UPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器;Waters公司);Xevo 质谱检测器(Waters公司);MassLynxTM质谱工作站软件(Waters公司);EPED超纯水系统(南京易普达易科技发展有限公司);KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);TDL-240B型离心机(上海安亭科学仪器厂);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司),FW80型高速万能粉碎机(天津市泰斯特仪器有限公司),Sartorius BT125D型电子天平(赛多利斯科学仪器有限公司)。
1.2 试剂及材料丹参茎叶和花的供试样品采自于南京中医药大学药用植物园(江苏南京),样品(编号1~15)采集是依不同物候期于2014年4~12月期间进行。植物基原经南京中医药大学段金廒教授鉴定为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.。所得样品分别于热风烘干(50 ℃)条件下进行,干燥至恒定质量后粉碎成粗粉,常温密封干燥保存备用。
对照品原儿茶醛(批号110810-200506)、咖啡酸(批号110885-200102)、阿魏酸(批号110773-201012)、迷迭香酸(批号111871-201203)均购自中国食品药品检定研究院;丹酚酸B(批号 MUST-13030203)、丹酚酸A(批号MUST-13030701)、丹参素(批号MUST-13030108)均购自北京普天同创生物科技有限公司,质量分数均大于98%;超纯水(实验室自制);经易普易达超纯水制备系统自制;甲酸(色谱纯,德国Merck);乙腈(色谱纯,美国Tedia公司);甲醇(分析纯,南京化学试剂有限公司)。
2 方法与结果 2.1 供试品溶液的制备称取样品粉末1.0 g,精密称定,置于100 mL具塞锥形瓶中,精密加入80%甲醇溶液40 mL,常温下静置1 h,称定质量。超声(100 kHz,50 ℃)80 min,称质量,加80%甲醇补足减失质量。取上清液,以13 000 r/min离心10 min,所得溶液过0.22 μm微孔滤膜,即得供试品溶液。
2.2 对照品溶液的制备取干燥至恒定质量的各对照品适量,精密称定,以少量90%甲醇溶解,置10 mL量瓶中,定容至刻度,摇匀,配得原儿茶醛、咖啡酸、丹参素、丹酚酸A、阿魏酸、迷迭香酸、丹酚酸B质量浓度分别为0.125、0.116、0.116、0.101、0.103、1.030、1.030 mg/mL的混合对照品溶液,作为储备液,其他不同质量浓度的对照品溶液由储备液稀释得到。
2.3 液质条件 2.3.1 色谱条件色谱柱为Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱,0~6 min,3%~40% A;6~8 min,40%~95% A;8~9 min,95% A;9~9.2 min,95%~3% A。体积流量0.4 mL/min,柱温35 ℃,进样量2 μL。
2.3.2 质谱条件离子化模式:ESI−/ESI+;检测方式为多反应检测(MRM方式);毛细管电压3.0 kV;离子源温度150 ℃;脱溶剂气温度550 ℃;脱溶剂气体积流量1 000 L/h;锥孔气体积流量50 L/h;碰撞气流量0.15 mL/min;取样锥孔电压4 V;碰撞能量18 eV,UPLC-TQ/MS色谱图见图 1。
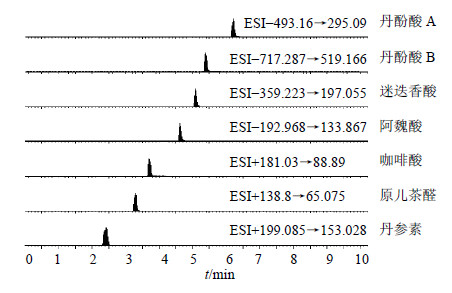 | 图 1 丹参地上部分含有的7种丹酚酸类化学成分的UPLC-TQ/MS分析图谱 Fig.1 UPLC-TQ/MS chromatogram of seven salvianolic acids in aerial parts of S. miltiorrhiza |
精密移取“2.2”项下的原儿茶醛、咖啡酸、丹参素、丹酚酸A、阿魏酸、迷迭香酸和丹酚酸B储备液,稀释,配成不同质量浓度的混合对照品溶液,按照“2.3”项下条件分别测定,记录峰面积,以对照品进样量为横坐标(X),峰面积值为纵坐标(Y),绘制标准曲线并进行线性回归,结果见表 1。
| 表 1 7种丹酚酸类成分的线性回归方程及线性范围 Table 1Calibration curves precision of senen analytes. |
精密吸取“2.2”项下对照品溶液2 μL,按照“2.3”项下条件连续进样6次,测定原儿茶醛、咖啡酸、丹参素、丹酚酸A、阿魏酸、迷迭香酸、丹酚酸B色谱峰峰面积,计算各峰面积的RSD,考察仪器的精密度,RSD在0.96%~2.05%,表明仪器精密度良好。
2.6 重复性试验取丹参茎叶样品6份,按照“2.1”项方法制备供试品溶液,按“2.3”项下条件测定,记录峰面积,计算各成分质量分数的RSD,RSD在1.21%~2.47%,表明该方法重复性良好。
2.7 稳定性试验取丹参茎叶样品的供试品溶液,按照“2.3”项下条件,分别在0、4、8、12、18、24 h进行测定,记录峰面积,计算各物质的RSD值,RSD在1.97%~3.48%,表明供试品溶液在24 h内稳定性良好。
2.8 加样回收率试验称取丹参茎叶样品粉末,精密称定,分别按已知质量分数的80%、100%、120%加入原儿茶醛、咖啡酸、丹参素、丹酚酸A、阿魏酸、迷迭香酸和丹酚酸B的对照品,按照“2.1”项下方法制备供试品溶液后,在“2.3”项条件下进行测定,记录峰面积,计算加样回收率及RSD值,加样回收率在98.36%~105.12%,RSD在1.22%~2.93%。
2.9 样品分析评价 2.9.1 丹参地上茎叶中丹酚酸类化学成分的积累动态供试样品分别按照“2.1”项下方法制备供试品溶液,在“2.3”项条件下进行测定,记录峰面积,计算质量分数,不同生长期丹参茎叶中7种丹酚酸类成分量见表 2。
| 表 2 不同生长期丹参茎叶中主要丹酚酸类化学成分动态积累分析 Table 2Contents of sevensalvianolic acids in different growth periods of S.miltiorrhiza stems and leaves |
研究表明,丹参茎叶中检测到丰富的水溶性丹酚酸类成分,但未检测到脂溶性的丹参酮类化学成分。由表 2结果可知,在同一个生长期内,丹酚酸类化学成分在丹参茎叶中的量差异较大,其中迷迭香酸、丹酚酸B量较高,8月质量分数最高时分别达到21.966、31.403 mg/g,而咖啡酸、丹参素、丹酚酸A、阿魏酸、原儿茶醛的量则相对较低。
除丹酚酸A外,各丹酚酸类化学成分量均在7~8月积累量达到最高值。阿魏酸、原儿茶醛量在7月达到峰值,迷迭香酸、丹酚酸B、丹参素、咖啡酸在8月达到峰值,且各丹酚酸类成分在8月后均开始急速下降,至12月份地上茎叶枯萎时,各丹酚酸类化学成分量均降至最低。值得关注的是,在丹参地上部分生长旺盛期,茎叶中丹酚酸类成分总量为丹参药材根及根茎中的1.5~1.8倍。
2.9.2 丹参花序中丹酚酸类化学成分积累动态对不同花期的丹参花序中丹酚酸类化学成分的动态积累分析发现,与茎叶相似,花序中同样含有丰富的水溶性丹酚酸类化学成分,其中仍然以迷迭香酸和丹酚酸B量为最高,最高时质量分数分别为1.8%和5.2%;未检测到脂溶性的丹参酮类成分。不同花期丹酚酸类化学成分的总量花序中的积累动态变化见表 3。丹参花序中的丹酚酸总量在盛花期达到最高值,达到7.8%,其在盛花期之前量变化不明显,但当丹参花开始凋谢时,丹酚酸总量开始急剧下降。
| 表 3 丹参花序中主要丹酚酸类化学成分总量动态积累 Table 3Contents of salvianolic acids in S. miltiorrhizaflowers of different growth period |
丹参茎叶和花序均含有丰富的水溶性丹酚酸类化学成分,但在2个组织器官中表现出明显不同的动态积累趋势。丹参茎叶中丹酚酸类成分在4月初至5月中下旬,即丹参由出苗到开花时期,其合成积累逐渐降低。从6月开始,即丹参花期过后,丹酚酸类成分的合成积累逐渐增加;6~8月是丹参地上部分生长旺盛期[11],此时是丹酚酸类成分合成积累的关键时期,其合成积累在7月中旬达到最高值,此后则呈现下降趋势;12月份地上部分枯萎时丹酚酸类成分量为最低。
5月中旬为丹参盛花期,花序中丹酚酸类成分总量在此时达到最高值,提示可能在丹参生长过程中,丹参地上部分营养物质主要是向以丹参花序、果实为中心的生殖器官运输分配,从而抑制营养器官生长,导致该时期丹参茎叶中丹酚酸类成分量较低。花期过后,丹参茎叶中丹酚酸类成分量逐渐升高。9月份后,气温逐渐下降,丹参地上部分叶片开始枯萎脱落,茎叶中的营养物质开始向根中运输,故茎叶中酚酸类量开始逐渐降低。据文献报道[9],此时期根及根茎中的丹酚酸类成分量开始升高,并在10月份达到最高。
3.2 丹参植物体内丹酚酸类化学成分积累与生物合成据研究报道[12, 13],丹参酚酸类化合物除丹参素和咖啡酸等单苯环物质可由氨基酸直接氧化脱氨生成外,其余酚酸类成分如迷迭香酸、丹酚酸B等均由咖啡酸与丹参素缩合产生。结果可看出,迷迭香酸、丹酚酸B量在8月份达到最大值,之后开始急剧下降,而咖啡酸、丹参素等小分子酚酸在7月份量较低,而在8月之后量开始增加,并在9、10月份达到最大值。提示迷迭香酸、丹酚酸B由小分子的酚酸聚合而来,而迷迭香酸、丹酚酸B又可分解为小分子酚酸。
3.3 丹参茎叶、花序与药用部位根茎利用价值分析及资源化利用丹参作为传统中药,其根及根茎中富含丹参酮类和丹酚酸类资源性化学成分,是临床常用活血化瘀中药之一,而其地上部分除少量应用外,大多被废弃造成资源浪费和环境污染。本实验研究表明,丹参茎叶、花序中均含有丰富的丹酚酸类化合物,尤其是迷迭香酸和丹酚酸B量较高,且研究报道[10],丹参在5~7月地上部分生长旺盛时期,叶中酚酸量约是通常采收时期丹参根的1.9倍。提示丹参茎叶、花序是良好的、具有开发潜力的重要资源,可对其适宜生长期的丹参茎叶或花序在不影响药材生长的条件下加以利用,充分提高丹参资源的利用效率。
丹酚酸类资源性物质具有较为广泛的生理活性,如抗氧化、抗血小板聚集、抗血栓、防止动脉硬化、抗肿瘤及抑制HIV整合酶等作用[14, 15, 16, 17],是目前已知的抗氧化作用最强的天然产物之一。目前市场上已有多种丹参及其复方的剂型,如丹参注射液、复方丹参注射液、丹红注射液等。本研究表明,丹参茎叶和花序中含有大量的水溶性丹酚酸类成分,提示可将丹参地上部分作为获取丹酚酸类资源性化学成分的新资源。此外,丹参茎叶中还含有丰富的糖类成分,如开发价值较高的水苏糖等。水苏糖是一种可以调节肠道菌群作用的功能性低聚糖,目前已广泛应用于保健品及婴幼儿食品开发等领域。
通过对丹参非传统药用部位地上茎叶、花序中可利用资源性物质的分析,探讨其资源化利用和综合系统利用,达到资源节约、创新资源价值和保护环境的目的,实现经济和生态的和谐共生,推动中药资源产业经济活动由物质消耗向价值提升转变,延伸资源经济产业链,将对丹参资源植物的综合循环利用和产业经济发展起到积极的推动作用[18]。
| [1] | 段金廒, 宿树兰, 钱大玮, 等. 中药资源化学研究思路方法与进展[J]. 中国天然药物, 2009, 7(5): 333-340. |
| [2] | Su C Y, Qian L M, Khalid R, et al. Salvia miltiorrhiza: Traditional medical uses, chemistry, and pharmacology[J]. Chin J Nat Med, 2015, 13(3): 163-182. |
| [3] | Jiang R W, Lau K M, Hon P M, et al. Chemistry and biological activities of caffeic acid derivatives from Salvia miltiorrhiza[J]. Curr Med Chem, 2005, 12(2): 237-246. |
| [4] | 段金廒. 中药废弃物的资源化利用[M]. 北京: 化学工业出版社, 2013. |
| [5] | Zhang Y, Li X, Wang Z Z. Antioxidant activities of leaf extract of Salvia miltiorrhiza Bunge and related phenolic constituents[J]. Food Chem Toxic, 2010, 48(10): 2656-2662. |
| [6] | 郑云枫, 葛 婷, 夏彦铭, 等. 生长期内丹参不同部位中水苏糖量的动态变化[J]. 南京中医药大学学报, 2014, 30(6): 573-575. |
| [7] | Matkowski A, Zielinska S, Oszmianski J, et al. Antioxidant activity of extracts from leaves and roots of Salvia miltiorrhiza Bunge, S. przewalskii Maxim, and S. verticillata L.[J]. Biores Technol, 2008, 99(16): 7892-7896. |
| [8] | 钟晓凤. 丹参和白花丹参叶的化学成分药理研究及临床应用[J]. 中医临床研究, 2014(3): 135-136. |
| [9] | 邓乔华, 潘永存, 彭 云, 等. 丹参生长期产量与质量的动态变化及最佳采收期研究[J]. 现代中药研究与实践, 2009, 23(4): 3-5. |
| [10] | 秦海燕, 索志荣, 刘文哲. 丹参营养器官中酚酸量的动态变化[J]. 中药材, 2009, 32(8): 1199-1201. |
| [11] | 刘文婷. 丹参的生物学特性研究[D]. 杨凌: 西北农林科技大学, 2004. |
| [12] | Matsuno M, Nagatsu A, Ogilhara Y, et al. Synthesis of 2-O-(4-coumaroyl)-3-(4-hydroxyphenyl) lactic acid, and important intermediate of rosmarinic acid biosyntheis[J]. Chem Pharm Bull, 2001, 49(12): 1644-1646. |
| [13] | 赵淑娟, 章国瑛, 刘 涤, 等. 丹参水溶性酚酸类化合物药理及生物合成途径研究进展[J]. 中草药, 2004, 35(3): 341-345. |
| [14] | Abd-Elazem I S, Chen H S, Bates R B, et al. Isolation of two highly potent and non-toxic inhibitors of human immunodeficiency virus type 1(HIV-1) integrase from Salvia miltiorrhiza[J]. Antiviral Res, 2002, 55: 91-106. |
| [15] | Liu J, Shen H M, Ong C N. Role of intracellular thiol depletion, mitochondrial dysfunction and reactive oxygen speciesin Salvia miltiorrhiza induced apoptosis in human hepatoma HepG2 cells[J]. Life Sci, 2001, 69: 1833-1850. |
| [16] | 王冰瑶, 吴晓燕, 樊官伟. 丹参素保护心血管系统的药理作用机制研究进展[J]. 中草药, 2014, 45(17): 2571-2575. |
| [17] | Wu Y J, Hong C Y, Lin S J, et al. Increase of vitamin E content in LDL and reduction of atherosclerosis in cholesterol-fed rabbits by a water-solube antioxidant-rich fracion of Salvia miltiorrhiza[J]. Arteriocscler Thromb, 1998, 18(3): 481-486. |
| [18] | 段金廒, 宿树兰, 郭 盛, 等. 中药资源产业化过程废弃物的产生及其利用策略与资源化模式[J]. 中草药, 2013, 44(20): 2787-2797. |
 2015, Vol. 46
2015, Vol. 46


