2. 浙江大学馥莉食品研究院, 浙江 杭州 310058
2. Fuli Institute of Food Science, Zhejiang University, Hangzhou 310058, China
红枣Ziziphus jujube Mill. 又名大枣、中华大枣、华枣,是鼠李科枣属植物枣树的果实。红枣具有很高的食用和药用价值,是“药食两用”的上等补品。红枣中的环核苷酸及其衍生物有10多种,主要为环磷酸腺苷 (adenosine 3′,5′-cyclic monophos-phate,cAMP)和环磷酸鸟苷(guanosine-3′,5′-cyclic phosohate,cGMP)[1]。cAMP是第2信使,在调节基因表达、细胞增殖和抑制心脏疾病、过敏性疾病、细胞癌变等方面具有重要作用。医学研究证明至少40多种疾病,包括癌症、高血压、冠心病、心肌梗死和心源性休克等重大疾病与cAMP的代谢有关[3]。
本实验采用高效液相色谱法对塔里木盆地17个引进品种红枣的主要功效成分环核苷酸及其衍生物进行指纹图谱研究,以期为红枣的品质评价和产品质量控制建立有效方法,并对其果实中尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、cAMP和cGMP 7种成分进行了测定分析。
1 仪器与材料岛津高效液相色谱仪;AS3120A超声提取器;BS224S型电子天平;SPSS 19.0统计软件。尿嘧啶(批号RA0410FA14,质量分数≥98%)、次黄嘌呤(批号YT0502RA15,质量分数≥98%)、腺嘌呤(批号XJ0606MA14,质量分数≥98%)、胞苷(批号MM0316YA12,质量分数≥99%)、尿苷(批号TM0313XA13,质量分数≥98%)、cAMP(批号WD0813EA16,质量分数≥99%)、cGMP(批号SS0903GA13,质量分数≥98%)对照品均购于上海源叶生物科技有限公司。
2014年10月16日采集于塔里木大学植物科学院红枣资源圃嫁接一年生红枣,密封冷冻保存。枣品种经塔里木大学植物科学学院园艺系吴翠云教授鉴定为鼠李科(Rhamnaceae)枣Zizyphus jujuba Mill.,具体信息见表 1。甲醇为色谱纯,水为娃哈哈纯净水,其他试剂均为国产分析纯。
| 表 1 红枣来源信息 Table 1 Sources of Z. jujube |
色谱柱:TOSOH TSKgel ODS-100V C18柱(150 mm×4.6 mm,3 μm),流动相:甲醇(A)-0.3%磷酸二氢钾缓冲水溶液(B),梯度洗脱0~2 min,0% A;2~5 min,1% A;5~9 min,4% A;9~13 min,15% A;13~21 min,22% A;21~27 min,30% A;27~30 min,45% A;体积流量1 mL/min;柱温40 ℃,进样量10 μL,检测波长260 nm。HPLC谱图见图 1。
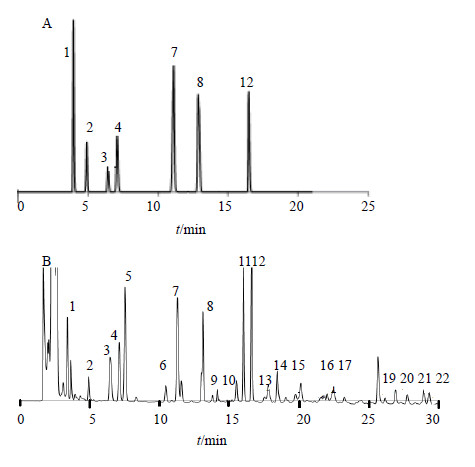 |
1-尿嘧啶 2-胞苷 3-次黄嘌呤 4-尿苷 7-腺嘌呤 8- cGMP 12-cAMP 1-uracil 2-cytidine 3- hypoxanthine 4- uridine 7- adenine 8- cGMP 12-cAMP 图 1 混合对照品 (A) 和样品 (B) HPLC谱图 Fig.1 HPLC of mixed reference substances (A) and samples (B) |
分别精密称取尿嘧啶、次黄嘌呤、腺嘌呤、胞苷、尿苷、cAMP、cGMP对照品适量,加水分别制成尿嘧啶、次黄嘌呤、腺嘌呤、胞苷、尿苷、cAMP、cGMP 1 mg/mL的对照品储备液。
2.2.2 混合对照品溶液的制备分别精密量取上述对照品储备液适量,加水制成含尿嘧啶、次黄嘌呤、腺嘌呤、胞苷、尿苷、cAMP、cGMP分别为10、10、20、16、24、50、10 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备取鲜枣10 g(研磨),精密称定,置100 mL三角瓶中,精密加入蒸馏水50 mL,称定质量,超声提取4次,每次10 min,放冷,再称定质量,用蒸馏水补足减失的质量,摇匀,滤过;精密量取1 mL,过0.45 μm微孔滤膜,得供试品溶液,待测。
2.4 指纹图谱方法学考察 2.4.1 重复性试验取S1样品6份,按“2.3”项下的方法平行制备供试品溶液,按“2.1”项下色谱条件进行测定,以共有峰的相对保留时间和相对峰面积计算RSD,运用相似度评价系统,将6次测定样品数据导入中药色谱指纹图谱相似度评价系统2004A,结果相对保留时间和相对峰面积RSD均小于3.2%,表明重复性良好。
2.4.2 精密度试验取S1样品1份,按“2.3”项制备供试品溶液,连续进样6次,以共有峰的相对保留时间和相对峰面积为指标计算RSD,运用相似度评价系统,将6次测定样品数据导入中药色谱指纹图谱相似度评价系统2004A,结果相对保留时间和相对峰面积RSD均小于3.0%,表明精密度良好。
2.4.3 稳定性试验 取S1样品1份,按“2.1”项色谱条件分别在0、2、4、8、12、24 h进样检测,以共有峰的相对保留时间和相对峰面积计算RSD,运用相似度评价系统,将6次测定样品数据导入中药色谱指纹图谱相似度评价系统2004A,结果相对保留时间和相对峰面积RSD均小于2.3%。结果表明,红枣指纹图谱测定方法具有可信的精密度和重复性,供试品溶液在24 h内稳定,可以获得可靠的指纹图谱。 2.5 指纹图谱的建立及相似度分析分别取17批样品,按“2.1”项色谱条件进行测定,运用药典委员会中药色谱指纹图谱相似度评价系统2004A进行分析,将实验数据导入中药色谱指纹图谱相似度评价软件,设定S1为参照图谱,将各色谱峰匹配,建立指纹图谱,见图 2,其中R为指纹图谱共有模式,并对实验数据进行相似度计算,对照谱图采用“平均数”法生成,然后生成对照图谱。共标定22个共有峰,指认其中7个峰,17个不同品种红枣与对照谱之间的相似度结果见表 2。
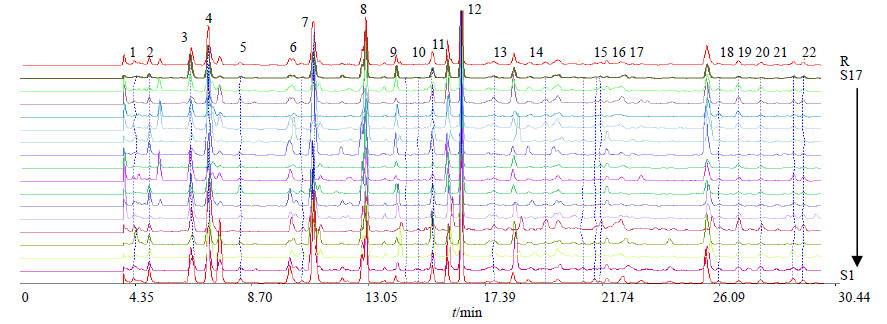 |
1-尿嘧啶 2-胞苷 3-次黄嘌呤 4-尿苷 7-腺嘌呤 8-cGMP 12-cAMP 1-uracil 2-cytidine 3- hypoxanthine 4-uridine 7- adenine 8- cGMP 12-cAMP 图 2 17批样品HPLC指纹图谱和共有模式Fig.2 HPLC fingerprint and common mode of 17 batches of samples |
| 表 2 样品HPLC指纹图谱的相似度 Table 2 Similarities of HPLC fingerprint of each sample |
以17批样品指纹图谱中22个共有峰的相对峰面积为变量,运用SPSS19.0数据统计软件,采用欧氏距离进行聚类分析研究,结果见图 3。若将17批样品分为3类,由图 3可知,S11、S12、S2、S4、S1、S7、S3、S15、S6、S17、S5、S13、S16、S8、S14为一类,S9为一类,S10为一类。
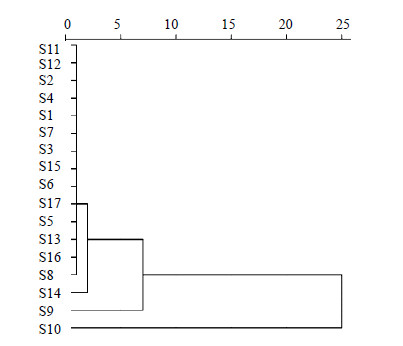 | 图 3 17批样品的聚类分析Fig.3 Hierarchical cluster analysis of 17 batches of samples |
分别取“2.2.2”项下的混合对照品溶液用水稀释成5个不同质量浓度的对照品溶液,每个质量浓度平行测定3次,以质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,计算回归方程,结果见表 3。
| 表 3 7个化合物的线性回归方程及相关系数 Table 3 Linear regression equations and correlations of seven compounds |
取同一对照品混合溶液,在“2.1”项的色谱条件下重复进样5次,测得各共有色谱峰的相对峰面积的RSD均小于1%,表明仪器精密度良好。
2.7.3 重复性试验取S1号样品5份,每份约10 g,精密称定,按“2.3”项下方法平行制备成供试品溶液,在“2.1”项的色谱条件下进样测定,结果显示,各共有色谱峰的相对峰面积的RSD均小于3%,表明方法重复性良好。
2.7.4 稳定性试验取S1号供试品溶液,在“2.1”项的色谱条件下,分别在0、2、4、8、12、24 h进样,测得各共有色谱峰的相对峰面积的RSD均小于3%,表明供试品溶液在24 h内稳定性良好。
2.7.5 加样回收率试验精密量取5份已测定的供试品溶液,每份1 mL,分别加入1 mL混合对照品溶液(尿嘧啶、次黄嘌呤、腺嘌呤、胞苷、尿苷、cAMP、cGMP质量浓度分别为10、10、20、16、24、50、10 μg/mL),按“2.3”项下方法制备供试品溶液,在“2.1”项的色谱条件下测定并计算5份样品中7种成分的平均加样回收率和RSD。结果表明,尿嘧啶、次黄嘌呤、腺嘌呤、胞苷、尿苷、cAMP、cGMP的平均加样回收率分别为95.51%、98.82%、101.41%、100.54%、93.95%、97.68%、95.58%,RSD分别为2.08%、1.91%、1.34%、1.17%、2.36%、1.35%、2.65%。
2.7.6 样品测定取鲜枣10 g(研磨),精密称定,按“2.3”项下的方法制备供试品溶液,在“2.1”色谱条件下分别进样10 μL进行测定,采用外标法计算样品中7种成分的质量分数,结果见表 4。对17个外引品种红枣中尿嘧啶、次黄嘌呤、腺嘌呤、胞苷、尿苷、cAMP、cGMP进行定量测定。尿嘧啶量为28.76~347.99 μg/g,胞苷量为37.31~332.11 μg/g,次黄嘌呤量为49.20~1 192.73 μg/g,尿苷质量分数为40.28~1 142.05 μg/g,腺嘌呤量为6.71~841.32 μg/g,cGMP量为104.99~659.67 μg/g,cAMP量为191.39~2 063.17 μg/g。
| 表 4 新鲜红枣中7个成分的量 Table 4 Seven component contents in fresh Z. jujube |
对供试品溶液分别超声提取1~6次,分别收集不同提取次数的提取液进行分析,结果表明不同提取次数的提取率不同,提取次数大于1次时,cAMP的提取率有所提高,提取次数大于5次时,cAMP的提取率变化不明显,考虑到操作简单的因素,因此选择超声提取次数为4次。
在本实验条件下,大多数色谱峰都得到了较好地分离。本实验对17批样品进行了HPLC指纹图谱构建和解析,标定了22个共有峰,和已知对照品相比较,指认其中7个峰,其中,峰1、2、3、4、7、8和12分别是尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、cGMP、cAMP。对17批样品进行了系统聚类分析,结果表明这17批样品可分为3类,旧庄窝枣为一类,骏枣2为一类,其余为一类。从分析结果可看出,17批样品质量较稳定,均一性较好。本方法精密度、重复性、稳定性较好,本实验对红枣的HPLC指纹图谱进行多方面的比较考察,得到的结果可靠,可用于红枣品质的综合评价。
| [1] | 姜晓燕. 灵武长枣中活性物质及总抗氧化能力的研究 [D]. 天津: 天津科技大学, 2010. |
| [2] | 刘孟军, 王永蕙. 枣和酸枣等14种园艺植物cAMP含量的研究 [J]. 河北农业大学学报, 1991, 14(4): 20-23. |
| [3] | 王向红. 枣果主要活性成分分析方法及其综合加工技术研究 [D]. 石家庄: 河北农业大学, 2003. |
| [4] | 肖 蓉, 张志斐, 韩学静, 等. 不同产地柴胡药材GC-MS指纹图谱研究 [J]. 中草药, 2006, 37(8): 1248-1252. |
| [5] | 李 强, 杜思邈, 张忠亮. 中药指纹图谱技术进展及未来发展方向展望 [J]. 中草药, 2013, 44(22): 3095-3104. |
| [6] | 曹建军, 梁宗锁, 杨东风. 地黄HPLC-DAD多波长指纹图谱的建立及其在熟地黄炮制中的应用 [J]. 中草药, 2014, 45(2): 265-270. |
| [7] | 黄立兰, 程文胜, 陈耀娣. 人参指纹图谱的研究进展 [J]. 中草药, 2013, 44(2): 241-246. |
| [8] | 高新彪, 孙 磊, 乔善义, 等. 牡丹皮HPLC指纹图谱研究 [J]. 中草药, 2013, 44(7): 900-904. |
| [9] | 覃洁萍, 冯 旭, 邓家刚, 等. 杧果叶HPLC指纹图谱共有模式的建立及在近缘品种扁桃叶鉴别中的应用 [J]. 中草药, 2010, 41(9): 1543-1546. |
| [10] | Zhao G, Peng L X, Wang S, et al. HPLC fingerprint-antioxidant properties study of buckwheat [J]. J Integr Agric, 2012, 11(7): 1111-1118. |
 2015, Vol. 46
2015, Vol. 46


