2. 抚州市第一人民医院, 江西 抚州 344000;
3. 西藏藏医学院, 西藏 拉萨 850000
2. The First People's Hospital of Fuzhou, Fuzhou 344000, China;
3. College of Tibetan Medicine, Lhasa 850000, China
裂叶独活Heracleum millefolium Diels为伞形科(Umbelliferae)独活属,又名藏当归(青海)、千叶独活(秦岭植物志),产于我国西藏、青海、甘肃、四川、云南,属于高海拔药材。裂叶独活传承了藏药效果快、药力强、纯净、天然、无污染的特点,以干燥全草入药,味苦、辛,性平,消散肿胀、破除癥结痞块。饶高雄等[1]从裂叶独活中分离鉴定了11个化学成分,其中香豆素类成分有4个。文献调研显示裂叶独活化学成分研究报道较少,因此,进一步阐明裂叶独活中的化学成分,对研究其药效物质基础、质量控制、现代藏药的开发等具有重要意义。查阅大量文献,未见关于裂叶独活活性成分的研究。据报道,香豆素成分广泛存在于独活属植物中,其中二氢欧山芹醇当归酸酯具有很好的抗炎、镇痛效果[2];蛇床子素在癌症和肝脏、脑部疾病等方面发挥重要作用[3, 4, 5];二氢欧山芹醇乙酸酯可以明显抑制大鼠体外血小板的聚集[6]。
高速逆流色谱(high-speed countercurrent chromatography,HSCCC)是20世纪80年代发展起来的一种连续高效的液-液分配色谱分离技术,被广泛应用于中药、食品、抗生素、蛋白质和多肽等分离制备方面[7, 8, 9, 10, 11, 12, 13]。传统的制备分离单体方法存在耗时、溶剂消耗量大,而且污染环境等缺点,HSCCC具有无污染、无吸附、一次制备量大、操作简单、耗材低廉、所用溶剂少、分离时间短、制备样品纯度高等优点,甚至可用于制备高质量分数的标准品[14]。
本研究中采用溶剂提取法和液-液萃取法得到裂叶独活粗提物,以此粗提物为原料利用HSCCC进行化学成分的分离纯化,得到3种香豆素类化合物蛇床子素、二氢欧山芹醇乙酸酯和二氢欧山芹醇当归酸酯,质量分数均达到96.0%以上。该法简单、快速、高效,分离纯度高。目前还未见关于利用HSCCC法从裂叶独活中一次性分离纯化3种高质量分数的香豆素类成分的报道。该研究结果可为裂叶独活的药理药效、物质基础研究和临床应用研究提供有用参考和信息,同时也为香豆素类成分的制备分离提供一种快速、简单、高效的方法。
1 仪器与材料TBE-300C型高速逆流色谱仪,上海同田生物技术股份有限公司;Agilent1260型自动进样高效液相色谱仪、Agilent1260DAD检测器、Agilent C18色谱柱(250 mm×4.6 mm,5 μm),美国安捷伦公司;Bruke Avance 400型超导核磁共振仪、VERTEX70型红外光谱仪,瑞士布鲁克公司;X-4A数字熔点测定仪,北京福凯仪器有限公司;N7001型旋转蒸发仪,厦门精艺兴业科学仪器有限公司;Triple QUAD 5500,ABsciex公司;高速多功能粉碎机,永康市绿可食品有限公司;SZ-93A型自动双重纯水蒸馏器,上海亚荣生化仪器厂;Milli-Q超纯水制备系统,美国Millipore公司;真空干燥箱,上海恒科学仪器有限公司;万分之一电子天平,北京赛多利斯仪器系统有限公司。
石油醚(AR),沸程60~90 ℃,天津市恒兴化学试剂制造有限公司;正己烷(AR)、醋酸乙酯(AR)、95%乙醇(AR),上海泰坦科技公司,甲醇(AR),上海试一化学试剂有限公司;HPLC流动相中所使用的水均为Milli-Q超纯水,其他用水为双蒸水;甲醇为色谱级,美国Tedia试剂公司。
裂叶独活根采集于拉萨市当雄县,经西藏藏医学院实验标本中心达瓦讲师鉴定为裂叶独活Heracleum millefolium Diels的根,晒干后用于实验。样品保存于江西中医药大学药学院实验标本中心。
2 方法和结果 2.1 裂叶独活粗提物的制备将裂叶独活在45 ℃下真空干燥12 h,粉碎过60目筛,称取1 000 g,用5倍量95%乙醇常温浸泡24 h,重复3次,合并上清液。将上清液减压浓缩得浸膏,加适量水混悬,用3倍量石油醚萃取5次,合并萃取液,减压浓缩得到20.9 g浸膏,得率为2.1%,常温保存备用。
2.2 溶剂系统筛选以试管法结合HPLC法,测定HSCCC溶剂系统的分配系数(K)。取1 mg裂叶独活粗提物溶于上、下相各1 mL的溶剂体系中,振摇,静置,重新分层后,取等量的上、下相溶液分别用HPLC检测I、II、III号峰,用上相峰面积除以下相峰面积即得到K值。HSCCC最佳的K值一般为0.5~2.0,如果K值>2.0,则目标成分分离时间延长;当K值<0.5时,目标成分与其他成分重叠而不能分开[10],以此为依据,共考察了5个不同体积比的溶剂体系,见表 1。根据K值,选择了第3种溶剂体系。
| 表 1 不同溶剂体系3个组分K值 Table 1 K values of three compounds in different solvent systems |
预实验结果表明,当流动相体积流量为2 mL/min时,III号峰完全出来共用了将近330 min,实验时间太长,尝试将体积流量改为3 mL/min,拟达到不影响分离效果的前提下缩短实验时间的目的,实验时间缩短为250 min;固定进样体积为20 mL,依次加大进样质量浓度为5、10、15、20、25、30 mg/mL,发现以大于15 mg/mL为进样质量浓度时会有固定相流失,所以实验选择进样质量浓度为15 mg/mL,尽量增加一次实验的制备量;升高温度有利于增加固定相的保留率,但是也会让两相的互渗性增加,而且主机里的管路容易老化,而降低仪器寿命,因此保持循环水温度为25 ℃;转速越快,分离效果越好,但是转速太快又会缩短主机里的皮带寿命,综合考虑选择转速为850 r/min。经优化后,实验能够达到最优的分离效果,且达到节省时间和保护仪器的目,固定相保留率达到73%。
2.4 HSCCC分离制备以正己烷-醋酸乙酯-乙醇-水(1.5∶2∶2.5∶1.5)作为溶剂体系。将这4种溶剂按比例混合后,强烈震摇,静置分离上下相并超声脱气20 min。开启循环水泵恒温装置,使温度保持在25 ℃,紫外检测吸收波长为323 nm。将上相(固定相)以30 mL/min的体积流量泵入主机,泵满后,正转,调转速为850 r/min,以3 mL/min的体积流量把下相(流动相)泵入主机。当只有下相从检测器流出时,及体系达到流体动力学平衡时,计算保留率为73%。取上、下相各10 mL溶解300 mg裂叶独活粗提物浸膏溶液由进样阀注入分离管路。根据HSCCC色谱图手动收集各色谱峰馏份,得到裂叶独活粗提物的HSCCC色谱图见图 1。所接收馏份在50 ℃下减压浓缩、静置滤过得到晶体,待测。
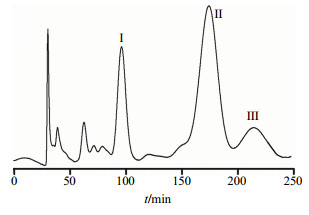 |
I-二氢欧山芹醇乙酸酯 II-蛇床子素 III-二氢欧山芹醇当归酸酯 I-columbianetin acetate II-osthole III-columbianadin 图 1 裂叶独活粗提取物HSCCC图谱Fig.1 HSCCCof crude extract from H. millefolium |
香豆素成分的2个最大紫外吸收区集中在280、350 nm附近[14],经HPLC-DAD检测可知,二氢欧山芹醇乙酸酯的最大吸收峰在330 nm附近,蛇床子素的最大吸收峰在320 nm附近,二氢欧山芹醇当归酸酯的最大吸收峰在325 nm附近,综合考虑,实验选择323 nm作为检测波长。将HSCCC所得的3种晶体用甲醇溶解,均制备成质量浓度为100 μg/mL,进样。流动相为甲醇-水(70∶30),体积流量为1.0 mL/min,柱温为20 ℃,检测波长为323 nm,进样量5 μL。用Agilent1260色谱工作站进行质量分数分析。按峰面积归一化法计算质量分数,测定结果为二氢欧山芹醇乙酸酯的质量分数为98.1%,称定质量为6.3 mg,得率为2.1%;蛇床子素质量分数为97.3%,称定质量为10.6 mg,得率为3.5%;二氢欧山芹醇当归酸酯质量分数为96.9%,称定质量为6.4 mg,得率为2.1%。3种晶体的HPLC图见图 2。
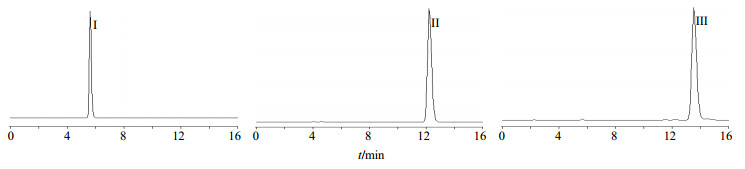 |
I-二氢欧山芹醇乙酸酯 II-蛇床子素 III-二氢欧山芹醇当归酸酯 I-columbianetin acetate II-osthole III-columbianadin 图 2 HSCCC分离的3种晶体的HPLC图Fig.2 HPLCof three crystals obtained by HSCCC |
组分I:白色粒状结晶(甲醇-水70∶30),mp 133~134 ℃;IRvmaxKBr(cm−1): 1 728(内酯环), 1 614, 1 580, 1 488, 1 453, 841;ESI-MS m/z: 288 [M]+ (甲醇), 228, 213, 203, 187, 176, 159, 131, 77, 59;1H-NMR (400 MHz, CDCl3) δ: 6.21 (1H, d, J = 18.0 Hz, H-3), 7.65 (1H, d, J = 9.6 Hz, H-4), 7.28 (1H, d, J = 8.4 Hz, H-5), 6.76 (1H, d, J = 8.4 Hz, H-6), 3.30 (2H, dd, J = 7.6, 7.6 Hz, H-3′), 5.15 (1H, dd, J = 18.0, 16.4 Hz, H-2′), 1.58 (3H, s, H-4′), 1.52 (3H, s, H-5′),2.01 (3H, s, OAc-CH3);13C-NMR (100 MHz, CDCl3) δ: 170.1 (OAc-C=O),160.8 (C-2), 112.3 (C-3), 143.8 (C-4), 128.8 (C-5), 106.6 (C-6), 163.9 (C-7), 113.4 (C-8), 151.3 (C-9), 113.4 (C-10), 27.6 (C-1′), 88.7 (C-2′), 82.1 (C-3′), 22.1 (C-4′), 22.0 (C-5′), 20.9 (OAc-Me)。以上数据与文献报道基本一致[15, 16],故鉴定为二氢欧山芹醇乙酸酯。
组分II:无色块状结晶(甲醇-水70∶30),mp 83~84 ℃;IRvmaxKBr(cm−1): 1 720 (-C=O), 1 604, 1 562, 1 499 (Ar), 1 251 (-C-O);ESI-MS m/z: 244 [M]+ (甲醇), 229, 213, 201, 159, 131, 103, 89, 77, 63, 51;1H-NMR (400 MHz, CDCl3) δ: 1.67 (3H, s, H-5′), 1.84 (3H, s, H-4′), 3.52 (2H, d, J = 8.0 Hz, H-1′), 3.92 (3H, s, OCH3), 5.22 (1H, m, H-2′), 6.83 (1H, d, J = 8.0 Hz, H-6), 7.28 (1H, d, J = 8.0 Hz, H-5), 7.61 (1H, d, J = 8.0 Hz, H-4), 6.23 (1H, d, J = 6.2 Hz, H-3);13C-NMR (100 MHz, CDCl3) δ: 160.2 (C-2), 113.0 (C-3), 143.6 (C-4), 126.2 (C-5), 107.4 (C-6), 161.2 (C-7), 113.0 (C-8), 152.9 (C-9), 118.1 (C-10), 21.9 (C-1′), 121.2 (C-2′), 132.5 (C-3′), 25.7 (C-4′), 17.8 (C-5′), 56.1 (OCH3)。以上数据与文献报道基本一致[15],鉴定为蛇床子素。
组分III:白色针形结晶(甲醇-水80∶20),mp 114~115 ℃;IRvmaxKBr(cm−1): 1 710 (内酯环), 1 616, 1 579, 1 491 (Ar), 1 455, 1 385;ESI-MS m/z: 328 [M]+ (甲醇), 228, 213, 187, 159, 131, 83, 55, 43;1H-NMR (400 MHz, CDCl3) δ: 6.21 (1H, d, J = 9.6 Hz, H-3), 7.63 (1H, d, J = 8.3 Hz, H-4), 7.26 (1H, d, J = 7.6 Hz, H-5), 6.74 (1H, d, J = 8.0 Hz, H-6), 3.38 (2H, m, H-3′), 5.13 (1H, t, J = 8.0 Hz, H-2′), 1.60 (3H, s, H-4′), 1.64 (3H, s, H-5′), 5.98 (1H, m, H-3″), 1.89 (3H, dd, J = 8.0, 2.0 Hz, 3″-CH3), 1.67 (3H, s, 2″-CH3);13C-NMR (100 MHz, CDCl3) δ: 160.9 (C-2), 113.0 (C-3), 143.8 (C-4), 128.8 (C-5), 106.6 (C-6), 164.0 (C-7), 112.2 (C-8), 151.3 (C-9), 113.5 (C-10), 89.2 (C-2′), 27.6 (C-3′), 82.0 (C-4′), 21.2 (4′-CH3), 22.3 (4′-CH3), 167.1 (C-1″), 128.7 (C-2″), 137.3 (C-3″), 15.5 (2″-CH3), 20.4 (3″-CH3)。以上数据与文献报道基本一致[15, 17],鉴定为二氢欧山芹醇当归酸酯。
3 讨论本实验采用HSCCC法,以正己烷-醋酸乙酯-甲醇-水(1.5∶2∶2.5∶1.5)作为溶剂体系,一次性从裂叶独活粗提物中分离制备到3种香豆素类化合物,质量分数均高于96%。裂叶独活作为一种藏药,相对研究比较少。二氢欧山芹醇乙酸酯、蛇床子素和二氢欧山芹醇当归酸酯具有多种药理活性,推断这些成分很有可能是裂叶独活的活性成分。本实验利用HSCCC一次制备这3种香豆素成分量大,这不仅为裂叶独活药性物质基础的研究提供依据,同样为其他香豆素类的分离制备提供参考。同时,本研究充分体现了HSCCC法的简单、高效、快速、制备量大和制备质量分数高等优点。HSCCC拥有众多优势,但其也存在一些缺点,如精密度不如分析性色谱仪器高,溶剂体系选择方法及理论远不如其他色谱成熟等。
| [1] | 绕高雄, 溥发鼎, 孙汉董. 裂叶独活和长裂叶独活的化学成分及其分类学意义 [J]. 天然产物研究与开发, 1995, 7(2): 16-19. |
| [2] | 马 哲, 梁茂新. 二氢欧山芹醇当归酸酯在家兔体内的药动学 [J]. 中国医院药学杂志, 2010, 30(21): 1817-1818. |
| [3] | Zhang Y, Xie M L, Xue J, et al. Osthole improves fat milk-induced fatty liver in rats: Modulation of hepatic PPAR-alpha/gamma-mediated lipogenic gene expression [J]. Planta Med, 2007, 73(8): 718-724. |
| [4] | Guh J H, Yu S M, Ko F N, et al. Antiproliferative effect in rat vascular smooth muscle cells by osthole, isolated from Angelica pubescens [J]. Eur J Pharmacol, 1996, 298(2): 191-197. |
| [5] | 何 蔚, 刘建新, 周钰梅, 等. 蛇床子素对大鼠脑缺血/再灌注损伤的保护作用及其机制 [J]. 中国药理学通报, 2008, 24(11): 1528-1530. |
| [6] | 吴雅娜, 栾立标. 二氢欧山芹醇乙酸酯在体单灌流肠吸收研究 [J]. 中国药学杂志, 2008, 43(22): 1719-1722. |
| [7] | 胡 瑕, 谢红旗, 罗 巍, 等. 高速逆流色谱法分离制备蛹虫草发酵液中虫草素 [J]. 中草药, 2013, 44(5): 557-561. |
| [8] | Liu D, Chen X F, Song X Y. Application actuality of high-speed countercurrent chromatography (HSCCC) [J]. Food Machin, 2006, 22(2): 98-101. |
| [9] | 胡利锋, 廖晓兰, 柏连阳, 等. 硅胶柱色谱-高速逆流色谱法分离纯化羌活中佛手柑内酯 [J]. 中草药, 2013, 44(6): 701-704. |
| [10] | Ito Y. Golden rules and pit fallsin selecting optimum conditions for high speed counter-current chromatography [J]. J Chromatogr A, 2005, 1065(2): 145-168. |
| [11] | 林文津, 徐榕青, 张亚敏, 等. 超临界流体萃取-高速逆流色谱法分离纯化泽泻中23-乙酰泽泻醇B [J]. 中草药, 2014, 45(20): 2928-2931. |
| [12] | 韩利文, 陈锡强, 袁延强, 等. 高速逆流色谱在中药现代化研究中的应用 [J]. 现代药物与临床, 2010, 25(4): 241-246. |
| [13] | 楼招欢, 杨 波, 沈 炜, 等. 丹参二萜醌部位高速逆流色谱制备工艺及体外抗肿瘤活性研究 [J]. 中草药, 2015, 46(5): 679-682. |
| [14] | 尹连红. 高速逆流色谱技术在天然产物分离制备中的探索性研究 [D]. 大连: 大连医科大学, 2010. |
| [15] | 张才煜, 张本刚, 杨秀伟. 独活化学成分研究 [J]. 解放军药学学报, 2007, 23(4): 241-245. |
| [16] | 孙希彩, 张春梦, 李金楠, 等. 紫花前胡的化学成分研究 [J]. 中草药, 2013, 44(15): 2044-2047. |
| [17] | 许剑锋, 孔令义. 紫花前胡茎叶化学成分的研究 [J]. 中国中药杂志, 2001, 26(3): 178-179. |
 2015, Vol. 46
2015, Vol. 46


