随着生活水平的提高和生活方式的改变,肥胖与2型糖尿病的发病率逐渐升高,引起了现代医学的广泛关注。肥胖与2型糖尿病的发生、发展密切相关。肥胖可导致糖代谢异常并发生胰岛素抵抗,促进2型糖尿病的发生[1];2型糖尿病患者常合并有脂代谢异常,单纯控制血糖不能完全消除糖尿病患者发生冠心病等大血管并发症的潜在隐患,在控制血糖的同时,必须要进行调脂治疗[2]。目前对于2型糖尿病的治疗手段仍然局限于对症治疗,长期服用降糖药会产生不可避免的毒副作用,而手术治疗风险大、费用高。肥胖的全球性流行,促使减肥药市场成为发达国家增长最快的市场之一,但是安全性问题使合成减肥药市场面临巨大的困难,严重的不良反应事件迫使大多合成减肥药退出市场。如长期服用减肥药芬特明(Phentermin)会导致心跳加速、精神紧张、失眠、妄想,可诱发高血压危象,美国FDA于2000年禁止其销售[3];西布曲明(Sibutramine)可能引起血压升高、心率加快,也于2010年被撤市[4]。由于合成药物伴随着大量的副作用,因此从天然产物中寻找安全、高效的降糖、调脂药物成为了研究热点。
尼酸(quinic acid)组成的缩酚酸,由植物在有氧呼吸过程中经莽草酸途径产生,在中药材和食物中分布广泛[5]。天然植物中的CGA常伴有异构体存在,从植物中提取分离的CGA往往为混合物[6],其中以5-O-咖啡酰奎尼酸(5-CQA)为最主要的异构体[7]。CGA具有抗菌、抗氧化、抗炎、保肝利胆、抗致畸、预防心血管疾病和某些癌症、降血压、降血糖、调节脂质代谢等广泛的药理作用[8,9,10,11,12],是国际公认的“植物黄金”。目前在食品、医药、日用化工领域对CGA的利用主要集中在清除自由基、抗菌消炎等方面,《卫生部药品标准》收录的170多种具有清热解毒、抗菌消炎的中成药中,均含有CGA类物质。近年来,越来越多的研究表明CGA能够改善胰岛素敏感性,调节糖、脂代谢,这对肥胖、糖尿病、代谢综合征等慢性疾病的防治具有重要意义。本文将就绿原酸对糖、脂代谢的影响及其主要的作用机制进行综述。 1 植物中的CGA
CGA普遍存在于各类植物中,主要存在于忍冬科忍冬属Lonicera L.、菊科蒿属Artemisia L. 等植物中。CGA的生物学分布受多种因素影响,如土质、气候、器官部位、采收时期、贮藏时间等。CGA含量较高的植物主要有杜仲、金银花、咖啡、青梅、向日葵、绿茶、苦丁等。杜仲叶中CGA的量可达1%~5.5%[13],远高于树皮。树龄和产地对杜仲CGA的量影响极大[14],树龄越小,CGA的量越高。此外,干燥方式也有一定影响,快速烘干叶>晒干叶>阴干叶[15]。CGA是金银花的主要活性成分和质量评价指标[16,17],金银花中CGA量在4%~8%,且花>叶>茎>根[18],花蕾期(未开放的绿针、白针)CGA量相对最高[19]。咖啡绿豆中CGA的量为5%~12%,其中5-咖啡酰奎尼酸的量最高[20],且CGA的量随着种植地区海拔的增高而增加[21]。青梅花、枝、叶中CGA的量分别约为4.8%、1.1%和2.1%,是优良的CGA天然资源[22]。葵花籽壳和仁中CGA的量也较高,葵花籽中含1.5%~3.3%,葵花籽仁中含2.1%~3.5%[23]。 2 CGA的吸收代谢
CGA的生物活性在很大程度上取决于其吸收水平和代谢形式。CGA在胃、小肠、大肠均有吸收,在胃和小肠中以原型吸收入血。在回肠造口术志愿者实验中发现,约1/3(29%)CGA从小肠吸收进入血液循环,约70% CGA进入盲肠[24]。体外培养人小肠上皮细胞研究表明CGA主要通过旁细胞扩散方式进行不饱和转运[25]。CGA在体外与白蛋白结合力较强,推测CGA在体内运输和储存的形式是与白蛋白结合形成复合体[26],但不同浓度时结合方式有所不同:在低浓度时,只有一个结合位点;高浓度时,存在多个结合位点。结合的主要部位在白蛋白的IIA区域。CGA在体内的血浆蛋白结合率仍不清楚[27]。
CGA在肠道和肝脏均发生生物转化。Azuma等[28]比较了大鼠ig与ip CGA后血浆中血药浓度,发现ip给药大鼠的血浆中CGA原型浓度高,可见少量代谢物,而ig给药的大鼠血浆中未检测到CGA原型,说明肠道是CGA代谢的主要部位。大部分CGA到达结肠被肠道菌群分解为咖啡酸和奎尼酸,再进一步代谢为马尿酸、阿魏酸、异阿魏酸以及部分m-香豆酸。透过肠道屏障的CGA、咖啡酸和奎尼酸在肝脏中进一步代谢[20],咖啡酸的代谢途径:①甲基化反应,咖啡酸的羟基在儿茶酚邻位甲基转移酶作用下发生甲基化,形成邻位羟基-甲氧基,转化为阿魏酸和异阿魏酸;②氧化反应,阿魏酸侧链被氧化,生成香草酸;③还原反应,侧链不饱和键被还原,生成二氢阿魏酸、二氢咖啡酸、二氢异阿魏酸;④结合反应,与葡萄糖醛酸、硫酸、甘氨酸结合成酯,如咖啡酸形成3-或4-O-硫酸酯;阿魏酸形成阿魏酸-4-O-硫酸酯[24];马尿酸与甘氨酸结合[29](图 1)。
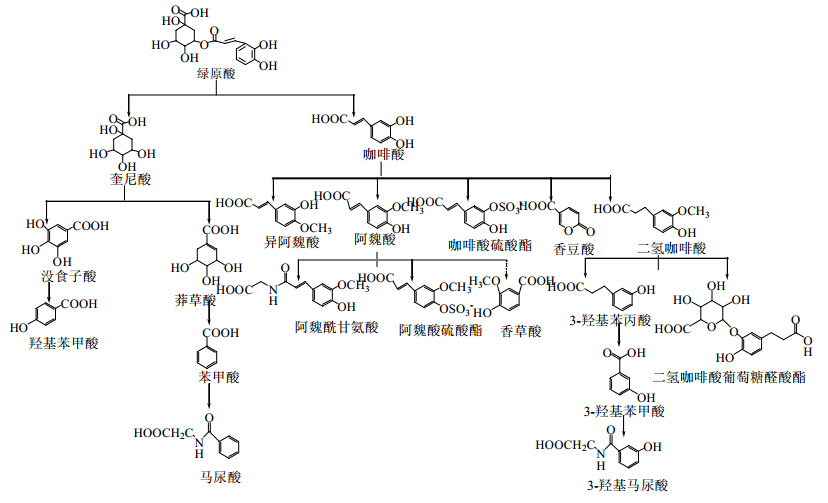 | 图 绿原酸可能的代谢途径及代谢产物 Fig. 1 Possible metabolic pathways and metabolites of CGA |
大量人群流行病学调查显示,经常饮用咖啡与2型糖尿病的发病呈负相关,如每天饮用3~4杯去咖啡因的咖啡可以降低30%患2型糖尿病的风险[30]。研究发现,咖啡因会损害胰岛素敏感性,但咖啡却有利于改善糖耐量,因此研究者普遍推测咖啡中起主要降血糖作用的生物活性成分是CGA而不是咖啡因。
健康志愿者饮用富含CGA的速溶咖啡后葡萄糖吸收率比摄食普通速溶咖啡降低6.9%[31]。在大鼠口服葡萄糖糖耐量试验中,CGA显著降低血浆葡萄糖峰值,这极有可能是由于减少了肠道对葡萄糖的吸收[32]。
胰岛素抵抗(IR)和胰岛素分泌缺陷是2型糖尿病主要发病机制,CGA被认为是一种新型的胰岛素增敏剂[33]。梁秀慈等[34]发现CGA可以明显改善小鼠糖耐量能力,升高胰岛素敏感指数,降低胰岛 素抵抗指数,下调肝脏葡萄糖-6-磷酸酶mRNA水平,上调骨骼肌葡萄糖转运蛋白(GLUT-4)mRNA水平,有效缓解高脂乳诱导的小鼠胰岛素抵抗。Tousch等[35]报道,CGA可以促进L6肌细胞对葡萄糖的摄取,而该作用只有在刺激胰岛素分泌情况下才发生。临床试验也证实,咖啡中的CGA能影响人体胃肠道激素和胰岛素分泌,对葡萄糖转运吸收具有拮抗作用[36]。 4 CGA对脂代谢的影响
CGA主要通过促进脂肪代谢、调节脂肪合成有关的酶和基因的表达而影响脂肪代谢。给具有肥胖、高脂血症和胰岛素抵抗表征的Zucker大鼠每天iv CGA(5 mg/kg),3周后大鼠空腹血浆胆固醇和三酰甘油浓度分别下降44%和58%,肝脏三酰甘油浓度下降24%,血浆、肝脏和脾脏中矿物质的量显著变化(P<0.05)[37]。以含0.02% CGA的膳食干预高脂饮食的正常小鼠8周后,CGA干预组小鼠的体质量、附睾白色脂肪和肾周脂肪量均显著下降,瘦素和胰岛素水平降低,脂联素水平提高,三酰甘油(血浆、肝脏、心脏)和胆固醇(血浆、脂肪组织、心脏)浓度降低,脂肪酸合成酶、3-羟基-3-甲基戊二酰辅酶A还原酶和胆固醇酰基转移酶活性显著抑制,脂肪酸β-氧化活性和肝脏中过氧化物酶体增殖物激活受体-α(PPAR-α)表达增加[38]。
在人群干预试验中,50名体质量指数(BMI)大于25的肥胖者随机分为实验组(30名)和对照组(20名),每天分别服用2粒富含CGA的绿咖啡豆提取物(Svetol®胶囊,每粒200 mg,CGA质量分数45%)和安慰剂,并给予低热量饮食。60 d后,实验组和对照组体质量分别减少(4.97±0.32)kg和(2.45±0.37)kg(P<0.001),肌肉与脂肪比分别增加(4.1±0.7)%和(1.6±0.6)%(P<0.001)。表明绿咖啡豆提取物能够增加沉积脂肪消耗并减少脂肪积累,增强低热量饮食的减重效果[39]。在一项交叉试验中,16名超重成年人人均每天接受高剂量CGA(1050 mg)、低剂量CGA(700 mg)或安慰剂各6周,洗脱期2周,22周后超重者的体质量、身体脂肪百分比、心脏速率及BMI均下降,且6名超重者的BMI降到正常范围[40]。 5 绿原酸调节糖/脂代谢的作用机制
现有的人群流行病学和动物实验研究表明,CGA对糖/脂代谢的调节可能通过多种机制共同作用,如调节糖/脂代谢相关的酶活性及激素水平、激活环磷酸腺苷(AMP)活化蛋白激酶、增强PPAR-α表达等。 5.1 抑制α-葡萄糖苷酶活性
餐后高血糖通过对脉管系统的损伤作用直接参与糖尿病并发症的发生、发展[41],抑制α-葡萄糖苷酶能控制餐后高血糖。郑毅男等[42]通过体外实验观察咖啡热水提取物对α-葡萄糖苷酶活性的抑制作用,结果表明咖啡中的主要成分咖啡因对α-葡萄糖苷酶的活性没有抑制作用,而CGA具有较强抑制作用,并且在大鼠po耐糖实验中,CGA能明显抑制血糖上升。最新研究数据显示,从紫甘薯茎叶中制备分离得到的绿原酸、异绿原酸C、异绿原酸A、异绿原酸B抑制α-葡萄糖苷酶的IC50值分别为7.556、1.419、0.209、9.339 μg/mL,均远远低于阳性对照阿卡波糖的IC50(355.4 μg/mL),进一步的酶抑制反应动力学分析结果表明它们对α-葡萄糖苷酶表现为竞争性抑制类型[43]。 5.2 调节肠促胰岛素浓度
葡萄糖依赖性促胰岛素分泌多肽(GIP)和胰高血糖素样肽-1(GLP-1)是至今发现的2种最重要的肠促胰岛素。Johnston等[44]分别给予健康受试者含25 g葡萄糖的含咖啡因或去咖啡因咖啡(富含CGA 2.5 mmol/L)和水各400 mL,结果发现,去咖啡因和含咖啡因组受试者GIP水平均比糖水组低,且去咖啡因组效果更好,而GIP的分泌受肠内葡萄糖吸收率影响,这说明咖啡能减少肠内葡萄糖吸收而调节胃肠激素分泌,其主要活性物质是CGA不是咖啡因。咖啡中的CGA可诱导GLP-1产生增加来抑制糖吸收,从而减轻高血糖对胰岛β细胞的毒性,保护胰岛β细胞功能[45]。CGA(40 mmol/L)体外孵育STC-1细胞3 h和72 h可以分别显著促进细胞GLP-1的量上升386%和583%[46]。但Tunnicliffe等[47]对SD大鼠ig有或无CGA(120 mg/kg)的标准餐后发现,CGA组大鼠血糖曲线总面积(AUC)显著减弱(P<0.05),GIP分泌减少,餐后180 min GIP峰值浓度和AUC较低(P<0.05),而GLP-1水平无变化。因此,CGA对GLP-1的调节作用还需进一步实验观察。 5.3 抑制糖基化终末产物形成
持续高血糖引起多种蛋白质非酶糖基化及形成的晚期糖基化终末产物(advanced glycation end products,AGEs)在糖尿病慢性并发症中起重要作用[48]。研究表明CGA在体外对牛血清蛋白糖基化的抑制作用(IC50=148.32 μmol/L)强于氨基胍(IC50=807.67 μmol/L)。并且,CGA比氨基胍对胶原蛋白与AGEs交联的抑制性更强。CGA可能是通过与活性羰基化合物如丙酮醛相互作用而对AGEs形成及其交联胶原蛋白产生抑制作用[49]。 5.4 抑制糖皮质激素的再活化
肥胖、糖尿病及代谢综合征患者常有全身或局部糖皮质激素作用增强。咖啡提取物(富含CGA)能够抑制11β-羟基类固醇脱氢酶-1(11β-HSD1),从而抑制糖皮质激素再活化,减轻胰岛素抵抗,这可能是咖啡中CGA在发挥作用,也是咖啡抗糖尿病的机制之一[50]。 5.5 激活AMP活化蛋白激酶(AMPK)
AMPK能调节机体能量代谢,改善胰岛素抵抗[51]。抗糖尿病药物二甲双胍和噻唑烷二酮类药物均通过激活AMPK而发挥胰岛素增敏作用[52]。在心脏和骨骼肌中,AMPK的激活能增加葡萄糖转运蛋白(GLUT-4)转位到细胞质膜增加葡萄糖转运[53,54]。Ong等[55]对db/db小鼠ip 250 mg/kg CGA 10 min后,小鼠空腹血糖浓度显著下降,葡萄糖刺激后这种效果持续30 min。CGA磷酸化AMPK和乙酰辅酶A羧化酶(ACC),以剂量和时间依赖方式增加L6肌细胞中葡萄糖转运,这是首次证明CGA在骨骼肌中通过激活AMPK而刺激葡萄糖转运。进一步研究证实[56],长期服用CGA可以抑制db/db小鼠肝葡萄糖-6-磷酸酶(G-6-Pase)的表达和活性,减弱肝细胞病变,改善血脂水平和骨骼肌葡萄糖摄取,而抑制和敲除AMPK后这些有益的代谢作用消失。 5.6 抑制G-6-Pase的表达
G-6-Pase体系在体内平衡血糖调控中发挥重要作用,其承担着由糖原异生和糖原分解产生内源性葡萄糖的形成[57]。体外研究表明[58],CGA及其衍生物对大鼠离体肝微粒体内G-6-Pase活性有特异性抑制作用,剂量依赖性调节糖原分解和合成平衡,可能会对非胰岛素依赖性糖尿病患者肝脏葡萄糖输出率过高起到有益的调节作用。Arion等[59]证实CGA是T1转运亚基(葡萄糖-6-磷酸转位酶,P46)的特异竞争性抑制剂。在大鼠肝细胞微粒体部分CGA(1.0 mmol/L)对G-6-Pase活性抑制率约为40%(P<0.05)[60]。Vitrac等[61]研究了CGA及其异构体在体外对肝脏G-6-Pase的抑制作用,结果表明,5-咖啡酰奎尼酸、4-咖啡酰奎尼酸、3,4-二咖啡酰奎尼酸、4,5-二咖啡酰奎尼酸对G-6-Pase均有抑制作用,160 μmol/L 5-咖啡酰奎尼酸抑制率为(9.2±1.4)%,120 μmol/L 4-咖啡酰奎尼酸抑制率为(14.4±1.2)%。但也有学者提出异议,de Sotillo等[62]给遗传性肥胖和胰岛素抵抗的Zuker(fa/fa)大鼠每天iv CGA(5 mg/kg),3周后大鼠血液中葡萄糖及胰岛素量状况有所改善,肝脏中蛋白及DNA量显著增加,但G-6-Pase活性并无改变,推测可能是CGA被体内胰岛素激活而协同增加胰岛素的生物作用。 5.7 抑制HMG-CoA还原酶及胰脂肪酶活性
HMG-CoA还原酶和胰脂肪酶是目前研究最广泛的降脂减肥靶点。李文娜等[63]对杜仲叶CGA提取物调血脂及减肥作用机制进行探讨,结果发现杜仲叶CGA提取物抑制猪肝HMG-CoA还原酶效价强于辛伐他汀,且以剂量依赖性抑制离体胆固醇微胶粒形成(IC50=64.8 μg/mL),由此可以推测CGA调血脂机制可能与抑制脂质的吸收转化、抑制肠道胆固醇的吸收和减少肝脏胆固醇的合成有关。此外,研究还发现杜仲叶CGA提取物(CGA量42.4%)可显著升高大鼠粪便中总脂质、胆固醇和胆汁酸的量,且强于奥利司他(P<0.05),杜仲叶CGA提取物通过抑制胰脂肪酶活性抑制脂肪吸收,促进胆固醇和胆汁酸的排出,这可能是其减肥的作用机制[64]。 5.8 下调固醇调节元件结合蛋白1c(SREBP-1c)及相关因子
固醇调节元件结合蛋白(SREBPs)是脂肪合成基因重要的转录调节因子,SREBP-1c又称脂肪细胞定向和分化因子(ADD1),主要调节与脂肪酸代谢相关的酶,在脂肪细胞的分化中发挥重要作用。Murase等[65]对C57BL/6J小鼠喂以添加0.5%~1.0%咖啡多酚的高脂饮食,小鼠体质量及腹部和肝脏脂肪堆积显著减少,SREBP-1c及相关因子水平下调。同时发现以5 μmol/L CGA孵育Hepal-6细胞,可以下调脂肪酸合成酶、乙酰辅酶A羧化酶、丙酮酸脱氢酶激酶4和SREBP-1c等mRNA表达,降低丙二酰辅酶A水平,提示CGA可以通过下调SREBP-1c及相关因子水平,从而调节脂肪代谢,抑制体内脂肪堆积。 5.9 调节内脏脂肪组织中脂肪因子分泌
内脏脂肪组织作为内分泌器官,分泌脂肪因子如脂联素、内脂素、抵抗素等,这些脂肪因子与肥胖糖尿病的胰岛素抵抗有着密切联系[66]。对自发性肥胖糖尿病db/db小鼠每天ig CGA 80 mg/kg,12周后发现CGA显著增加db/db小鼠内脏脂肪中脂联素量,降低内脂素量,上调肝脏PPAR-α mRNA和蛋白表达水平,增加肌糖原,降低肝脏和骨骼肌TG水平。研究中没有观察到体脂量的变化,提示CGA可能通过更新内脏脂肪组织,改善脂肪因子分泌。此外,在连续12周的干预过程中,未发现CGA对db/db小鼠的糖脂代谢有任何不良影响,提示CGA对正常小鼠的糖脂代谢无不良反应[67]。 5.10 增强PPARs表达
PPARs(PPAR-α、β、γ)是在调节糖脂代谢中起关键作用的核受体超家族的成员,PPAR-α是配体激活转录因子受体之一,能够增强线粒体脂肪酸β氧化,降低脂质合成,改善胰岛素抵抗[68]。对高脂饮食的雄性黄金仓鼠ip CGA(80 mg/kg),8周后,CGA显著升高仓鼠肝脏PPAR-α mRNA和蛋白的表达水平,CGA组仓鼠的空腹血清的三酰甘油、游离脂肪酸、总胆固醇、血糖、胰岛素水平显着低于对照组,而肝脏中脂肪酶活性增强,骨骼肌中脂蛋白脂酶活性减弱[69]。SD大鼠每天ig含CGA(1或10 mg/kg)的高胆固醇饮食28 d后,肝脏脂质沉积显著减弱,高胆固醇血症引起的血浆总胆固醇和低密度脂蛋白的增加及高密度脂蛋白的下降显著改善,剂量依赖性改善了动脉粥样硬化指数和心脏病危险因子,这可能是由于CGA上调了PPAR-α mRNA表达[70]。 6 目前存在的问题及未来研究的方向
目前CGA的抗菌、消炎特性在医药行业的应用开发较多,CGA不仅是众多抗菌解毒、消炎利胆的药材和中成药的主要有效成分,同时是质量控制的重要指标,但是其降糖调脂活性的应用较为不足。CGA的研究还存在以下问题:因个体差异较大,CGA的主要吸收部位尚未确定;CGA在胃内的吸收机制也尚未明确。尽管CGA的代谢研究已取得一定成果,但由于个体内微生物的差异,报道结果也有所差异,研究还不够深入。虽然大量流行病学和动物实验研究表明,CGA能调节糖/脂代谢,改善胰岛素敏感性,具有潜在的防治糖尿病、肥胖和代谢综合症的作用,但CGA调节葡萄糖和脂质代谢的机制尚未得出明确结论,CGA的副作用研究尚未全面展开,因此还存在一定争议,如Buchanan等[71]认为目前关于CGA减肥的临床研究存在一定缺陷,如样本量小、实验时间短、缺少安全性评价等,没有达到FDA发布的开发减肥产品的行业指南要求,不建议将CGA作为安全可靠的减肥产品。
我国拥有富含CGA的杜仲、金银花等中药资源,为开发利用CGA提供了有利条件。在以后的研究中,应着重于以下几方面:(1)大力开发天然植物中的CGA资源;(2)CGA的纯度与应用有密切关系,加强对其提取、分离纯化技术的研究;(3)确定CGA的吸收机制及在不同条件下的代谢途径,提高CGA生物活性的利用;(4)亟待加强CGA应用方面的研究,通过大样本量的人群干预试验,进一步研究和明确CGA调节糖脂代谢的作用机制、有益作用的量效关系、评价其副作用及安全性等,充分发挥CGA的有益作用,为预防和治疗肥胖、2型糖尿病等代谢性疾病提供科学依据。
| [1] | 钟 勇, 江时森. 调脂药物对糖尿病状态下糖代谢的影响及其机制的研究进展[J]. 中华老年心脑血管病杂志, 2013, 15(9): 990-992. |
| [2] | 谢新荣. 2型糖尿病患者体重指数与胰岛素抵抗、血脂的关系[J]. 广西医学, 2007, 29(1): 104-105. |
| [3] | Thearle M, Aronne L J. Obesity and pharmacologic therapy[J]. Endocrinol Metab Clin North Am, 2003, 32(4): 1005. |
| [4] | 陈秋平. 油茶蒲减肥降脂功能因子研究[D]. 杭州: 浙江大学, 2011. |
| [5] | 高锦明, 张鞍灵, 张康健, 等. 绿原酸分布、提取与生物活性研究[J]. 西北林学院学报, 1999, 14(2): 73. |
| [6] | 李淑媛, 常翠青. 氯原酸的生物活性与人体健康[J]. 卫生研究, 2005, 34(6): 762-764. |
| [7] | Clifford M N. Chlorogenic acids and other cinnamates-nature, occurrence, dietary burden, absorption and metabolism[J]. J Sci Food Agric, 2000, 80(7): 1033-1043. |
| [8] | Yanagimoto K, Ochi H, Lee K G, et al. Antioxidative activity of fractions obtained from brewed coffee[J]. J Agric Food Chem, 2004, 52(3): 592-596. |
| [9] | Iwai K, Kishimoto N, Kakino, Y, et al. In Vitro antioxidative effects and tyrosinase inhibitory activities of seven hydroxycinnamoyl derivatives in green coffee beans[J]. J Agric Food Chem, 2004, 52(15): 4893-4898. |
| [10] | Farah, A, Paulis de T, Trugo L C, et al. Effect of roasting on the formation of chlorogenic acid lactones in coffee[J]. J Agric Food Chem, 2005, 53(5): 1505-1513. |
| [11] | Jiang Y, Kusama K, Satoh K, et al. Induction of cytotoxicity by chlorogenic acid in human oral tumor cell lines[J]. Phytomedicine, 2000, 7(6): 483-491. |
| [12] | Kurata R, Yahara S, Yamakawa O, et al. Simple high-yield purification of 3, 4, 5-tri-O-caffeoyl quinic acid from sweet potato (Ipomoea batatas L.) leaf and its inhibitory effects on aldose reductase[J]. Food Sci Technol Res, 2011, 17(2): 87-92. |
| [13] | 张风云, 毛富春. 毛细管区带电泳法筛选提取杜仲叶中氯原酸的方法[J]. 西北药学杂志, 1996, 11(2): 66. |
| [14] | 马金花, 黎晓敏, 武 煊. 重庆市不同产地杜仲叶中绿原酸量的研究[J]. 中草药, 2009, 40(S1): 268-270. |
| [15] | 何希瑞, 李永生, 杨 芳, 等. 不同采收时间及干燥方法对杜仲叶中绿原酸含量的影响[J]. 西北药学杂志, 2013, 28(2): 130-132. |
| [16] | 邢志霞, 韩永成, 刘 伟. UHUPLC和HPLC法对比测定不同产地金银花药材中绿原酸的含量[J]. 辽宁中医杂志, 2014, 41(5): 992-994. |
| [17] | 李 淼, 王永香, 孟 谨, 等. HPLC法测定金银花中新绿原酸等8种成分的量[J]. 中草药, 2014, 45(7): 1006-1010. |
| [18] | 吴世福, 张永清. 影响金银花植株体内绿原酸含量的因素[J]. 山东医药工业, 2003, 22(2): 32-34. |
| [19] | 石俊英, 张会敏. 金银花不同品种、产地与采收期样品中绿原酸和木犀草苷的含量测定[J]. 山东中医药大学学报, 2007, 31(3): 247-249. |
| [20] | Farah A, Monteiro M, Donangelo C M, et al. Chlorogenic acids from green coffee extract are highly bioavailable in humans[J]. J Nutr, 2008, 138(12): 2309-2315. |
| [21] | Vaast P, Cilas C, Perriot J J, et al. Mapping of coffee quality in Nicaragua according to regions, ecological conditions and farm management[A] // ASIC 20th International Conference on Coffee Science[C]. Bangalore: ASIC, 2005. |
| [22] | 石嘉怿, 张 英. 高效液相色谱法测定青梅花、枝、叶中绿原酸类化合物[J]. 食品科学, 2011, 32(2): 191-194. |
| [23] | 陈大淦. 植物蛋白的加工与利用[M]. 北京: 中国食品出版社, 1988. |
| [24] | Stalmach A, Steiling H, Williamson G, et al. Bioavailability of chlorogenic acids following acute ingestion of coffee by humans with an ileostomy[J]. Archiv Biochem Biophys, 2010, 501(1): 98-105. |
| [25] | Konishi Y, Kobayashi S. Transepithlial transport of chlorogenic acid, caffeic acid, and their colonic metabolites in intestinal Caco-2 cell monolayers[J]. J Agric Food Chem, 2004, 52(9): 2518-2526. |
| [26] | 张立伟. 荧光法研究咖啡酸类药物与白蛋白的作用[J]. 科学通报, 1994, 39(1): 31-35. |
| [27] | Kann J, Liu Y, Xie M X, et al. Interations of human serum albumin with chlorogenic acid and ferulic acid[J]. Biochim Biophysic Acta, 2004, 1674(2): 205-214. |
| [28] | Azuma K, Ippoushi K, Nakayama K, et al. Absorption of chlorogenic acid and caffeic acid in rats after oral administration[J]. J Agric Food Chem, 2000, 48(11): 5496-5500. |
| [29] | Gonthier M P, Verny M A, Besson C, et al. Chlorogenic acid bioavailability largely depends on its metabolism by the gut microflora in rats[J]. J Nutr, 2003, 133(6): 1853-1859. |
| [30] | Huxley R, Lee C M Y, Barzi F, et al. Coffee, decaffeinated coffee, and tea consumption in relation to incident type 2 diabetes mellitus a systematic review with meta-analysis[J]. Arch Intern Med, 2009, 169(22): 2053-2063. |
| [31] | Thom E. The effect of chlorogenic acid enriched coffee on glucose absorption in healthy volunteers and its effect on body mass when used long-term in overweight and obese people[J]. J Int Med Res, 2007, 35(6): 900-908. |
| [32] | Bassoli B K, Cassolla P, Borba-Muradetal G R, et al. Chlorogenic acid reduces the plasma glucose peak in the oral glucose tolerance test: effects on hepatic glucose release and glycaemia[J]. Cell Biochem Funct, 2008, 26(3): 320-328. |
| [33] | McCarty M F. A Chlorogenic acid-induced increase in GLP-1 production may mediate the impact of heavy coffee consumption on diabetes risk[J]. Med Hypotheses, 2005, 64(4): 848-853. |
| [34] | 梁秀慈, 孟 文, 钟英丽. 绿原酸对高脂乳诱导小鼠胰岛素抵抗形成的影响[J]. 中国药理学通报, 2013, 29(5): 654-658. |
| [35] | Tousch D, Lajoix A D, Hosy E, et al. Chicoric acid, a new compound able to enhance insulin release and glucose uptake[J]. Biochem Biophys Res Commun, 2008, 377(1): 131-135. |
| [36] | Johnston K L, Clifford M N, Morgan L M. Coffee acutely modifies gastrointestinal hormone secretion and glucose tolerance in humans: glycemic effects of chlorogenic acid and caffeine[J]. Am J Clin Nutr, 2003, 78(4): 728-733. |
| [37] | Rodriguez de Sotillo D V, Hadley M. Chlorogenic acid modifies plasma and liver concentrations of: cholesterol, triacylglycerol, and minerals in (fa/fa) Zucker rats[J]. J Nutr Biochem, 2002, 13(12): 717-726. |
| [38] | Cho A S, Jeon S M, Kim M J, et al. Chlorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat diet-induced obese mice[J]. Food Chem Toxicol, 2010, 48(3): 937-943. |
| [39] | Dellalibera O, Lemaire B, Lafay S. Svetol®, green coffee extract, induces weight loss and increases the lean to fat mass ratio in volunteers with overweight problem[J]. Phytotherapie, 2006, 4: 194-197. |
| [40] | Vinson J A, Burnham B R, Nagendran M V. Randomized, double-blind, placebo-controlled, linear dose, crossover study to evaluate the efficacy and safety of a green coffee bean extract in overweight subjects[J]. Diabetes Metab Syndrome Obes, 2012, 5: 21-27. |
| [41] | Bonora E, Muggeo M. Postprandial blood glucose as a risk factor for cardiovascular disease in type 2 diabetes: the epidemiological evidence[J]. Diabetologia, 2001, 44(12): 2107-2114. |
| [42] | 郑毅男, 刘可越, 贾桂燕, 等. 咖啡热水提取物对大鼠餐后血糖的影响[J]. 中国药学杂志, 2007, 42(1): 32-35. |
| [43] | 刘雪辉, 李觅路, 谭 斌. 紫甘薯茎叶中绿原酸及异绿原酸对α-葡萄糖苷酶的抑制作用[J]. 现代食品科技, 2014, 30(3): 103-107. |
| [44] | Johnston K L, Clifford M N, Morgan L M. Coffee acutely modifies gastrointestinal hormone secretion and glucose tolerance in humans: glycemic effects of chlorogenic acid and caffeine[J]. Am J Clin Nutr, 2003, 78(4): 728-733. |
| [45] | McCarty M F.A Chlorogenic acid-induced increase in GLP-1 production may mediate the impact of heavy coffee consumption on diabetes risk[J]. Med Hypotheses, 2005, 64(4): 848-853. |
| [46] | Rafferty E P, Wylie A R, Elliott C T, et al. In vitro and in vivo effects of natural putative secretagogues of glucagon like peptide-1 (GLP-1)[J]. Sci Pharm, 2011, 79(3): 615-621. |
| [47] | Tunnicliffe J M, Eller L K, Reimer R A, et al. Chlorogenic acid differentially affects postprandial glucose and glucose-dependent insulinotropic polypeptide response in rats, applied physiology[J]. Appl Physiol Nutr Metab, 2011, 36(5): 650-659. |
| [48] | Vlassara H, Bucala R, Striker L, et al. Pathogenic effects of advanced glycosylation: Biochemical, biologic and clinical implications for diabetes and aging[J]. Lab Invest, 1994, 70(2): 138-151. |
| [49] | Kim J, Jeong I H, Kim C S, et al. Chlorogenic acid inhibits the formation of advanced glycation end products and associated protein cross-linking[J]. Archiv Pharm Res, 2011, 34(3): 495-500. |
| [50] | Atanasov A G, Dzyakanchuk A A, Schweizer R A S, et al. Coffee inhibits the reactivation of glucocorticoids by 11 β-hydroxysteroid dehydrogenase type 1: A glucocorticoid connection in the anti-diabetic action of coffee?[J]. FEBS Lett, 2006, 580(17): 4081-4085. |
| [51] | 袁 虎, 吴国亭. AMP活化蛋白激酶研究进展[J]. 国际内分泌代谢杂志, 2010, 30(B4): 25-28. |
| [52] | Saha A K, Avilucea P R, Ye J M, et al. Pioglitazone treatment activates AMP-activated protein kinase in rat liver and adipose tissue in vivo[J]. Biochem Biophys Res Commun, 2004, 314(2): 580-585. |
| [53] | Russell R R, Bergeron R, Shulman G I, et al. Translocation of myocardial GLUT-4 and increased glucose uptake through activation of AMPK by AICAR[J]. Am Physiol Soc, 1999, 277(2): 643-649. |
| [54] | Kurth-Kraczek E J, Hirshman M F, Goodyear L J, et al. 5′ AMP-activated protein kinase activation causes GLUT4 translocation in skeletal muscle[J]. Diabetes, 1999, 48(8): 1667-1671. |
| [55] | Ong KW, Hsu A, Tan B H K. Chlorogenic acid stimulates glucose transport in skeletal muscle via AMPK activation: a contributor to the beneficial effects of coffee on diabetes[J]. PLoS One, 2012, 7(3): e32718. |
| [56] | Ong K W, Hsu A, Tan B H K. Anti-diabetic and anti-lipidemic effects of chlorogenic acid are mediated by ampk activation[J]. Biochem Pharmacol, 2013, 85(9): 1341-1351. |
| [57] | 张鞍灵, 马 琼, 高锦明, 等. 绿原酸及其类似物与生物活性[J]. 中草药, 2001, 32(2): 173-176. |
| [58] | Hemmerle H, Burger H J, Below P, et al. Chlorogenic acid and synthetic chlorogenic acid derivatives: Novel inhibitors of hepatic glucose-6-phosphate translocase[J]. J Med Chem, 1997, 40(2): 137-145. |
| [59] | Arion W J, Cafield W K, Ramos F C, et al. Chlorogenic acid and hydroxynitrobenzaldehyde: New inhibitors of hepatic glucose 6-phosphatase[J]. Archiv Chem Biophys, 1997, 339(2): 315-322. |
| [60] | Bassoli B K, Cassolla P, Borba-Murad G R, et al. Chlorogenic acid reduces the plasma glucose peak in the oral glucose tolerance test: effects on hepatic glucose release and glycaemia[J]. Cell Biochem Funct, 2008, 26(3): 320-328. |
| [61] | Vitrac C H, Ibarra A, Roller M, et al. Contribution of chlorogenic acids to the inhibition of human hepatic glucose-6-phosphatase activity in vitro by svetol, a standardized decaffeinated green coffee extract[J]. J Agric Food Chem, 2010, 58(7): 4141-4144. |
| [62] | de Sotillo D V R, Adley M, Sotillo J E. Insulin receptor exon 11+/- is expressed in Zucker (fa/fa) rats, and chlorogenic acid modifies their plasma insulin and liver protein and DNA[J]. J Nutr Biochem, 2006, 17(1): 63-71. |
| [63] | 李文娜, 韩宇东, 刘银花. 杜仲叶绿原酸提取物对脂代谢关键酶活性的影响[J]. 中药新药与临床药理, 2012, 23(1): 30-33. |
| [64] | 李文娜, 肖 苑, 黄燮南, 等. 杜仲叶绿原酸提取物对大鼠的减肥作用机制[J]. 中国临床药理学杂志, 2012, 28(7): 534-535. |
| [65] | Murase T, Misawa K, Minegishi Y, et al. Coffee polyphenols suppress diet-induced body fat accumulation by down regulating SREBP-1c and related molecules in C57BL/6J mice[J]. Am Physiol Soc, 2011, 300(1): 122-133. |
| [66] | Puente B, Feve B, Fellahi S, et al. Adipokines: the missing link between insulin resistance and obesity[J]. Diabetes Metab, 2008, 34(1): 2-11. |
| [67] | 张兰涛, 常翠青, 刘 阳, 等. 氯原酸对db/db小鼠糖脂代谢紊乱的影响及其作用机制[J]. 中国医学科学院学报, 2011, 33(3): 281-286. |
| [68] | Chen X, Matthews J, Zhou L, et al. Improvement of dyslipidemia, insulin sensitivity, and energy balance by a peroxisome proliferator-activated receptor α agonist[J]. Metabolism, 2008, 57(11): 1516-1525. |
| [69] | Li S Y, Chang C Q, Ma F Y, et al. Modulating effects of chlorogenic acid on lipids and glucose metabolism and expression of hepatic peroxisome proliferator activated receptor-α in golden hamsters fed on high fat diet[J]. Biomed Environ Sci, 2009, 22(2): 122-129. |
| [70] | Wan C W, Wong C N Y, Pin W K, et al. Chlorogenic acid exhibits cholesterol lowering and fatty liver attenuating properties by up-regulating the gene expression of PPAR-α in hypercholesterolemic rats induced with a high-cholesterol diet[J]. Phytother Res, 2013, 27(4): 545-551. |
| [71] | Buchanan R, Beckett R D. Green coffee for pharmacological weight loss[J]. J Evid Based Complement Alternat Med, 2013, 18(4): 309-313. |
 2015, Vol. 46
2015, Vol. 46


