2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西大学体育学院, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Department of Physical Education, Shanxi University, Taiyuan 030006, China
驴皮为马科动物驴Equus asinus L. 的干燥皮或鲜皮,从宋代开始就一直是制备传统中药阿胶的原料。阿胶最初记载于《神农本草》,其中写道:“主心腹,内崩,劳极,洒洒如疟状,腰腹痛,四肢酸疼,女子下血安胎,久服轻身益气,一名傅致胶”[1],历来被誉为“补血圣药”“滋补国宝”,与人参、鹿茸一起被誉为“中药三宝”。《中国药典》2010年版[2]中记载,阿胶为马科动物驴的干燥皮或鲜皮经煎煮、浓缩制成的固体胶。在唐代以前制作阿胶的原料以牛皮为主,兼用猪、驴、马等皮,至宋代由以牛皮为主转为驴皮为主。明代李时珍在《本草纲目》[3]中对阿胶原料写道:“大抵古方所用多是牛皮,后世乃贵驴皮……,当以黄透如琥珀色,或光黑如漆者为真”。
近年来,随着人们养生保健意识的增强,阿胶所具有的滋阴、补血、养颜等多重功效越来越受到社会各界人士的关注与欢迎,阿胶的市场需求快速增长。驴皮作为制作阿胶的主要原料,货源紧缺,市场上劣质皮甚至伪品(如马皮、骡皮)等纷纷出现,导致阿胶及其复方制剂产品质量差异较大。针对这一现状,广大学者使用液相色谱法、紫外分光光度法、近红外光谱法等对阿胶的各种化学成分包括蛋白质成分[4, 5, 6]、脂溶性成分[7, 8]及水溶性成分(氨基酸)[9, 10, 11, 12, 13]、微量元素[14, 15, 16, 17]等进行了研究,对阿胶原料驴皮及其伪品进行了鉴别研究[18, 19, 20],并对阿胶及其复方制剂的质量均一性进行了研究[21, 22, 23]。而这些研究方法目前尚有一定的局限性,由于驴皮及其伪品的主要成分相似,难以找到专属性成分,需要能够进行全面整体研究的新方法。
代谢组学[24]是近年来出现的继基因组学、蛋白组学之后的一种新型组学技术,以组群指标分析为基础,以高通量检测和数据处理为手段,具有整体观的研究思路,特别适合于传统食品、中草药等复杂体系分析。其主要对某一生物或是细胞内所有低相对分子质量(1 000以内)代谢产物进行动态检测以及定性定量研究,在药物毒理学研究、疾病诊断、植物和中药等领域应用广泛,其中核磁共振(NMR)代谢组学技术是应用较多的一种。
NMR技术[25]是一种利用物理原理来分析物质分子结构与性质的无损检测方法,它在化学、生命科学中具有广泛的应用。本研究拟采用基于1H-NMR的代谢组学方法对驴皮及其伪品(马皮、骡皮)进行分析,通过多元统计分析方法鉴定驴皮及其伪品的差异水溶性成分,为阿胶的质量控制研究提供参考。
1 材料与仪器 1.1 材料驴皮样品采集自不同产地(黑龙江、吉林、辽宁、内蒙古、河北);马皮样品共3份,采集自河北、内蒙古,骡皮样本采集自内蒙古,所有样本均为整张皮,样品信息见表 1。全部样本经山西大学中医药现代研究中心秦雪梅教授鉴定为马科动物驴Equus asinus L.、马科动物马E. caballus L. 和马和驴的杂交种骡Equus ferus × asinus的干燥皮。凭证样本保存于山西大学中医药现代研究中心。
| 表 1 样本采集信息表 Table 1 Sources information of samples |
核磁仪器为Bruker 600-MHz AVANCE III核磁共振检测仪(600.13 MHz proton frequency),旋转蒸发器RE-52A(上海亚荣生化仪器厂),真空泵SHZ-III(上海知信实验仪器技术有限公司),中草药粉碎机(天津市赛斯特仪器有限公司),高速离心机LG10-2.4A(北京时代北利离心机有限公司),高速台式冷冻离心机TGL-16(湘仪离心机),KQ5200E型超声波清洗器(昆山市超声仪器有限公司),101-3AB型电热鼓风干燥箱(天津泰斯特仪器有限公司)。二氯甲烷为分析纯(北京化工厂,批号20120329),重水(美国默克试剂公司,批号C20111017)。
2 方法 2.1 样品溶液的制备结合前期实验结果[20],取6-1、8、10号样本为研究对象。每个样本分别从不同的部位(头部、四肢、背部等)取样,平行制备6份,制备方法如下:称取驴皮及其伪品(马皮、骡皮)样品粉末500 mg,分别置于150 mL锥形瓶中,加入25 mL蒸馏水,浸泡40 min,超声提取30 min;转入50 mL离心管中,4 000 r/min离心5 min,取上清液于125 mL分液漏斗中,加入二氯甲烷25 mL,振摇萃取10 min,取水层置于25 mL圆底烧瓶中,减压蒸干,加入700 μL重水(含0.005% 3-三甲基硅基丙酸钠),超声助溶,转移至1.5 mL离心管中,13 000 r/min离心20 min,取上清液600 μL,置于5 mm核磁管中,待测。
2.2 NMR测定条件数据采集在Bruker 600-MHz AVANCE III NMR谱仪上进行,采用nuclear overhauser effect spectroscopy(NOESY)脉冲序列,参数设置为自旋弛豫延迟为320 ms、自由感应衰减为64 K数据点、谱宽为8 000 Hz、扫描64次。
2.3 1H-NMR图谱处理采用MestReNova(Mestrelab Research,Santiago de Compostella)核磁图谱专业处理软件对全部谱图进行内标校准、相位校准及基线校准等规格化处理。然后以δ 0.01积分段为单位,对δ 0.70~8.47区域的谱图进行等宽度分割,去除δ 4.70~5.09区域水峰;对图谱进行积分,对所产生的积分数据进行归一化处理,进行多元统计分析。
2.4 统计学分析采用SIMCA-P 13.0软件对上述NMR采集处理的归一化积分数据进行中心化和规格化后,进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least-squares discriminant analysis,OPLS-DA)。然后采用独立样本t检验对具有差异的水溶性成分进行统计分析,找出差异性成分。
3 结果与分析 3.1 NMR图谱的指认与分析结合每个水溶性成分的化学位移,裂峰情况及偶合常数,参照Chenomx NMR Suite(Chenomx Inc.,Edmonton,AB,Canada)数据库,并结合文献对本实验所得的图谱进行指认,从图谱中共指认了42种化合物(图 1),主要包括氨基酸、有机酸等,化学位移指认结果见表 2。
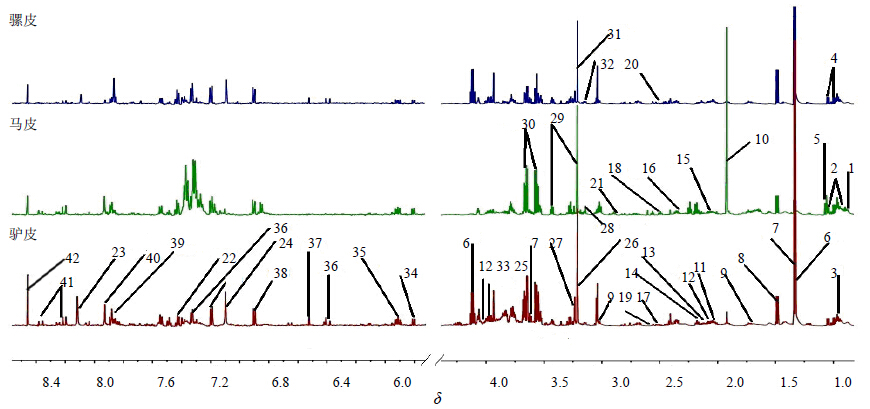 | 图 1 1H-NMR图谱主要水溶性成分归属指认Fig.1 1H-NMR spectra of attribution for main water soluble constituents |
| 表 2 主要水溶性成分峰归属 Table 2 Peak attribution in 1H-NMR spectra for water-soluble constituents |
由1H-NMR图谱直接观察可以发现,驴皮、马皮、骡皮图谱的峰高、峰面积及峰的种类差别较为明显,因此推断它们的水溶性成分在其相对量和种类上都具有一定的差异。
3.2 NMR代谢组学数据分析采用PCA分析法及聚类分析法对驴皮(6-1-1~6)、马皮(8-1~6)、骡皮(10-1~6)的1H-NMR图谱进行分析,结果见图 2、3。从图 2中可以看出,驴皮与马皮、驴皮与骡皮有较好的分开趋势。而它们的聚类分析图(图 3)也可以进一步证明驴皮与马皮、驴皮与骡皮之间的差异性。为了发现驴皮与马皮之间的差异性水溶性成分,进一步对驴皮、马皮数据进行OPLS-DA分析,
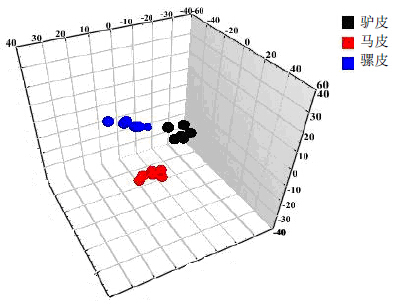 | 图 2 1H-NMR谱PCA分析3D散点图Fig.2 PCA 3D score plot in 1H-NMR spectra |
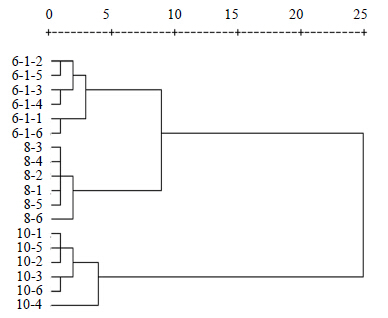 | 图 3 1H-NMR谱聚类分析图Fig.3 Cluster analysis in 1H-NMR spectra |
散点图和载荷图见图 4所示。由图 4可知,驴皮与马皮能够明显分开,差异显著。依据离原点越远的点对分组贡献越大的原则,同时结合Excel软件对位于在OPLS-DA的载荷图中边缘成分的峰面积进行独立样本t检验,得到峰面积具有显著差异性的水溶性成分,如图 5所示。由图 5可知,马皮中含较多醋酸、亮氨酸、缬氨酸、异亮氨酸,含较少乳酸、丝氨酸、焦谷氨酸、肌酸,与驴皮比较具有显著性差异(P<0.05,0.01)。为了发现驴皮与骡皮之间的差异水溶性成分,也对驴皮、骡皮数据进行
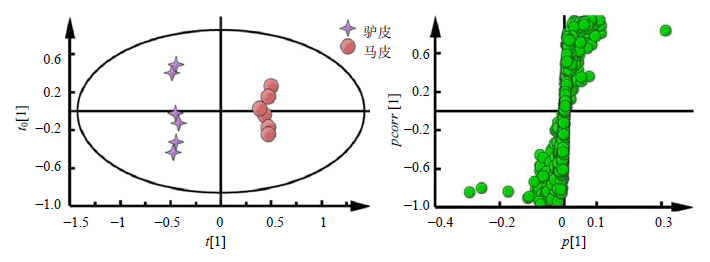 | 图 4 驴皮与马皮1H-NMR谱OPLS-DA 散点图及载荷图分析Fig.4 OPLS-DA score plot and its S-plot in 1H-NMR spectra of donkey-hide and horse-hide |
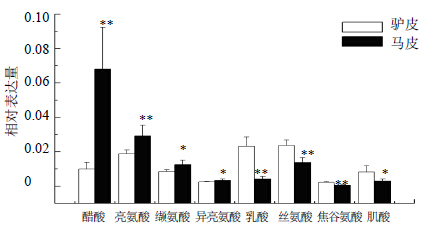 |
与驴皮比较:*P<0.05 **P<0.01,下同
*P < 0.05 **P < 0.01 vs donkey hide,same as below 图 5 驴皮与马皮1H-NMR谱OPLS-DA分析载荷图中具有Fig.5 Water-soluble components with significant difference of OPLS-DA S-plots in 1H-NMR spectra of donkey-hide and horse-hide |
了OPLS-DA分析,做了它们的散点图和载荷图,如图 6所示。由图可知,驴皮与骡皮能够明显分开,差异显著。依据离原点越远的点对分组贡献越大的原则,同时对位于在OPLS-DA的载荷图中边缘成分的峰面积进行独立本t检验,得到峰面积具有显著差异性的水溶性成分,如图 7所示。由图 7可知,骡皮中含较多乳酸、肌酸、丙氨酸、胆碱,含较少甘油、醋酸,与驴皮比较具有显著性差异(P<0.05,0.01)。
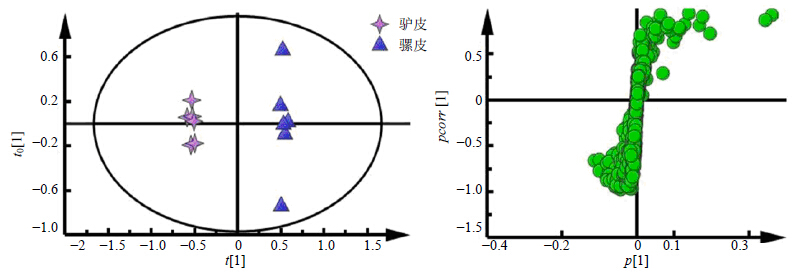 | 图 6 驴皮与骡皮1H-NMR谱OPLS-DA 散点图及载荷图分析Fig.6 OPLS-DA score plot and its S-plot in 1H-NMR spectra of donkey-hide and mule-hide |
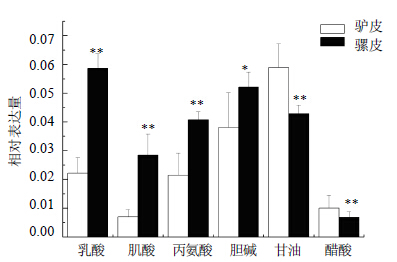 | 图 7 驴皮与骡皮1H-NMR谱OPLS-DA分析载荷图中具有显著性差异的水溶性成分Fig.7 Water-soluble constituents of OPLS-DA S-plots in 1H-NMR spectra of donkey-hide and mule-hide |
在对实验样品的前期处理过程中发现,不同动物的皮的干燥程度、厚薄程度、毛的浓疏程度会有所不同,对实验结果可能产生一定程度的影响;同时,同一张皮中,不同部位厚薄程度、毛的浓疏程度会有所差异,在样品的去毛过程及粉碎过程中难易程度不同,可能对所得样品有一定影响,因此本实验中样本制备之前先尽可能除去毛。在提取溶剂选择上,对水相和有机相的提取物进行了预试验,发现水提取物核磁图谱中化合物种类较多、相对量较大,因此选择水为溶剂,这也与传统的阿胶制备工艺具有一致性。另外,本实验对驴皮与其伪品以及不同产地驴皮分别进行了PCA分析,结果发现种间差异明显大于种内差异。由于所收集的马皮与骡皮样本有限,在后续研究中将加强伪品样本收集的力度,并对不同产地的样本进行分析。
核磁图谱分析结果中发现驴皮、马皮中出现了醋酸峰,且马皮中该峰的强度很大,对出现该现象可能的原因进行了探讨。有文献报道用Na2SO3[26]与醋酸的溶液处理生皮,通过所释放的SO2来达到抑菌的目的,因此猜测该现象可能的原因是马皮前期加醋酸对其进行了防腐抑菌;为了进一步提高结果的可靠性,在对核磁图谱积分处理时,切除了醋酸峰,将所得数据进行PCA分析,发现驴皮、马皮、骡皮仍具有较好的分开趋势。
图谱分析结果发现,有一些峰仅出现在马皮中,如丙酸、2-羟基丁酸、2-氨基乙二酸、β-氨基丙酸及3-苯丙酸;同时,本实验也发现了可能存在于驴皮或马皮中但不存在于骡皮中的物质有黄嘌呤和腺嘌呤,但是,由于它们峰面积较小,因此并未进行差异成分统计分析。对于《中国药典》2010年版中阿胶项下测定指标L-羟脯氨酸、甘氨酸、丙氨酸和L-脯氨酸,可明显观察到马皮中甘氨酸峰较小。但由于核磁分析灵敏度及干扰峰的限制,还需进一步采用LC-MS或GC-MS等手段对其进行完善分析。
另外,将驴皮的核磁图谱与阿胶(保定赛行阿胶有限公司,生产批号121003)(样品制备方法同“2.1”项)核磁图谱进行对比,发现阿胶中氨基酸类物质相对质量分数明显高,说明在阿胶的制备过程中,驴皮中的氨基酸类成分得到富集;同时发现它们的物质种类存在差异,如驴皮中的乳酸、胆碱等阿胶中并没有,而阿胶中的乙酰丙酸(亦称戊隔酮酸、左旋糖酸、果糖酸,是水解产生)在驴皮中没有,这可能与制备阿胶过程中的工艺及所加辅料有关,有待进一步研究。
综上所述,基于核磁代谢组学的驴皮与其伪品的鉴别研究方法简便有效,为阿胶原料的质量控制研究提供参考。在本实验基础上,进一步使用NMR、LC-MS、GC-MS等技术对不同厂家的阿胶进行质量差异性研究及对不同生产批次的阿胶复方制剂进行质量均一性研究,从而建立相对完整的阿胶质量控制体系。
| [1] | 张少权. 阿胶原料的主要蛋白组成及其生理活性的研究[D]. 福州: 福州大学, 2005. |
| [2] | 中国药典[S]. 一部. 2010. |
| [3] | 吴长虹, 王若光. 阿胶的历史沿革、研究现状及相关思考[J]. 湖南中医药大学学报, 2008, 28(6): 77-79. |
| [4] | 汪 冰, 肖新月, 程显隆, 等. 凝胶排阻色谱法研究阿胶中蛋白质及多肽相对分子质量分布规律[J]. 药物分析杂志, 2009, 29(11): 1886-1891. |
| [5] | 杨 霞, 王珊珊, 赵芙钗, 等. 驴皮中胶原蛋白的提取及其特性[J]. 精细化工, 2011, 28(9): 883-886. |
| [6] | 王若光, 尤昭玲, 刘小丽, 等. 基于激光解析/离子化-飞行时间质谱技术的中药阿胶蛋白质组分析[J]. 中国组织工程研究与临床康复, 2007, 11(13): 2518-2521. |
| [7] | 于海英, 周永妍, 程秀民. 阿胶、龟甲胶中脂溶性成分的高效液相色谱指纹图谱[J]. 色谱, 2009, 27(4): 447-452. |
| [8] | 于海英. 阿胶等胶剂脂溶性成分HPLC指纹图谱研究[D]. 济南: 山东大学, 2009. |
| [9] | Cheng X L, Wei F, Xiao X Y, et al. Identification of five gelatins by ultra performance liquid chromatography/time-of-flight mass spectrometry (UPLC/Q-TOF-MS) using principal component analysis[J]. J Pharm Biom Anal, 2012, 62: 191-195. |
| [10] | 王晓坤, 成秀民, 于海英, 等. 阿胶水溶性成分HPLC指纹图谱研究[J]. 上海中医药杂志, 2008, 42(2): 66-69. |
| [11] | 程显隆, 肖新月, 邹秦文, 等. 柱前衍生化HPLC法同时测定阿胶中4种主要氨基酸的含量[J]. 药物分析杂志, 2008, 28(12): 1997-2000. |
| [12] | 谢 谊, 易 艳, 刘 阳, 等. 柱前衍生HPLC测定阿胶中17种水解氨基酸含量[J]. 湖南中医药大学学报, 2012, 32(5): 46-49. |
| [13] | 鄢 丹, 韩玉梅, 董小萍. 反相高效液相色谱-蒸发光散射检测法同时测定阿胶中的17种未衍生氨基酸[J]. 色谱, 2006, 24(4): 359-362. |
| [14] | 贾艾玲, 王红梅, 李玲玲. 电感耦合等离子体质谱法检测阿胶中6种有害元素的含量[J]. 药物分析杂志, 2012, 32(3): 434-436. |
| [15] | 张红梅, 王文静, 李兴元. X射线荧光光谱法测定螺旋藻和阿胶中微量元素[J]. 光谱实验室, 2008, 25(2): 150-151. |
| [16] | 石 岩, 肖新月, 石上梅, 等. 微波消解-石墨炉原子吸收法测定阿胶中铬含量[J]. 药物分析杂志, 2011, 31(8): 1527-1529. |
| [17] | 樊绘曾, 刘或曦, 谢克勤, 等. 驴皮硫酸皮肤素的鉴定与含量分析[J]. 中国中药杂志, 1994, 19(8): 477-511. |
| [18] | 徐长华, 周 群, 孙素琴, 等. 二维相关红外光谱法与阿胶的真伪鉴别[J]. 分析化学研究简报, 2005, 33(2): 221-224. |
| [19] | 翟乙娟, 任孝德, 都恒青, 等. 阿胶、鹿角胶、龟甲胶圆二色谱鉴别[J]. 中药材, 1998, 21(12): 66-68. |
| [20] | 田俊生, 史碧云, 张福生, 等. 驴皮药材RAPD分析方法建立及其与伪品马皮的鉴别[J]. 中草药, 2013, 44(3): 354-358. |
| [21] | 欧金秀, 谷陟欣, 张妮瑜, 等. 柱前衍生HPLC法同时测定驴胶补血颗粒中6种水解氨基酸[J]. 中国实验方剂学杂志, 2012, 18(16): 93-96. |
| [22] | 谷陟欣, 张妮瑜, 梁逸曾, 等. 驴胶补血颗粒HPLC指纹图谱研究[J]. 中国实验方剂学杂志, 2011, 17(22): 80-82. |
| [23] | 张贵锋, 刘 涛, 王 前, 等. 中药阿胶的质量控制方法研究[J]. 药物生物技术, 2009, 16(3): 250-254. |
| [24] | 李爱平, 李震宇, 邢 婕, 等. 核磁共振代谢组学技术检测食醋化学成分[J]. 食品科学, 2013, 34(12): 247-253. |
| [25] | 张艳花, 王东琴, 李晓伟, 等. 基于1H-NMR代谢组学技术寻找CCl4致大鼠急性肝损伤的代谢标志物[J]. 药物评价研究, 2014, 5(1): 11-16. |
| [26] | 于淑贤. 现代生皮保藏技术文献综述[J]. 中国皮革, 1999, 28(17): 23-25. |
 2015, Vol. 46
2015, Vol. 46


