2. 山西大学 化学化工学院, 山西 太原 030006;
3. 中国医学科学院药物研究所, 北京 100050
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China
逍遥散源自《太平惠民和剂局方》,由柴胡、当归、白芍、白术、茯苓、炙甘草、干姜、薄荷8味药组成,具有疏肝解郁、健脾养血之功效,临床及实验研究均显示该方有确切的抗抑郁作用[1, 2, 3],是治疗抑郁症最常用的经典名方之一。本课题组前期通过大量体内外药理活性实验筛选出了逍遥散的有效部位为低极性部位,发现其在抗抑郁疗效方面明显优于原复方,并采用超临界CO2提取技术获取逍遥散的有效部位[4, 5, 6]。
中药有效部位在新药的开发中具有独特的优势,明确其化学成分及活性物质能够为中药有效部位的质量控制提供科学依据,进而有利于高效中药新药的开发和疗效的提高。然而,由于中药成分的复杂性,市场上可购买的对照品有限,使用对照品指认的方法确定有效部位的活性成分具有一定的局限性。超高效液相色谱-二极管阵列(UPLC-PDA)导向分离技术可全面、快速明确有效部位的活性成分,为中药有效部位现代化药效物质基础研究和质量控制提供了一种有效的技术平台[7]。
中药Angelica Sinensis Radix当归为逍遥散中的一味君药,来源于伞形科(Umbelliferae)植物当归Angelica sinensis (Oliv.) Diels的干燥根,本实验室和黑龙江中医药大学都曾对逍遥散中的色谱峰进行了归属[8, 9],结果显示当归对逍遥散有效部位的贡献成分较多,但是,对于这些贡献峰成分的指认和活性验证未见报道。研究表明,当归还在多个抗抑郁复方中发挥重要作用,如无忧汤[10]、救肝开郁汤[11]等,表明当归在抑郁症的治疗中做出了重要贡献。综上所述,对当归的有效成分进行研究对明确逍遥散药效物质基础尤为重要。本研究首先通过药效学实验确定有效部位,再利用UPLC-PDA导向分离结合化学表征技术鉴定化学成分,最后采用体外活性实验验证活性成分,建立了一种中药复方药效成分定性研究的有效方法。
1 材料与方法超高效液相色谱仪(Acquity UPLC TM PDA,美国Waters公司);Bruker 600-MHz AVANCE IIINMR波谱仪(德国布鲁克公司);气相色谱-质谱联用仪(Trace GC-PolarisQ Mass,Thermo Finniga);Agilent 1100 LC/MSD液质联用仪。
本实验所用的药材饮片均购自山西省华阳药业有限公司,经山西大学中医药现代研究中心主任秦雪梅教授鉴定分别为柴胡 Bupleurum chinense DC. 的干燥根、当归Angelica sinensis (Oliv.) Diels. 的干燥根、白术Atractylodes macrocephala Koidz. 的干燥根茎、白芍Paeonia lactiflora Pall.干燥根、茯苓Poria cocos (Schw.) Wolf的干燥菌核、炙甘草Glycyrrhiza uralensis Fisch. 的干燥根和根茎、生姜Zingiber officinale Rosc. 的新鲜根茎、薄荷Mentha haplocalyx Briq. 的干燥地上部分,均留样于山西大学中医药现代研究中心。色谱级乙腈购自Fisher Scientific(USA),培养基购自Hyclone公司,胎牛血清和马血清购自Clark公司,谷氨酸(Glu)购自Sigma公司。
2 方法 2.1 提取物的制备超临界CO2萃取条件:温度50 ℃;压力20 MPa;CO2流量15 kg/h;物料粒度20目;萃取时间3 h。所有样本均在山西省林业科学研究院制备。
逍遥散有效部位的制备:各药材按逍遥散处方量配比(柴胡-当归-白芍-白术-茯苓-炙甘草-薄荷-生姜6∶6∶6∶6∶6∶3∶2∶2)混合,粉碎,过20目筛,称取300 g置于超临界萃取装置中,采用上述条件进行提取,得率为2.25%,作为逍遥散有效部位UPLC-PDA分析的供试品。
当归超临界CO2萃取部位的制备:取7.3 kg当归饮片粉碎,过20目筛,置于超临界萃取装置中萃取得当归浸膏,得率为1.11%,用于当归的UPLC-PDA指纹图谱分析和贡献成分的分离。
2.2 供试品溶液的制备分别精密称定逍遥散及当归浸膏各30 mg,置10 mL量瓶中,加三氯甲烷定容至刻度,0.22 μm微孔滤膜滤过,取续滤液,即得。
2.3 UPLC色谱条件色谱柱:BEH C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相:乙腈(A)-水(B);梯度洗脱:0~8 min,40%~55% A;8~17 min,55%~75% A;17~18 min,75%~100% A;体积流量0.5 mL/min;柱温40 ℃;进样量2 μL;全波长扫描。
2.4 导向分离当归超临界CO2萃取部位经200~300目硅胶柱色谱,以石油醚-醋酸乙酯(100∶0→0∶100)梯度洗脱,TLC检识合并相同部分,得到28个部分,经UPLC-PDA检测分析,通过对比共有峰的相对保留时间和紫外光谱图,发现当归对逍遥散的贡献成分富集于流分7(97∶3洗脱组分),流分8(19∶1洗脱组分),流分23(7∶3洗脱组分),流分25(1∶1洗脱组分),当归与各流分的UPLC色谱图如图 1所示。
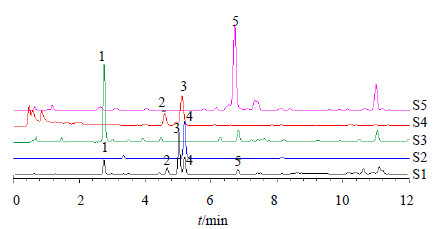 |
S1-当归 S2-流分7 S3-流分25 S4-流分8 S5-流分23 S1-Angelica Sinensis Radix S2-Fraction 7 S3-Fraction 25 S4-Fraction 8 S5-Fraction 23 图 1 逍遥散和各流分在254 nm下的UPLC色谱图Fig.1 UPLC of Angelica Sinensis Radix and fractions at 254 nm |
流分7经Sephadex LH-20色谱柱,三氯甲烷-甲醇(2∶1)洗脱纯化,得到贡献成分4。流分8经硅胶柱色谱,以石油醚-醋酸乙酯(99∶1、98∶2、97∶3)梯度洗脱,收集石油醚-醋酸乙酯97∶3的洗脱组分,再经Sephadex LH-20纯化,得到贡献成分2和3。流分23经Sephadex LH-20色谱柱分离,再经制备高效液相分离,流动相为甲醇-水65∶35,收集出峰时间为20.58 min的物质,得到贡献成分5。流分25经200~300目硅胶柱色谱,使用石油醚-醋酸乙酯系统(1∶9、2∶8、3∶7、5∶5)梯度洗脱,再经Sephadex LH-20纯化,得到贡献成分1。
2.5 细胞培养PC12细胞购自中国科学院上海细胞库,培养体系用含5%胎牛血清和10%马血清的RPMI 1640培养基,于37 ℃、5% CO2细胞培养箱中培养。培养前用多聚L-赖氨酸(0.01 mg/mL)包被培养瓶和培养皿,每隔3 d换液。
SH-SY5Y细胞由中国医学科学院药物研究所提供,用含10%胎牛血清的DMEM/F12培养液,于37 ℃、5% CO2细胞培养箱中培养,每隔2 d换液。
2.6 实验分组及药物处理PC12细胞经胰酶消化后用完全培养基制成浓度为2×105/mL的细胞悬液,接种于96孔培养板,每孔100 μL,放入37 ℃、5% CO2孵箱培养。24 h后弃去细胞液,空白组加入无血清培养基,模型组加入含20 mmol/L Glu的无血清培养基,给药组加入含20 mmol/L Glu及浓度分别为2、10、20、50、100 μmol/L的化合物1、3、4、5的无血清培养基。孵育48 h后进行MTT实验。
用含10% FBS的DF12培养基将SH-SY5Y细胞稀释为浓度1×105/mL细胞悬液,接种于96孔培养板,每孔100 μL,放入37 ℃、5% CO2孵箱培养。24 h后弃去细胞液,空白组加入无血清培养基,模型组加入含15 mmol/L Glu的无血清培养基,给药组加入含15 mmol/L Glu及20 μmol/L的化合物1、3、4、5的无血清培养基。孵育24 h后进行MTT实验。
2.7 MTT法检测细胞存活率吸去培养液,每孔加入含浓度为0.5 mg/mL MTT的无血清培养基,培养4 h后吸去培养基,每孔加入100 μL二甲基亚砜(DMSO),振荡5 min,待蓝色颗粒完全溶解,用酶标仪测定各组培养液在570 nm波长处的吸光度(A)值,计算细胞存活率。
3 结果 3.1 UPLC-PDA指纹图谱分析结果 3.1.1 检测波长的选择逍遥散复方成分复杂,本实验利用UPLC-PDA的优势,在全波长扫描模式的基础上,选择能检测出最多物质的检测波长。3D色谱图的等高线图如图 2所示(图中竖线表示色谱图在所对应的时间和检测波长下有吸收值,即在该条件下可检测出物质),结果显示254 nm可同时检测到相对保留时间tR为1.98、6.80、15.10 min的色谱峰,保留了最多的色谱峰信息(所得色谱图见图 3-A),可作为逍遥散有效部位UPLC色谱图的检测波长。
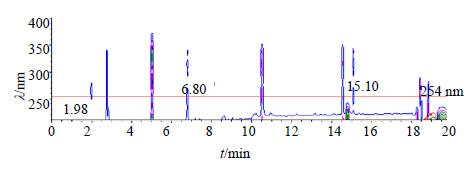 | 图 2 逍遥散有效部位的3D色谱图的等高线图Fig.2 3D Contour plot of active fraction in Xiaoyao Powder |
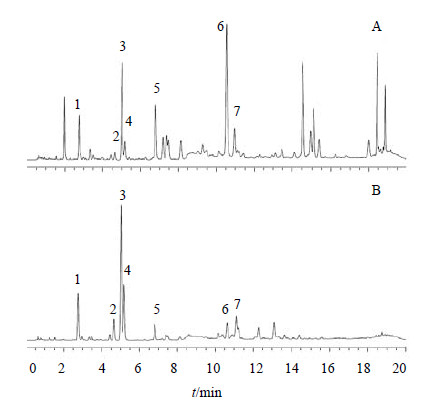 | 图 3 逍遥散 (A) 和当归 (B) 供试品溶液在254 nm下的UPLC色谱图Fig.3 UPLC of XiaoyaoPowder (A) and Angelica Sinensis Radix(B) at 254 nm |
精密吸取逍遥散和当归2种供试品溶液各2 μL,按上述色谱条件进行分析,记录2种供试品在254 nm处的UPLC色谱图。通过对比各色谱峰的相对保留时间,共指认出当归7个共有峰,色谱图见图 3。同时分别采集2种供试品中的共有峰在210~400 nm内的紫外光谱图(图 4),结果显示2种供试品溶液中1~5号峰的紫外光谱图完全一致,而6、7号峰的紫外光谱图不同,确证1~5号物质为当归对逍遥散的贡献成分。
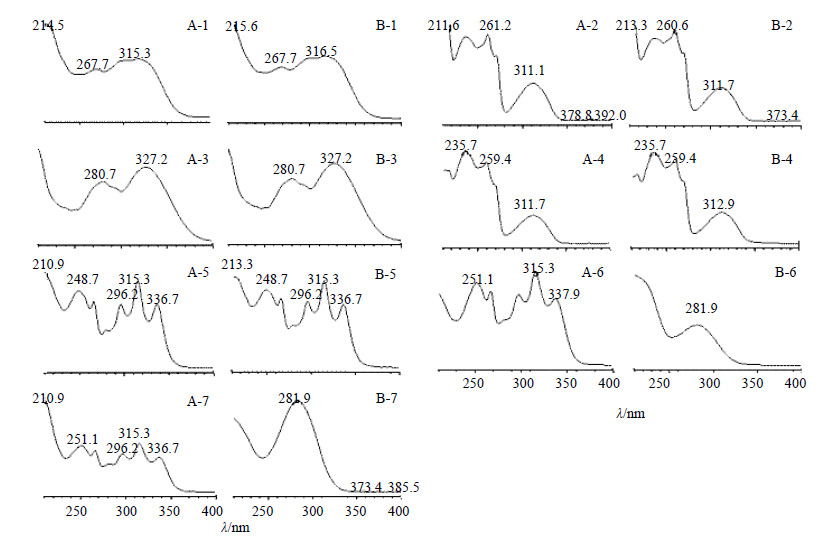 | 注释 图 4 逍遥散 (A) 和当归 (B) 指纹图谱中共有峰的UV光谱图Fig.4 Ultraviolet spectra of common peaks of Xiaoyao Powder (A) and Angelica Sinensis Radix (B) |
化合物1:黄色油状物(氯仿),ESI-MS m/z: 379 [M+Na]+, 163。1H-NMR (600 MHz, CDCl3) δ: 7.65 (1H, d, J = 15.9 Hz, H-7), 7.07 (1H, dd, J = 8.2, 1.8 Hz, H-6), 7.04 (1H, d, J = 1.8 Hz, H-2), 6.94 (1H, d, J = 1.7 Hz, H-2′), 6.91 (2H, d, J = 8.2 Hz, overlapped, H-5′, 6′), 6.86 (1H, d, J = 8.2 Hz, H-5), 6.63 (1H, d, J = 15.8 Hz, H-7′), 6.33 (1H, d, J = 15.8 Hz, H-8), 6.21 (1H, dt, J = 15.8, 6.6 Hz, H-8′), 4.84 (2H, dd, J = 6.6, 1.1 Hz, H-9′), 3.91 (3H, s, 3-OCH3), 3.90 (3H, s, 3′-OCH3);13C-NMR (150 MHz, CDCl3) δ: 170.0 (C-9), 151.0 (C-3), 149.8 (C-4), 149.6 (C-4′), 148.9 (C-3′), 148.1 (C-7), 137.3 (C-1), 131.8 (C-6), 129.9 (C-6′), 126.0 (C-1′), 123.9 (C-5), 123.5 (C-5′), 118.2 (C-7′), 117.7 (C-8), 117.4 (C-8′), 112.4 (C-2), 111.5 (C-2′), 68.1 (C-9′), 58.8 (3-OCH3), 53.6 (3′-OCH3)。以上数据与文献报道一致[12],故鉴定化合物1为阿魏酸松柏醇酯。
化合物2:黄色油状物(氯仿),EI-MS m/z: 188[M]+, 159 [M-CH2H3]+, 146, 131, 103。1H-NMR (600 MHz, CDCl3) δ: 7.93 (1H, dt, J = 7.7, 0.9 Hz, H-7), 7.84 (1H, d, J = 7.9 Hz, H-4), 7.72 (1H, dt, J = 7.6, 1.1 Hz, H-5), 7.55 (1H, dt, J = 7.6 Hz, H-6), 5.87 (1H, t, J = 8.2 Hz, H-8), 2.55 (2H, m, H-9), 1.63 (2H, m, H-10), 1.04 (3H, t, J = 7.4 Hz, H-11)。以上数据与文献报道一致[13, 14],故鉴定化合物2为E-丁烯基苯酞。
化合物3:淡黄色油状物(氯仿),EI-MS m/z: 190 [M]+, 161 [M-CH2H3]+, 148, 105。1H-NMR (600MHz, CDCl3) δ: 6.28 (1H, dt, J = 9.6, 2.1 Hz, H-7), 6.00 (1H, dt, J = 9.7, 4.3 Hz, H-6), 5.22 (1H, t, J = 8.0 Hz, H-8), 2.60 (2H, t, J = 9.4 Hz, H-4), 2.47 (2H, m, H-5), 2.38 (2H, td, J = 7.6 Hz, H-9), 1.51 (2H, m, H-10), 0.96 (3H, t, J = 7.4 Hz, H-11)。以上数据与文献报道一致[13, 15],故鉴定化合物3为藁本内酯。
化合物4:黄色油状物(氯仿),EI-MS m/z: 188 [M]+, 159 [M-CH2H3]+, 146, 131, 103, 77。1H-NMR (600 MHz, CDCl3) δ: 7.88 (1H, dt, J = 7.7, 0.9 Hz, H-7), 7.65 (2H, m, H-5, 6), 7.50 (1H, m, H-4), 5.64 (1H, t, J = 7.8 Hz, H-8), 2.45 (2H, q, J = 7.4 Hz, H-9), 1.55 (2H, m, H-10), 0.99 (3H, t, J = 7.4 Hz, H-11);13C-NMR (150 MHz, CDCl3) δ: 167.2 (C-1), 145.7 (C-3), 139.5 (C-3a), 134.2 (C-5), 129.3 (C-7), 125.2 (C-6), 124.4 (C-7a), 119.6 (C-4), 109.4 (C-8), 27.7 (C-9), 22.5 (C-10), 13.7 (C-11)。以上数据与文献报道一致[15],故鉴定化合物4为Z-丁烯基苯酞。
化合物5:棕红色油状物(氯仿),ESI-MS m/z: 379 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 6.65 (1H, dd, J = 15.5, 11.0 Hz, H-9), 6.41 (1H, dt, J = 15.9, 4.9 Hz, H-2), 6.31 (1H, dd, J = 15.3, 11.0 Hz, H-10), 5.87 (1H, d, J = 15.9 Hz, H-3), 5.79 (1H, dd, J = 15.3, 6.6 Hz, H-11), 5.70 (1H, d, J = 15.5 Hz, H-8), 5.68 (1H, s, H-2″), 5.44 (1H, d, J = 6.6 Hz, H-12), 4.26 (2H, dd, J = 4.9, 2.0 Hz, H-1), 4.11 (2H, t, J = 6.5 Hz, H-14), 2.16 (3H, s, H-5″), 2.01 (3H, s, H-2′), 1.99 (2H, m, H-13), 1.91 (3H, s, H-4″);13C-NMR (150 MHz, CDCl3) δ: 170.9 (C-1′), 165.5 (C-1″), 157.9 (C-2″), 145.4 (C-2), 143.5 (C-9), 135.0 (C-10), 131.0 (C-11), 115.6 (C-3″), 111.2 (C-8), 109.0 (C-3), 80.9 (C-4), 80.7 (C-7), 76.9 (C-6), 74.7 (C-5), 69.7 (C-12), 62.7 (C-1), 60.5 (C-14), 33.4 (C-13), 27.4 (C-5″), 20.9 (C-2′), 20.3 (C-4″)。以上数据与文献报道一致[16, 17],故鉴定化合物5为12-异戊烯酰基-14-乙酰基-2E,8E,10E-三烯-4,6-二炔-1-醇。
3.2.2 当归对逍遥散贡献成分的指认结果当归对逍遥散有效部位的贡献峰为1~5号峰,所对应的物质分别为阿魏酸松柏醇酯(1)、E-丁烯基苯酞(2)、藁本内酯(3)、Z-丁烯基苯酞(4)、12-异戊烯酰基- 14-乙酰基-2E,8E,10E-三烯-4,6-二炔-1-醇(5)。
3.3 神经保护作用研究 3.3.1 贡献成分对Glu损伤的PC12细胞的保护作用如图 5所示,20 mmol/L Glu作用48 h后,模型组的细胞存活率为45.2%,与对照组相比明显降低,表明该浓度Glu对PC12细胞有明显损伤作用,模型建立成功。图 5显示,给予一定浓度的化合物1、3、4保护后,细胞存活率明显升高。其中,阿魏酸松柏醇酯在2~50 μmol/L均表现出较好的保护作用,在20 μmol/L具有明显浓度依赖性,最佳剂量为20 μmol/L。藁本内酯对Glu损伤PC12的保护作用的最佳剂量为10 μmol/L。在一定浓度范围内,阿魏酸松柏醇酯和藁本内酯的保护作用具有明显的浓度依赖性,之后随剂量加大而保护作用减弱,这可能由于大剂量的化合物对PC12细胞产生了毒性。Z-丁烯基苯酞在2~100 μmol/L表现出较好的保护作用,并且具有明显浓度依赖性。12-异戊烯酰基-14-乙酰基-2E,8E,10E-三烯-4,6-二炔-1-醇(5)未表现出神经保护作用。
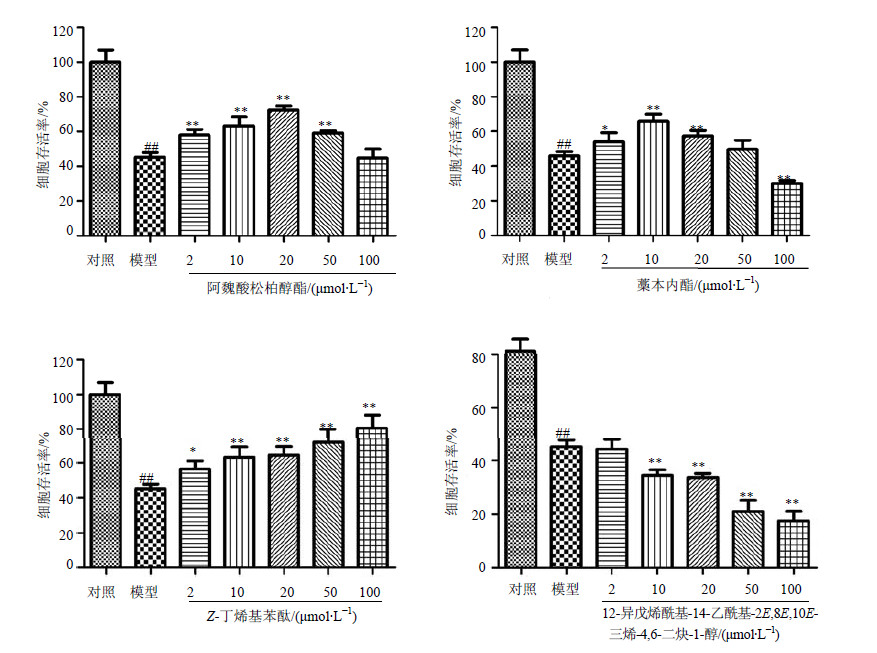 |
与对照组比较:##P<0.01 与模型组比较:*P<0.05 **P<0.01;下图同 |
20 μmol/L的化合物1、3、4对Glu所致PC12细胞损伤模型均表现出良好保护作用。本研究又考察了该浓度的化合物1、3、4是否对Glu损伤的SH-SY5Y细胞具有保护作用,结果见图 6。15 mmol/L Glu作用24 h后,损伤模型组与正常细胞对照组相比存活率明显降低,表明该浓度的Glu对SH-SY5Y细胞有明显损伤作用,模型建立成功,给予20 μmol/L的化合物1、3、4后,细胞存活率明显升高,差异有显著性,表明化合物1、3、4对Glu所致SH-SY5Y细胞的损伤也具有保护作用。
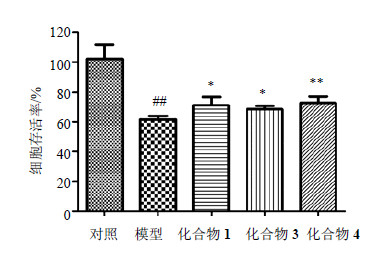 | 图 6 化合物1、3、4对谷氨酸损伤的SH-SY5Y细胞的保护作用Fig.6 Protective effect of compouds 1, 3, and 4 in SH-SY5Y cells injured by glutamate |
本研究通过UPLC-PDA导向分离技术对逍遥散中源于君药当归的药效成分进行了研究,成功归属并鉴定了当归对逍遥散抗抑郁有效部位的5个贡献成分,分别为阿魏酸松柏醇酯(1)、E-丁烯基苯酞(2)、藁本内酯(3)、Z-丁烯基苯酞(4)、12-异戊烯酰基-14-乙酰基-2E,8E,10E-三烯-4,6-二炔-1-醇(5)。体外活性结果显示化合物阿魏酸松柏醇酯(1)、藁本内酯(3)和Z-丁烯基苯酞(4)能有效保护Glu损伤SH-SY5Y和PC12细胞,为主要的有效成分。
本研究在研究方法上结合了中药分析的多种技术,首先采用了UPLC-PDA技术对逍遥散中源于当归的成分进行了归属,然后运用提取分离结合化学表征对贡献成分进行了鉴定,最后通过体外活性实验对贡献成分进行了活性验证。UPLC是近年来新兴的一种色谱技术,与传统的高效液相色谱相比,其
具有更快的分离速率、更高的分辨率和灵敏度[18],PDA检测器可以提供各成分的紫外特征光谱,UPLC- PDA的联合使用弥补了不同成分保留时间相同而引起的误差,可用于准确归属复方中源于各单味药材的成分。与LC-MS、GC-MS等定性方法比较,提取分离结合化学表征方法可准确鉴定各成分的结构式,并且市场上可购买的对照品有限,而分离得到的化合物为进一步的体外活性实验提供了物质基础。
现代医学对于抑郁症的病理研究认为[19],抑郁症病人慢性心理应激时,机体长期处于应激状态,HPA轴功能持续亢进,可导致抑郁病人兴奋性氨基酸谷氨酸的堆积,进而引起神经元变性,海马神经元的凋亡和死亡,甚至出现大脑功能形态损害,因此,大量研究以Glu损伤神经细胞模型模拟抑郁症时的病理改变[20, 21, 22]。本研究以高浓度Glu损伤SH-SY5Y和PC12细胞模型模拟抑郁神经细胞损伤状态,观察当归对逍遥散的贡献化合物在模型上对细胞的保护作用,筛选出药效成分为藁本内酯、Z-丁烯基苯酞和阿魏酸松柏醇酯,其中藁本内酯和Z-丁烯基苯酞在治疗抑郁症方面的作用已有报道[23],而阿魏酸松柏醇酯在该方面的活性为首次研究报道。
综上所述,本研究整合系列研究技术成功阐明逍遥散中的药效物质基础,为中药复方药效物质基础的研究提供了一种有效的研究方法。
| [1] | Gao X X, Zheng X Y, Li Z Y, et al. Metabonomic study on chronic unpredictable mild stress and intervention effects of Xiaoyaosan in rats using gas chromatography coupled with mass spectrometry[J]. J Ethnopharmacol, 2011, 137(1):690-699. |
| [2] | 秦献魁, 李萍, 韩梅, 等. 逍遥散治疗抑郁症随机对照试验的系统评价[J]. 中医杂志, 2010, 51(6):500-505. |
| [3] | 陈建丽, 田俊生, 周玉枝, 等. 基于代谢网络调控的逍遥散抗抑郁作用机制研究进展[J]. 中草药, 2014, 45(14):2100-2105. |
| [4] | Zhou Y Z, Lu L L, Li Z F, et al. Antidepressant-like effects of the fractions of Xiaoyaosan on rat model of chronic unpredictable mild stress[J]. J Ethnopharmacol, 2011, 137(1):236-244. |
| [5] | 左亚妹, 田俊生, 郭晓擎, 等. 逍遥散超临界提取工艺及提取物GC-MS特征图谱初步研究[J]. 中国中药杂志, 2014, 39(4):674-678. |
| [6] | 任艳玲, 贾广成, 马致洁, 等. 逍遥散抗抑郁活性部位筛选[J]. 时珍国医国药, 2012, 11(23):2689-2691. |
| [7] | 吕圭源, 陈素红. 关于中药有效部位新药研究的几点思考-中医药现代化[J]. 世界科学技术, 2004, 6(5):17-20. |
| [8] | 李会娟, 张宁, 李秋红. 逍遥散高效液相色谱指纹图谱的研究[J]. 中成药, 2011, 33(6):913-916. |
| [9] | 任艳玲, 周玉枝, 马致洁, 等. 逍遥散抗抑郁有效部位指纹图谱归属分析[J]. 山西医科大学学报, 2011, 42(8):636-640. |
| [10] | 秦竹, 唐瑶瑶, 毕秀华. "无忧汤"治疗抑郁症40例临床观察及疗效评价的研究[J]. 江苏中医药, 2012, 44(8):30-31. |
| [11] | 郑日新, 李从甫, 扬士友. 救肝开郁汤治疗抑郁症23例临床观察[J]. 安徽医药, 2003, 7(1):30-31. |
| [12] | Cheng C H, Alaganandam K, Lucy S H. Bio-assay guided isolation and identification of anti-Alzheimer active compounds from the root of Angelica sinensis[J]. Food Chem, 2009, 114(1):246-252. |
| [13] | Alejandra L, María Isabel C, Guillermo D, et al. 1H and DOSY NMR spectroscopy analysis of Ligusticum porteri rhizome extracts[J]. Magn Reson Chem, 2011, 49(8):469-476. |
| [14] | Claudio R, David M E, Malcolm B, et al. Product selection through photon flux:Laser-specific lactone synthesis[J]. Angew Chem (Int Ed Engl), 2008, 47(12):2283-2286. |
| [15] | 张金兰, 于德泉, 周志华. 辽藁本化学成分的研究[J]. 药学学报, 1996, 31(1):33-37. |
| [16] | Dong H Y, He L C, Huang M, et al. Anti-inflammatory components isolated from Atractylodes macrocephala Koidz[J]. Nat Prod Res, 2008, 22(16):1418-1427. |
| [17] | 董海燕, 董亚琳, 贺浪冲, 等. 白术抗炎活性成分的研究[J]. 中国药学杂志, 2007, 42(14):1055-1058. |
| [18] | Ashok K, Gautam S, Anroop N, et al. UPLC:a preeminent technique in pharmaceutical analysis[J]. Acta Pol Pharm, 2012, 69(3):371-380. |
| [19] | 全美娜. 抑郁症动物模型病因机制探讨及美金刚的可能疗效[D]. 天津:南开大学, 2011. |
| [20] | Mao Q Q, Zhong X M, Feng C R, et al. Protective effects of paeoniflorin against glutamate-induced neurotoxicity in PC12 cells via antioxidant mechanisms and Ca2+ antagonism[J]. Cell Mol Neur, 2010, 30(7):1059-1066. |
| [21] | 严灿, 吴丽丽, 潘毅, 等. 加味四逆散对皮质酮和谷氨酸致损伤的PC12细胞中cAMP反应元件结合蛋白及其磷酸化的影响[J]. 中国药理学通报, 2009, 25(2):270-274. |
| [22] | Sun Z W, Zhang L, Zhu S J, et al. Excitotoxicity effects of glutamate on human neuroblastoma SH-SY5Y cells via oxidative damage[J]. Neurosci Bull, 2010, 26(1):8-16. |
| [23] | Saizieu A D, Dsmlp A B, Regina G, et al. Ligustilide derivatives for the treatment of disorders of the central nervous system:WO 2008017491 A8[P]. 2007-8-10. |
 2015, Vol. 46
2015, Vol. 46


