2. 山西大学化学化工学院, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China
阿胶为马科动物驴Equus asinus L. 的干燥皮或鲜皮经煎煮、浓缩制成的固体胶[1]。阿胶是传统的滋补上品、补血圣药,药食两用,味甘平,入肺、肝、肾经,具有补血止血、滋阴润燥等功效。李时珍在《本草纲目》中有十分详细的记载“疗吐血,蛆血,血淋,尿血,肠风下痢,……,圣药也”[2]。
随着经济社会的不断发展,人们的工作生活压力明显增加,因此对养生保健也越来越重视。阿胶及其复方制剂作为传统的保健药品和养生食品也受到更多的关注,导致阿胶的市场需求快速增加,价格连连攀升。目前,阿胶原料驴皮紧俏、阿胶生产厂家众多、产品质量参差不齐,因此对于不同生产厂家的阿胶产品进行化学成分分析,进而建立更加全面可靠的质量控制新方法显得尤为重要。
阿胶的主要化学成分为骨胶原,水解可得明胶、蛋白质及多种氨基酸。阿胶含蛋白质约80%,水解产物主要为氨基酸,含有18种氨基酸(包括7种人体必需氨基酸)[3, 4, 5, 6]。关于氨基酸的分析有多种方法,其中包括氨基酸自动分析仪法[7, 8],柱前衍生高效液相色谱法[9, 10, 11, 12]、气相色谱-质谱联用法(GC-MS)[13, 14, 15]、液相色谱-质谱联用法(LC-MS)[16, 17, 18]及其他方法如光谱法[19]、电化学分析法[20]等。但这些方法均具有一定的局限性。
代谢组学是以组群指标分析为基础,以高通量检测和数据处理为手段,以信息建模与系统整合为目标的系统生物学的一个分支,是继基因组学、转录组学、蛋白质组学后系统生物学的另一重要研究领域[21, 22]。核磁共振(NMR)检测方法简单快速,测量精确,重复性高;测量结果受样本大小与外观色泽的影响较小,且不受操作人员的技术和判断所影响[23]。本研究采用1H-NMR代谢组学技术对市场主要生产厂家的阿胶酸水解产物进行化学成分差异性比较,以期探寻阿胶质量评价的新方法。
1 材料 1.1 药材阿胶样品购买自5个不同生产厂家(分别以代号A、B、C、D、E表示),批号分别为110914、1211011、121003、121104、1197481,样品均为长方形块状,黑褐色,有光泽,气微,味微甘。全部样品均经山西大学中医药现代研究中心秦雪梅教授鉴定为驴Equus asinus L. 的干燥皮或鲜皮经煎煮、浓缩制成的固体胶。
1.2 试剂蒸馏水,浓盐酸(37%,12 mol/L),D2O(美国默克试剂公司),2,2,3,3-三甲基甲硅烷基氘代丙酸钠盐(TSP,质量分数98%,Cambridge Isotope Laboratories,Inc.)。
1.3 仪器Bruker 600-MHz AVANCE III核磁共振检测仪(600.13 MHz);RE-52A旋转蒸发器(上海亚荣生化仪器厂);SHZ-III真空泵(上海知信实验仪器技术有限公司);TGL-16高速台式冷冻离心机(湘仪离心机仪器有限公司);25 mL Schott玻璃蓝盖瓶(德国Duran Group公司)。
2 方法 2.1 1H-NMR测试样本制备称取阿胶粗粉25 mg置于Schott蓝盖瓶中,其中加入10 mL 6 mol/L的盐酸溶液,振摇,超声溶解,置于110 ℃烘箱中,恒温水解24 h。取出放至室温,转移至25 mL圆底烧瓶中,并用蒸馏水多次洗涤,减压蒸干,放至室温后加入D2O(内含0.015% TSP)700 μL,超声助溶,转移至1.5 mL离心管中,13 000 r/min离心20 min,取600 μL上清液于5 mm核磁管中,待测。
2.2 1H-NMR测定条件样品在25 ℃下于Bruker 600-MHz AVANCE III NMR检测仪上采集数据,测定频率为600.13 MHz,采用预饱和水峰压制脉冲序列(noesygppr1d),参数设置:RD=5.0 s,傅里叶转换LB=0.3 Hz,PW=30°(12.7 μs),谱宽为12 345.7 Hz,采集65 536个数据点,扫描次数32次。
2.3 数据处理 2.3.1 1H-NMR图谱处理采用MestReNova核磁图谱专业处理软件对图谱进行内标(TSP)校准、相位校准及基线校准等规格化处理。以δ 0.01为单位,切除δ 4.50~4.90水峰区域,对δ 0.85~8.70区域的谱图进行积分,将所产生的积分数据进行归一化处理。
2.3.2 多元统计分析采用SIMCA-P 13.0软件将1H-NMR采集处理的积分数据进行中心化和规格化后,进行主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)模型验证,并用正交偏最小二乘判别分析(OPLS-DA)结合独立样本t检验找出差异化学成分。
3 结果 3.1 1H-NMR图谱的指认与分析结合每个化学成分的化学位移,裂峰情况及Chenomx NMR Suite(Chenomx Inc.,Edmonton,AB,加拿大)专业数据库,对所得图谱进行分析,共指认出了17种化合物(图 1),主要成分为氨基酸和有机酸,指认结果见表 1。
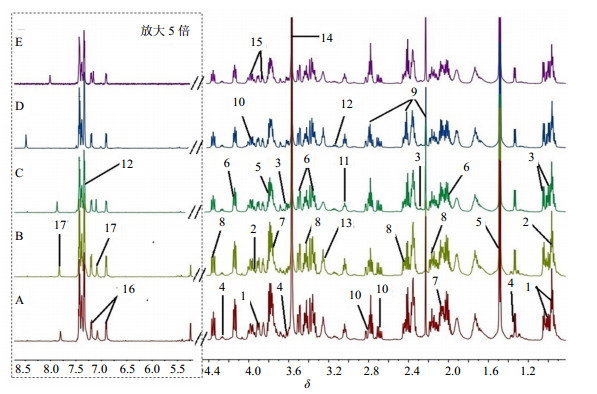 | 图 1 不同生产厂家阿胶1H-NMR图谱Fig.1 1H-NMR spectra of E′jiao from different manufacturers |
| 表 1 阿胶1H-NMR图谱中主要化学成分归属 Table 1 Peak attribution in 1H-NMR spectra for main components of E′jiao |
采用PCA分析法对A、B、C、D、E厂家的阿胶1H-NMR代谢轮廓进行分析,所得结果见图 2。从图中可以看出,不同厂家的阿胶具有一定程度的差异性。同时可以明显发现,A、B厂家阿胶的主成分较接近,而其余3个厂家(C、D、E)的主成分较接近,并且A、B与C、D、E沿t[1] 轴明显分开。
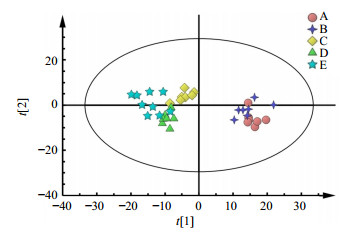 | 图 2 不同厂家阿胶1H-NMR谱PCA分析散点图Fig.2 PCA scores plotting in 1H-NMR spectra of E′jiao from different manufacturers |
为了进一步分析不同生产厂家的阿胶在化学成分上的差异性,选取B厂家阿胶作为对照,而其余厂家的阿胶与其进行OPLS-DA分析。而OPLS的使用必须以PLS模型通过验证为基础。排列实验是一种外部模型验证方法,主要用于验证PLS-DA模型的拟合程度和预测能力分析[24]。PLS-DA的模型验证图见图 3。从图 3可知,PLS-DA模型排列实验中左端任何一次随机排列产生的R2、Q2值均小于右端的原始值,表明原始模型的预测能力大于任何一次随机排列y变量的预测能力,即模型有效,可以做后续的差异成分寻找。所得OPLS-DA散点图及载荷图见图 4。
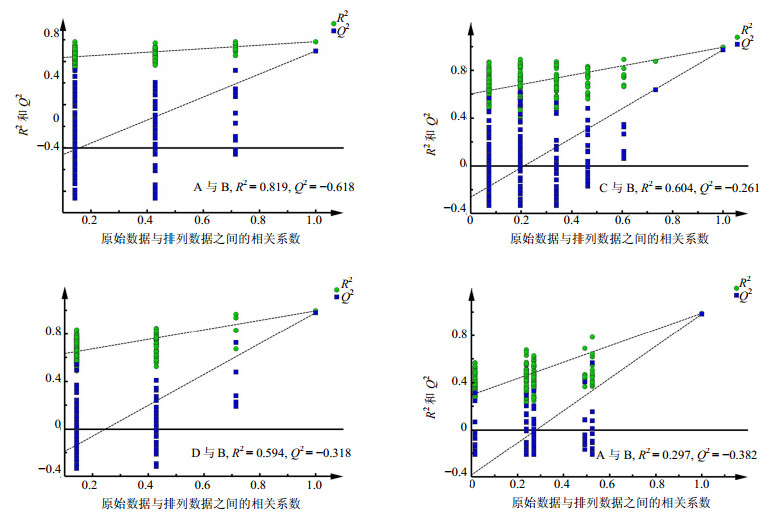 | 图 3 A、C、D、E厂家与B厂家阿胶模型有效验证图Fig.3 Effective varification of E′jiao from manufacturers A, C, D, E, and that from manufacturer B |
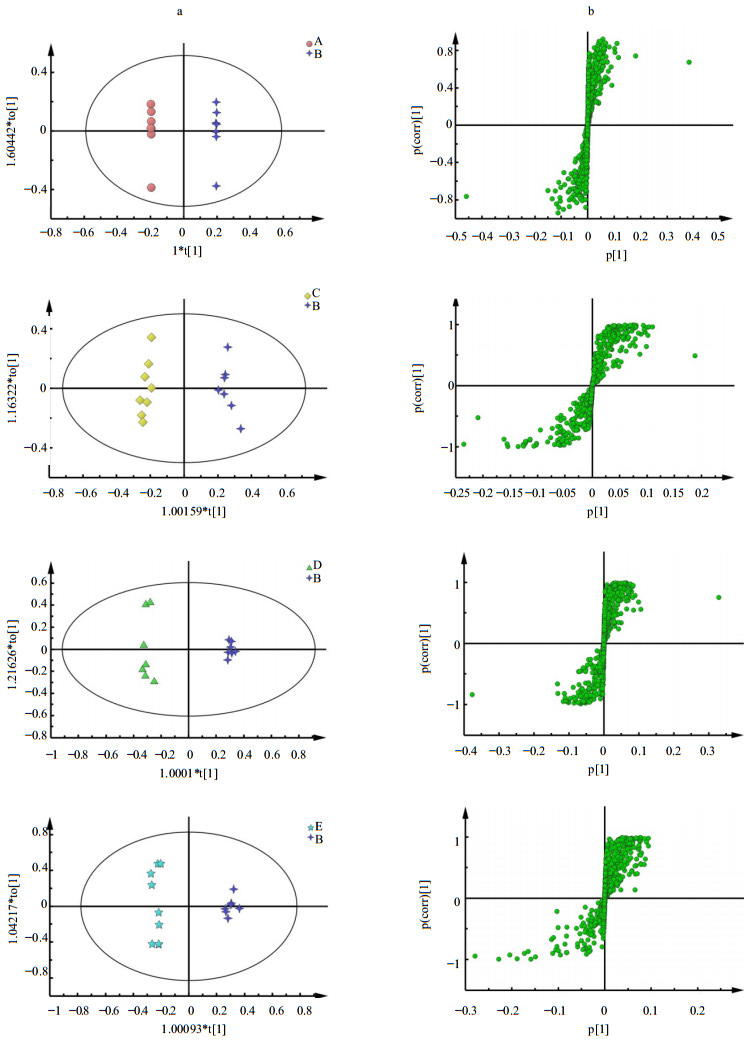 | 图 4 A、C、D、E各厂家与B厂家阿胶OPLS-DA散点图 (a) 及载荷图 (b)Fig.4 OPLS-DA scores plotting (a) and relative s-plotting (b) in 1H-NMR spectra of E′jiao from manufacturers A, C, D, E,and that from manufacturer B |
依据离原点越远的点对分组贡献越大的原则,结合由OPLS-DA分析得到的VIP值(选取前10%),找出A、C、D、E厂家阿胶与B厂家阿胶酸水解产物的差异性成分分别见图 5。
 |
两组间比较:*P<0.05 **P<0.01 *P < 0.05 **P< 0.01 between two groups 图 5 A、C、D、E各厂家与B厂家阿胶1H-NMR谱OPLS-DA分析载荷图具有显著性差异的成分Fig.5 Components with significant difference of OPLS-DA S-plotting in 1H-NMR spectra of E’jiao from manufacturers A, C, D, E, and that from manufacturer B |
从图 5可知,与B厂家阿胶相比,A厂家阿胶含较多乙酰丙酸,含较少赖氨酸和精氨酸;C厂家阿胶含较多乙酰丙酸、丙氨酸、亮氨酸、苏氨酸和苯丙氨酸,含较少异亮氨酸、精氨酸和羟脯氨酸;D厂家阿胶含较多乙酰丙酸、丙氨酸、亮氨酸、精氨酸和赖氨酸,含较少异亮氨酸和羟脯氨酸;E厂家阿胶含较多乙酰丙酸、丙氨酸和亮氨酸,含较少异亮氨酸、脯氨酸、丝氨酸和精氨酸,并且它们均具有显著性差异(P<0.05)。
4 讨论本研究在阿胶的谱图中发现阿胶酸水解物中含乙酰丙酸(又称4-氧化戊酸、左旋糖酸或戊隔酮酸),该成分应来源于制备阿胶的辅料冰糖[1]水解生成的单糖在酸性及高温条件下水解所得[25, 26]。并且在实验过程中发现阿胶加酸水解后出现腐黑物,该腐黑物的来源有2种可能[26]:一种为葡萄糖及其水解产物中含醛基、羟基、羧基,能够发生缩聚,生成不溶于水的高聚物或者腐黑物沉淀出来;二为高温使糖类炭化。
本实验中发现,不同生产厂家阿胶外观相似,但硬度及脆度不同,有的可轻易用手掰断,有的则需借助工具。同时,不同厂家的阿胶具有不用程度的腥味,因此,可以推测它们的化学成分是有差异的,而这些差异可能来源于阿胶原材料采集地的不同及阿胶制备过程中工艺的差异等。
阿胶主要有补血、抗休克、改善钙代谢平衡、调节免疫功能、止血、促进淋巴细胞转化率等药理作用。关于阿胶的药理作用机制,主要有2种学说[27],第1种是传统药理学说,认为阿胶的许多药理作用与其所含的氨基酸和微量元素有关;第2种是聚负离子结构学说,认为阿胶中中性氨基酸和酸性氨基酸的量高,其中含甘氨酸18.83%、脯氨酸9.40%、谷氨酸8.63%,这样具备了聚负离子基结构形成的物质基础。因此,可以推测阿胶的药理作用与其所含氨基酸具有密不可分的关系,但其具体作用成分仍需进一步探索分析。
综上所述,基于1H-NMR代谢组学的不同厂家的阿胶差异性成分研究是简便有效的,为阿胶的质量控制研究提供了新的方法。结合实验室前期使用RAPD分析方法对阿胶原材料驴皮与其伪品马皮的鉴别研究[28]及使用1H-NMR代谢组学对不同产地驴皮及其伪品的鉴别研究,后期将使用其他的技术如HPLC、GC-MS联用技术对阿胶进行研究,并结合药效学研究阿胶的有效作用成分,从而建立一套相对完整的阿胶质量控制体系。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 付 玥, 张 茹, 吴昊轩, 等. 阿胶的研究进展 [J]. 新经济, 2014(8): 18-19. |
| [3] | 杨晓君, 李厚建. 阿胶的研究应用现状 [J]. 中国民间疗法, 2009, 17(4): 66-67. |
| [4] | 余天真, 余椿生. 阿胶 [J]. 食品与药品, 2005, 7(6A): 22-24. |
| [5] | 尤金花, 田守生, 郭尚伟, 等. 阿胶及其疗效功能的研究进展 [J]. 明胶科学与技术, 2009, 29(4): 169-174. |
| [6] | 郭 健, 孙佳明, 张志颉, 等. 阿胶化学成分及药理作用研究进展 [J]. 吉林中医药, 2013, 33(4): 389-391. |
| [7] | 陈定一, 王静竹, 刘文林. 阿胶及其炮制品中氨基酸和微量元素的分析研究 [J]. 中国中药杂志, 1991, 16(2): 833-835. |
| [8] | Zhang H, Wang Z Y, Yang X, et al. Determination of free amino acids and 18 elements in freeze-dried strawberry and blueberry fruit using an amino acid analyzer and ICP-MS with micro-wave digestion [J]. Food Chem, 2014, 147: 189-194. |
| [9] | 陈萍红, 王书芳, 龚行楚. 柱前衍生RP-HPLC法测定阿胶中13种氨基酸 [J]. 中草药, 2013, 44(14): 1995-1999. |
| [10] | 王翠芬, 吕彩莲, 彭思梅, 等. HPLC 法测定阿胶中6种氨基酸的含量 [J]. 中国现代药物应用, 2014, 8(9): 1-3. |
| [11] | 谢 谊, 易 艳, 刘 阳, 等. 柱前衍生HPLC测定阿胶中17种水解氨基酸含量 [J]. 湖南中医药大学学报, 2012, 32(5): 46-49. |
| [12] | Marrubini G, Caccialanza G, Massolini G. Determination of glycine and threonine in topical dermatological preparations [J]. J Pharm Biomed Anal, 2008, 47(4): 716-722. |
| [13] | 张 佳, 王川丕, 阮建云. GC-MS及GC测定茶叶中主要游离氨基酸的方法研究 [J]. 茶叶科学, 2010, 30(6): 445-452. |
| [14] | 徐继林, 叶芳挺, 严小军. 微量海洋微藻脂肪酸甾醇及游离氨基酸GC-MS分析研究 [J]. 中国药学杂志, 2007, 41(24): 1895-1899. |
| [15] | Styring A K, Sealy J C, Evershed R P. Resolving the bulk δ15N values of ancient human and animal bone collagen via compound-specific nitrogen isotope analysis of constituent amino acids [J]. Geochim Cosmochim Acta, 2010, 74(1): 241-251. |
| [16] | Kato M, Yamazaki T, Goto M, et al. Comparison of three amino acid analysis methods and their application to the amino acid impurity analysis for the development of high-purity amino acid certified reference materials [J]. Accredit Quality Assur, 2013, 18(6): 481-489. |
| [17] | Guo S, Duan J, Qian D, et al. Rapid determination of amino acids in Fruits of Ziziphus jujuba by hydrophilic interaction ultra-high-performance liquid chromatography coupled with triple-quadrupole mass spectrometry [J]. J Agric Food Chem, 2013, 61(11): 2709-2719. |
| [18] | 马 戎, 鲍峰伟, 冯文宁, 等. 液相色谱串联质谱法测定烟草中的游离氨基酸 [J]. 中国测试, 2013, 39(2): 34-37. |
| [19] | 李兴军, 姜 平, 陆 晖. 小麦及加工品中游离氨基酸总量测定 [J]. 粮食科技与经济, 2013, 38(1): 35-36. |
| [20] | 李春香, 令玉林, 邓克勤. 电化学还原的氧化石墨烯修饰电极检测L-色氨酸 [J]. 分析科学学报, 2013, 29(2): 231-234. |
| [21] | 夏建飞, 梁琼麟, 胡 坪, 等. 代谢组学研究策略与方法的新进展 [J]. 分析化学, 2009, 37(1): 136-143. |
| [22] | 周京琳, 李 伟. 基于核磁共振的代谢组学技术在生命科学领域的研究进展 [J]. 国际口腔医学杂志, 2008, 35(2): 152-152. |
| [23] | 邹 云, 贺建华, 谢红兵, 等. 基于核磁共振的代谢组学在动物营养中的应用 [J]. 动物营养学报, 2012, 24(11): 2073-2078. |
| [24] | 田 栋, 李震宇, 范圣此, 等. 基于NMR代谢组学技术的不同产地黄芪水溶性浸出物化学组成分析 [J]. 药学学报, 2014, 49(1): 89-94. |
| [25] | 李 静. 糖类催化水解制备乙酰丙酸的研究 [D]. 合肥: 安徽理工大学, 2013. |
| [26] | 周 昆. 糖类物质水解生成乙酰丙酸的研究 [D]. 无锡: 江南大学, 2008. |
| [27] | 郭成浩, 金 毅, 祁玉成, 等. 阿胶结构与药理功能研究进展 [J]. 青岛医学院学报, 1998, 34(4): 310-311. |
| [28] | 田俊生, 史碧云, 张福生, 等. 驴皮药材RAPD分析方法建立及其与伪品马皮的鉴别 [J]. 中草药, 2013, 44(3): 354-358. |
 2015, Vol. 46
2015, Vol. 46


