杜仲Eucommia ulmoides Oliv. 是杜仲科杜仲属植物,是我国特有的多年生落叶乔木药用植物,传统以皮入药,是名贵的滋补药材,《神农本草经》中将杜仲皮列为“上品”,名为“思仙”[1]。随着研究的深入,学者发现杜仲皮和叶的化学成分基本相似,杜仲叶因为资源优势,逐渐被医学工作者接受并重视,收录于《中国药典》2005年版和2010年版。杜仲叶中化学成分骨架结构复杂庞杂,其中以京尼平苷酸(geniposidic acid,GPA)为代表的环烯醚萜类结构最为多样。GPA可以用于治疗炎症、黄疸和肝疾病,对肿瘤细胞也有一定的抑制作用[2, 3],具有预防性功能低下、预防学习行为低下和增强记忆功能,其量伴随杜仲叶采摘时间变化明显,在6月份达到最高,达到1.7%[4]。目前,对于杜仲中GPA分离,基本上采用溶剂提取,提取液经浓缩后用水溶解除去脂溶性杂质,然后用石油醚、醋酸乙酯、正丁醇萃取得到3个不同极性部位,再采用大孔树脂吸附,硅胶柱色谱以及制备高效液相色谱进行分离纯化[5, 6, 7]。
双水相气浮溶剂浮选技术是在双水相萃取联用气浮溶剂浮选技术基础上,发展起来的一种全新高效的分离富集技术,它综合了双水相萃取[8]和气浮溶剂浮选[9] 2种技术的优点。常用的双水相气浮溶剂浮选体系是由亲水性高聚物或者小分子亲水有机溶剂和无机盐组成,形成上、下两相后,在气体作用下对目标物进行浮选。其浮选过程受多个变量控制,浮选体系复杂,涉及气、液、固3相体系运动,形成气-液、固-液及气-固多相界面,依靠界面性质的改变,达到分离富集的目的。近年来,该技术在多种中药活性成分分离富集方面都有应用,例如,甘草中甘草苷[10]、桑黄中总黄酮[11]、葛根中葛根素[12]、黄芩中黄芩苷[13]。在常用的双水相浮选体系中,以亲水性小分子有机溶剂与无机盐以一定比例混合形成的双水相体系,具有原料成本低、黏度低、传质速度快、操作简便等优点,避免了高聚物价格昂贵,黏度高,反萃取难度大的缺点,应用最为广泛[14, 15]。本研究采用乙醇/NaH2PO4双水相气浮溶剂浮选技术,对杜仲叶粗提液中GPA进行分离富集研究,考察了无机盐的种类与用量、有机溶剂的种类和用量、空气体积流量、浮选时间、杜仲叶粗提液的加入量等实验条件,并在单因素试验基础上,选择NaH2PO4质量分数、乙醇体积分数和空气体积流量为实验因素,采用Box-Behnken中心组合设计进行优化实验,确定京尼平苷酸的最优浮选工艺,并进行100倍放大研究。本研究为杜仲叶中环烯醚萜类活性成分分离富集提供了一种有效新方法。
1 仪器与材料GZX-9146-MBE数显鼓风干燥箱,上海博迅实业有限公司医疗设备厂;LC-20A高效液相色谱仪,日本岛津公司;LZB-3WB玻璃转子流量计,常州双环热工仪表有限公司;AEG-220型万分之一天平,日本Shimaazu公司;EASY15超纯水仪,青岛市力康生物医疗科技控股有限公司;自制浮选装置,包括气泵、缓冲瓶、流量计和G4砂芯玻璃柱。杜仲叶采集于吉首大学张家界校区实验基地,经吉首大学廖博儒研究员鉴定为杜仲科杜仲属植物杜仲Eucommia ulmoides Oliv. 的叶;京尼平苷酸对照品(批号111828-201001),质量分数≥98%,购自日本光和纯工业株式会社。
2 方法与结果 2.1 杜仲叶粗提液的制备称取25.00 g干燥的杜仲叶(放入80 ℃烘箱中,烘干2 h)于圆底烧瓶中,加入80%乙醇500 mL,80 ℃回流提取2 h,滤过,减压浓缩,转移于250 mL量瓶加去离子水定容作为储备液,实验前离心处理(除去不溶性物质)作为杜仲叶粗提液(HPLC分析GPA质量浓度约为0.3 mg/mL)。
2.2 双水相浮选实验准确称取一定质量无机盐,用一定质量的去离子水和5 g杜仲叶粗提液进行溶解,转入浮选柱,加入一定质量无水乙醇,使双水相体系总质量为20 g(上相为有机相,下相为水相),从浮选柱下端通入一定体积流量的空气,浮选一段时间后,停止通气,将浮选柱中溶液迅速转入带刻度25 mL试管中,静置,待溶液能够分成2相,且界面清晰,上、下相体积不变后,记录上、下相体积。用移液器准确移取1.00 mL上相溶液置于玻璃培养皿,放于烘箱中50 ℃烘干2 h;烘干后,用50%甲醇溶液将其转移于5 mL量瓶中并定容,过0.45 μm有机系滤膜,进行HPLC检测[16, 17];下相溶液直接过0.45 μm有机系滤膜,进行HPLC检测。
2.3 液相色谱条件色谱柱为Agilent TC C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.1%磷酸水溶液(23∶77),体积流量1.0 mL/min;柱温35 ℃,检测波长240 nm,进样量20 μL[18, 19]。色谱图见图 1。
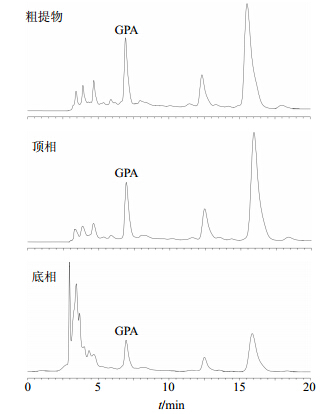 | 图 1 不同样品的HPLC色谱图Fig. 1 HPLC analysis of samples obtained from various extraction steps |
精密称取GPA对照品22.8 mg,用甲醇溶解并定容至5 mL量瓶中,配成4.560 mg/mL的GPA对照品溶液,采用逐级稀释法,分别移取一定体积的母液,用50%甲醇定容至5 mL量瓶中,配制成GPA质量浓度分别为16.8、42.0、70.0、175.1、437.8、729.6 μg/mL对照品溶液。以质量浓度为横坐标(X),峰面积积分值为纵坐标(Y)绘制标准曲线,得回归方程:Y=30 975 X-30 884,r2=0.999 9,线性范围16.8~729.6 μg/mL。同时取70 μg/mL的GPA对照品溶液,按“2.3”项下的色谱条件,连续进样6次,进行HPLC检测,结果显示GPA保留时间的RSD为0.43%,峰面积的RSD为0.42%。
2.5 浮选效率的计算富集倍数(α)=Ct/C,相比(R)=Vt/V,浮选效率(E)=(1-C/C0)[12, 13],其中C0为浮选前水相中京尼平苷酸质量浓度,C为浮选后水相中京尼平苷酸质量浓度,Ct为浮选后上相中京尼平苷酸质量浓度,V为浮选后水相体积,Vt为浮选后上相体积。
2.6 双水相浮选条件优化 2.6.1 亲水有机溶剂及无机盐的选择通过改变有机溶剂的加入量,考察在室温条件下,采用浊点法绘制乙醇、正丙醇、异丙醇/NaH2PO4双水相体系相图[20]。由图 2可知,有机溶剂分相能力:正丙醇>异丙醇>乙醇[21],3种溶剂都有较好的分相效果,而正丙醇/NaH2PO4双水相体系展现出相对较宽的分相范围;GPA属于大极性物质,易溶于强极性溶剂中,在水中的溶解性大于甲醇、乙醇等有机溶剂,常用的亲水有机溶剂极性顺序为乙醇>正丙醇>异丙醇,经过对比正丙醇/NaH2PO4和乙醇/NaH2PO4双水相气浮溶剂浮选体系发现,后者GPA在液相中能够出现正常的正态分布峰型,E高,前者GPA峰型不规则。因此本实验选择乙醇作为分相有机溶剂。
 | 图 2 3种醇与NaH2PO4的相图Fig. 2 Phasediagrams for three alcohols and NaH2PO4 |
无机盐筛选中,考察了K3PO4、K2HPO4、KH2PO4、NaH2PO4、(NH4)2SO4、NaCl 6种无机盐的分相情况,结果表明,乙醇不能和NaCl溶液形成双水相体系,在乙醇/K3PO4、乙醇/K2HPO4、乙醇/KH2PO4、乙醇/NaH2PO4和乙醇/(NH4)2SO4等5种双水相体系中,分相能力最好的是 (NH4)2SO4,能够在较少的盐和醇用量时形成稳定的双水相体系,但 (NH4)2SO4溶解度随温度影响比较大,容易析出晶体,分相稳定时间较短;K3PO4和K2HPO4虽能够稳定分相、持续时间长,但属于碱性盐,由于GPA在碱性条件下不稳定、容易分解,导致浮选后在体系的上相与水相中均检测不出GPA,所以不适合作为浮选体系。KH2PO4和NaH2PO4分相能力虽不如K3PO4和K2HPO4,但属于酸性盐,GPA在其中相对稳定,经实验验证,发现乙醇/KH2PO4、乙醇/NaH2PO4对GPA的浮选效果较好,但由于KH2PO4在水中的溶解度较小(20 ℃,226 mg/mL),最终选择乙醇/NaH2PO4双水相体系为最优体系分离富集GPA。
2.6.2 NaH2PO4加入量的影响NaH2PO4的质量分数在20%、25%、30%、35%时,其他按“2.2”项下方法进行,结果见图 3。结果显示,随着NaH2PO4用量的不断加入,GPA E和α都逐渐增大;到达某一临界点时,E和α都逐渐减小,而R随NaH2PO4用量的加入,逐渐变小。这是因为双水相体系的分相过程是一个有机溶剂与无机盐竞争夺取水分子的过程,分相能力与有机溶剂的水化能力和无机盐的盐析能力密切相关,随着NaH2PO4用量的增加,水相中NaH2PO4可以比上相乙醇溶剂争夺更多的水分子,下相体积增大,上相体积减小,R持续减小;在气泡的传质作用下,E和α在NaH2PO4质量分数为25%时达到最大。但由于GPA是强极性物质,易溶于水溶液中,当继续增加NaH2PO4的用量时,水相中NaH2PO4用量增大,导致GPA更易富集于水相,E和α降低。
 | 图 3 分相盐质量分数的影响Fig. 3 Effect of mass fraction of salt on flotation |
无水乙醇的体积分数在15%、20%、25%、30%时,其他按“2.2”项下方法进行,结果见图 4。结果显示:GPA E和α都逐渐增大;到达某一临界点时,E和α都逐渐减小,而R随NaH2PO4的加入,逐渐增大。随着乙醇用量增加,乙醇分子可以比NaH2PO4争夺更多的水分,使得上相中水量增大,下相体积减小,R持续增大,E和α在乙醇体积分数为20%时达到最大;当继续增加乙醇用量,使水相中溶解的乙醇量增大,E和α降低。
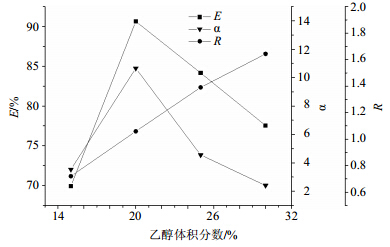 | 图 4 乙醇体积分数的影响Fig. 4 Effect of mass fraction of ethanol on flotation |
空气体积流量为20、30、40、50 mL/min时,其他按“2.2”项下方法进行,结果见图 5。随着空气体积流量的增大,E和α都出现波浪式变动,30、50 mL/min效果要优于20、40 mL/min,R则相反。总体来讲,增大空气体积流量有利于提高气泡结合GPA分子的能力和接触时间,增加E;当空气体积流量为40 mL/min时,气泡量增加使得器壁上气泡首尾相连形成通道,使得GPA倒流回水相,同时有更多气泡在上升过程中由于碰撞等原因导致提前破裂,使得吸附在气泡表面的GPA分子未进入上相;当空气体积流量为50 mL/min时,使得浮选柱中上、下相完全混合成均一相,增大了GPA与有机溶剂的接触面积和接触时间,所以E偏大。
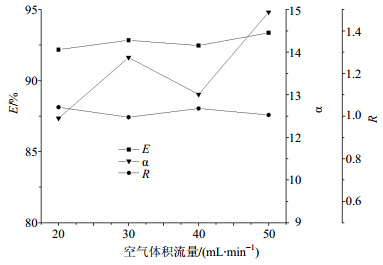 | 图 5 空气体积流量的影响Fig. 5 Effectof air flow rate on flotation |
浮选时间在10、20、30、40 min时,其他按“2.2”项下方法进行,结果见图 6。结果显示,E随时间的延长而增大,当浮选时间为20 min时,浮选基本达到平衡,继续增加浮选时间,E变化不大。
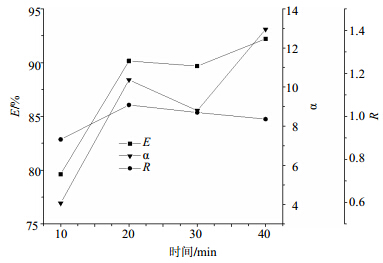 | 图 6 浮选时间的影响Fig. 6 Effect of time on flotation |
杜仲粗提液的加入量为1、3、5、7、9 g,其他按“2.2”项下方法进行。结果表明双水相浮选实验前水相中GPA的质量浓度对浮选效果影响不大,故选择杜仲粗提液的加入量为5 g。
2.7 响应曲面法优化实验设计为了进一步优化双水相气浮溶剂浮选法分离富集GPA的工艺条件,考察因素之间是否存在交互作用,根据Box-Behnken实验设计原理,在单因素实验基础上,选择了NaH2PO4质量分数(A)、乙醇体积分数(B)、空气体积流量(C)为自变量,E为因变量,共设计17个实验点,每个实验点做3次平行,进行响应曲面分析优化确定GPA的最佳浮选条件,实验安排及实验结果见表 1。采用Design-Expert 8.05b软件对表 1中的数据进行回归分析,方差分析见表 2,通过对各因素进行回归分析,拟合得到E与各自变量的回归方程为Y=95.47+1.72 A+2.13 B+0.074 C-1.15 AB+0.54 AC+0.71 BC-0.53 A2-0.86 B2-0.25 C2。
| 表 1 Box-Behnken实验设计及结果 Table 1 Design and results of Box-Behnken test design |
| 表 2 回归方程显著性检验 Table 2 Significance test of regression equation |
从表 2可以看出,数学模型的F=9.55、P=0.003 5<0.05,表明该模型对双水相气浮溶剂浮选工艺影响显著,模型确定系数R2=0.924 7,变异系数CV=0.98%,模型调整系数Radj2=0.827 9,表明数据离散程度较小,模拟程度良好,实验误差较小,模型相关度良好。A、B对浮选工艺有显著影响,交互项中A与B对E影响显著。二次项均对E影响不显著。实验因素间交互作用的3D响应曲面见图 7。
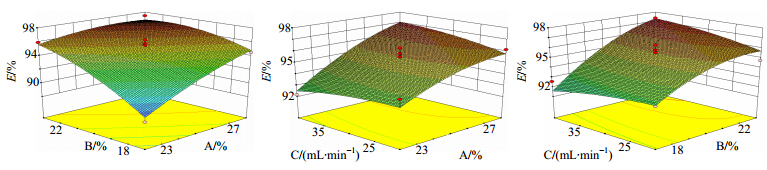 | 图 7 交互作用对GPA E影响Fig. 7 Effect of interaction on flotation efficiency of GPA |
结合Box-Behnken实验设计方案,利用RSM研究各个因素之间对GPA E的影响,预测得出GPA的最优浮选实验条件为NaH2PO4的质量分数为28%,乙醇的体积分数为22.92%,空气体积流量为40 mL/min,E最大值为97.85%。
2.8 验证实验为验证该模型的有效性,考虑实际情况,将浮选条件中乙醇体积分数修正为23%,选择NaH2PO4 的质量分数为28%,乙醇的体积分数为23%,空气体积流量为40 mL/min,加入5 g粗提液,浮选20 min。按照“2.2”项下操作进行5次验证实验,结果5次的E分别为97.88%、97.71%、97.91%、98.04%、97.86%。由此可知,优化条件下GPA的E平均为97.88%,α为27.34,非常接近理论预测值97.85%。
2.9 放大实验为了验证最优实验条件的实用性,结合实际情况,对最优实验工艺进行了100倍放大研究。由于浮选柱中待浮选的双水相溶液质量为2 000 g,小试时40 mL/min的体积流量不能完成浮选实验,所以选用空气压缩机将气体体积流量设定为能使两相有清晰界面的最大体积流量为最佳体积流量,浮选20 min,进行2次实验,结果显示,GPA的E为95.60%,α为8.40,RSD为0.77%,说明优选的浮选工艺条件实用性良好,可以进一步进行中试放大研究,能够为工业生产提供一定的理论指导,具有较好的应用前景。
3 讨论双水相萃取因为存在易乳化、分相时间长、分离效率低等缺点,限制了其应用,实验中常常需要借助超声、离心、微波等一系列的仪器设备来辅助完成实验,本实验基于双水相萃取,辅助气浮溶剂浮选技术对杜仲叶乙醇提取物中GPA进行了系统分离富集研究。
实验采用单因素试验考察了无机盐的种类和用量、有机溶剂的种类和用量、空气体积流量、浮选时间和粗提液加入量5个因素对E、α和R的影响。其中NaH2PO4的质量分数,乙醇的体积分数和空气流速对浮选效果影响较大,本研究采用了3因素3水平的响应面实验设计,Box-Behnken实验设计通过非线性模型拟合,优选出最佳浮选工艺条件,避免了正交试验设计和均匀试验设计的不全面性,具有较好的预测性,为双水相气浮溶剂浮选法分离富集中药活性成分提供了科学依据。结果显示,在NaH2PO4的质量分数为28%、乙醇的体积分数为23%,杜仲叶粗提液的加入量为5 g,空气体积流量为40 mL/min,浮选时间为20 min条件下,GPA的E达到97.88%,α达到27.34。双水相气浮浮选技术为中药中活性成分的高效快速分离提供了一种新方法。
| [1] | 张康健, 马希汉. 杜仲次生代谢产物与人类健康 [M]. 杨凌: 西北农林科技大学出版社, 2009. |
| [2] | Kim S J, Kim K M, Park J, et al. Geniposidic acid protects against D-galactosamine and lipopolysaccharide induced hepatic failure in mice [J]. J Ethnopharmacol, 2013, 146(1): 271-277. |
| [3] | Pan I H, Chiu H H, Lu C H, et al. Aqueous two-phase extraction as an effective tool for isolation of geniposide from gardenia fruit [J]. J Chromatogr A, 2002, 977(2): 239-246. |
| [4] | Zhang Q, Su Y Q, Zhang J F. Seasonal difference in antioxidant capacity and active compounds contents of Eucommia ulmoides Oliver leaf [J]. Molecules, 2013, 18(2): 1857-1868. |
| [5] | 李湘洲, 胡文彬, 张 胜, 等. 大孔吸附树脂纯化杜仲叶加工剩余物中的京尼平苷酸 [J]. 光谱实验室, 2012, 29(4): 2006-2011. |
| [6] | 曹 慧, 陈晓青. 固相萃取分离纯化杜仲中环烯醚萜类化合物 [J]. 中草药, 2006, 37(12): 1806-1807. |
| [7] | 邹登峰, 何翠微, 朱 华, 等. 制备色谱法制备京尼平甙酸 [J]. 化学工程师, 2005, 19(9): 7-8. |
| [8] | 刘磊磊, 李秀娜, 赵 帅. 双水相萃取在中药活性成分提取分离中的应用进展 [J]. 中草药, 2015, 46(5): 766-772. |
| [9] | Bi P Y, Dong H R, Dong J. The recent progress of solvent sublation [J]. J Chromatogr A, 2010, 1217(16): 2716-2725. |
| [10] | Chang L, Wei Y, Bi P Y, et al. Recovery of liquiritin and glycyrrhizic acid from Glycyrrhiza uralensis Fisch by aqueous two-phase flotation and multi-stage preparative high performance liquid chromatography [J]. Sep Purif Technol, 2014, 134: 204-209. |
| [11] | 戈延茹, 潘 茹, 傅海珍, 等. 离子液体双水相溶剂浮选法分离/富集桑黄黄酮类成分 [J]. 分析化学, 2012, 40(2): 317-320. |
| [12] | Bi P Y, Dong H R, Yuan Y C. Application of aqueous two-phase flotation in the separation and concentration of puerarin from Puerariae extract [J]. Sep Purif Technol, 2010, 75(3): 402-406. |
| [13] | Bi P Y, Chang L, Mu Y L, et al. Separation and concentration of baicalin from Scutellaria baicalensis Georgi extract by aqueous two-phase flotation [J]. Sep Purif Technol, 2013, 116: 454-457. |
| [14] | 毕鹏宇, 常 林, 董慧茹. 双水相浮选过程中青霉素的分离行为 [J]. 分析化学, 2011, 39(3): 425-428. |
| [15] | 范芳芳. 离子液体双水相气浮溶剂浮选/分离水中抗生素的研究 [D]. 西安: 长安大学, 2014. |
| [16] | 傅海珍, 谢 菊, 陈晶晶, 等. 双水相浮选-HPLC法测定水中氯硝柳胺 [J]. 环境科学与技术, 2013, 36(9): 100-103. |
| [17] | Ge Y R, Cao H J, Qi X Y, et al. Aqueous two-phase solvent sublation-HPLC for determining tilmicosin residues in environment water samples [A]//The International Conference on Remote Sensing, Environment and Transportation Engineering [C]. Piscataway: IEEE Press, 2011. |
| [18] | 李 钦, 杜红岩, 杜兰英, 等. HPLC法测定杜仲雄花和杜仲雄花茶中京尼平苷酸、绿原酸和京尼平苷 [J]. 中草药, 2009, 40(1): 71-72. |
| [19] | 党会章, 刘磊磊, 赵 帅. 杜仲饮片中京尼平苷酸和京尼平苷的含量测定 [J]. 抗感染药学, 2014, 11(4): 315-317. |
| [20] | Nemati-Knade E, Shekaari H, Jafari S A. Thermodynamic study of aqueous two phase systems for some aliphatic alcohols plus sodium thiosulfate plus water [J]. Fluid Phase Equilibr, 2012, 321: 64-72. |
| [21] | Jiang X M, Lu Y M, Tan C P, et al. Combination of aqueous two-phase extraction and cation-exchange chromatography: New strategies for separation and purification of alliin from garlic powder [J]. J chromatogr B, 2014, 957: 60-67. |
 2015, Vol. 46
2015, Vol. 46


