2. 吉林省长白县科学技术协会, 吉林 白山 134400
2. Association of Science and Technology in Changbai County, Jilin Province, Baishan 134400, China
人参Panax ginseng C. A. Meyer为名贵中药,在我国东北已形成规模化种植[1]。在栽培条件下,人参常发生根腐病、疫病、锈腐病等病害,并随人参种植年份的增加,病害的种类、发病面积及严重程度也逐年增加,严重制约着人参产业的健康发展。开发人参内生菌资源,用于人参病害的生物防治,对于提高人参品质和保护环境都具有非常重要的意义。目前对人参内生菌的报道多集中在内生菌分离和内生菌次生代谢产物研究上,人参内生菌用于植物病害预防和治疗的报道较少,仅有对人参内生细菌做了生防研究[2, 3],内生真菌和内生放线菌鲜有报道,人参内生菌这一重要资源未得到充分开发。因此本实验对吉林省人参内生菌资源进行系统研究,探索其对人参病原菌的拮抗作用,筛选有抑菌活性的内生菌,为揭示吉林省人参内生菌资源状况,以及进一步研发人参病害的生物防治剂和促生生物菌剂提供重要依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株及植物材料人参锈腐病菌Cylindrocarpon destructans (Zinss) Scholten、灰霉病菌Botrytis cinerea Pers、菌核病菌Sclerotinia schinseng Wang et Chen、疫病病菌Phytophthora cactorum Schroet、黑斑病菌Alternaria panax Whetz、根腐病菌Fusarium solani (Mart.) App. et Wollenw、立枯病菌Rhizoctonia solani Kuhn. 7种人参常见病原菌由本课题组保存。2013年7~8月,在吉林省人参主产区采集健康人参植株为供试材料(表 1),由吉林农业大学中药材学院田义新教授鉴定。
| 表 1 样品来源情况 Table 1 Sample source |
马铃薯葡萄糖(PDA)培养基;牛肉膏蛋白胨(NA)培养基;高氏I号培养基;PDA液体培养基。
1.1.3 主要试剂和仪器基因组提取试剂盒,2×Power Tap PCR Master Mix(北京百泰克生物技术有限公司);通用引物 [金唯智生物科技(北京)有限公司]。TC-XP型PCR扩增仪(杭州博日科技有限公司);BIS910凝胶成像系统(北京东胜创新生物科技有限公司);超微量紫外可见分光光度计(北京百泰克生物技术有限公司);超净工作台(上海博迅实业有限公司)。
1.2 组织表面消毒将采集到的人参样本先在流水下冲洗,去除表面的泥土和灰尘。室温晾干,用灭菌滤纸吸干植物表面剩余的水分。选择没有破损且完整的根、茎和叶片,切成2 cm见方的小块(段、片),在50%乙醇中浸泡1 min后置于75%乙醇中1 min,再对根使用0.10% HgCl2处理11 min,茎使用0.10% HgCl2处理7 min,叶使用2% NaClO处理5 min进行表面消毒,然后用无菌水冲洗3~5次。把处理后的组织接入NA培养基,观察2周无污染后,切去表皮,切成0.5 cm见方的小块(段、片)接入NA培养基,观察是否有污染。每个处理3次重复。
1.3 内生菌的分离纯化内生细菌分离采用NA培养基,内生真菌分离采用PDA培养基,内生放线菌分离采用高氏I号培养基。分离得到的内生菌,纯化到无杂菌后,4 ℃保存。
1.4 内生菌抑菌活性筛选采用姜云等[2]的方法对抑菌活性进行初筛。在姜云等[2]复筛方法的基础上改进,发酵和菌液收集不变,使用滤纸片法对菌液抑菌活性进行复筛。
1.5 内生菌的鉴定内生细菌基因组的提取利用Bio Teke cat#DP2001细菌基因组DNA提取试剂盒(离心柱型)进行,用通用引物27f(5’-AGAGTTTGATCC-TGGCTCAG-3’)和1492r(5’-TACGGCTACCTTG-TTACGACTT-3’)扩增细菌16 S RNA。扩增体系为50 μL,包括2×PCR Mix 25 μL,ddH2O 15 μL,DNA 模板 5 μL,27f 2.5 μL,1492r 2.5 μL。PCR扩增程序为94 ℃变性5 min,94 ℃变性40 s,53 ℃复性60 s,72 ℃延伸90 s,35个循环,72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测,并将其产物送上海生物工程有限公司进行测序。
内生真菌基因组提取利用Bio Teke cat#DP2031真菌基因组DNA提取试剂盒(离心柱型)进行。用通用引物ITS1(5’-TCCGTAGGTGAACCTGCG-G-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)扩增内生真菌ITS序列。扩增体系为50 μL,包括2×PCR Mix 25 μL,ddH2O 15 μL,DNA模板5 μL,ITS1 2.5 μL,ITS4 2.5 μL。PCR扩增程序为95 ℃变性5 min,94 ℃变性45 s,52 ℃复性45 s,72 ℃延伸90 s,35个循环,72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测,并将其产物送上海生物工程有限公司进行测序。
扩增产物测序结果在GenBank中进行BLAST分析,然后用 MEGA6.0进行序列相似性分析,以Neighbor-joining方法构建系统发育树,用Bootstrap(1 000次重复)进行检验。
1.6 数据分析用Excel 2003对统计数据进行计算和制作图表。
2 结果与分析 2.1 人参内生菌的分离纯化内生菌的种类和数量会受到植物种类、生长阶段、生长环境的影响[4],对不同采样地的人参进行内生菌的分离纯化,共分离得到133株内生菌(表 2),其中根中70株,茎中60株,叶中46株。结果显示采样地的不同、不同年生人参和分离部位的不同影响植株内生菌种类和数量。相同采样地不同年生人参样品中得到的内生菌数量随人参年生的增加而呈增多的趋势。
| 表 2 不同采集地和部位的内生菌分离情况 Table 2 Isolation situation of endophytes in different collection places and different plant parts |
初筛结果显示,对病原菌具有抑菌活性的菌株有88株(表 3),其中,对人参立枯病菌有抑菌作用的内生菌最多,为52株,占有抑菌作用内生菌总数的59.09%,其次是对人参根腐病菌有抑菌作用的为45株,占有抑菌作用内生菌总数的51.14%,对人参菌核病菌有抑菌作用的最少,为15株,占有抑菌作用内生菌总数的17.05%。
| 表 3 不同部位来源有抑菌作用的内生菌数量及比例 Table 3 Quantity and proportion of endophytes with antagonistic effect on phytopathogen in different parts |
对病原菌有抑制作用的内生菌在人参各部位的分布上有明显差异(表 3),根中有抑菌作用的内生菌最多,占有抑菌作用内生菌总数的51.13%;茎中次之,占43.18%;叶中最少占36.36%。对病原菌有抑制作用的内生菌在相同年限不同产地分布上也有明显差异(表 4),靖宇人参内生菌有抑菌作用的最多,占18.18%;集安和长春次之,占17.05%;长白最少,占9.09%;对病原菌有抑制作用的内生菌在相同产地不同生长年限人参分布上也有明显差异(表 4),集安15年人参内生菌有抑菌作用的最多,占25.00%;集安9年次之,占18.18%;集安5年最少,占17.05%。
| 表 4 不同产地来源具有抑菌作用内生菌的数量及比例 Table 4 Quantity and proportion of endophytes with antagonistic effect on phytopathogen in different areas |
通过对初筛得到的内生细菌和真菌进行发酵液抑菌活性复筛后得到4株拮抗效果较好的内生菌株(表 5),其中内生菌B16对锈腐病菌的抑菌活性较其他处理最强,抑菌圈直径为39 mm,内生菌B69对灰霉病菌和立枯病菌的抑菌活性较其他处理强,抑菌圈直径分别为41 mm和31 mm,内生菌F32对菌核病、疫病和根腐病菌的抑菌活性较其他处理强,抑菌圈直径分别为35、38、36 mm,内生菌B25对黑斑病菌的抑菌活性较其他处理强,抑菌圈直径为43 mm。对6种以上病原菌有拮抗作用的内生菌有7株,其中B16和B66对7种供试病原菌都有拮抗作用,说明人参中含有广谱拮抗作用的内生菌。对病原菌拮抗抑菌圈>30 mm的内生菌有8株,说明人参内生菌对其病原菌的抑制有一定的专一性。
| 表 5 拮抗内生菌的筛选情况 Table 5 Screening situation of endophytes with antagonistic effect |
如表 5所示,内生菌B16、B25和B69的发酵液与菌体的抑菌活性无明显差异。内生菌F32发酵液相对于菌体来说,对菌核病菌、根腐病菌和疫病菌的抑制作用消失,但是对立枯病菌、锈腐病菌和黑斑病菌的抑制效果显著增强。其余内生菌发酵液与菌体相比,对病原菌的抑菌情况变化总体表现为对可抑制的病原菌种类减少,但是其抑菌活性增强。
2.4 菌株16S rDNA序列扩增及系统发育学分析对株菌B16、B25和B69进行16S rDNA基因测序,测序结果在GenBank基因库中进行同源性搜索,结果表明,菌株B16、B25和B69分别与甲基营养型芽孢杆菌Bacillus methylotrophicus(KC790320)、解淀粉芽胞杆菌Bacillus amyloliquefaciens(CP006890)
和死谷芽孢杆菌Bacillus vallismortis(JF496376)的序列相似率最大,达98%以上,构建系统发育树后,位于同一系统发育分支上。综合同源性比对结果并结合其培养特征,株菌B16、B25和B69菌株分别属于甲基营养型芽孢杆菌、解淀粉芽胞杆菌和死谷芽孢杆菌。
对株菌F32进行ITS基因测序,测序结果在GenBank基因库中进行同源性搜索,结果表明,菌株F32与齿孢青霉Penicillium daleae(DQ132832)的序列相似率最大,达98%,构建系统发育树(图 1)后,二者位于同一系统发育分支上。综合同源性比对结果和F32与齿孢青霉在发育系统中的位置,并结合其培养特征,该菌株应属于齿孢青霉。
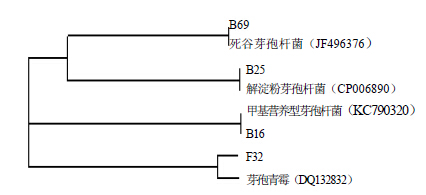 | 图 1 拮抗菌株序列系统发育树Fig.1 Phylogenetic tree of sequence of antagonistic strains |
本研究在不同产地、不同部位的人参样本中共分离到内生菌133株,样品的来源较广、数量较多,表面消毒彻底,保证了分离到的内生菌具有多样性和代表性,为人参内生菌资源进行进一步的开发奠定了良好的基础。
本研究通过混菌法对人参内生菌初筛后发现,不同采集地、同采集地不同部位人参体内拮抗菌的量存在一定的差异,这与金岩等[5]在五味子内生菌研究中得出的结论一致。而且不同菌株对于供试的7种人参主要病害病原菌均有不同的抑制作用,其中对根腐病菌和立枯病菌菌具有抑菌活性的菌株较多,灰霉病菌、黑斑病菌和疫病菌次之,而对锈腐病菌和菌核病菌有抑菌作用的菌株最少,说明在拮抗菌株间存在着靶标菌选择性,对于不同种类的病原菌抗菌谱存在差异,这与刘学周等[3]在人参内生细菌研究中得出的结论一致。
芽孢杆菌属菌株是最普遍被报道的植物生长促生根际细菌,芽孢杆菌属的一些种能够产生次生代谢产物(如多肽类物质),对植物病原菌(细菌、真菌、线虫等)具有较强的抑菌活性[6, 7],可用于生物防治。
甲基营养型芽孢杆菌是Madhaiyan等[8]自水稻根系土壤中分离得到的芽孢杆菌属新成员,有促进植物生长的作用。近年研究表明,甲基营养杆菌可以用来工业化生产各种辅酶(辅酶Q10)、维生素(VB12)和聚-β-羟基丙酮等[9],甲基营养型芽孢杆菌还可以用于防腐剂[10],在食品保鲜中广泛应用。向军等[9]从甲基营养型芽孢杆菌中分离得到3个bacillomycin Lc抗真菌脂肽类化合物。有研究发现[11],甲基营养型芽孢杆菌发酵液对番茄灰霉病菌、稻瘟病菌、辣椒疫霉病菌、苹果轮纹病菌、小麦根腐病菌、棉花枯萎病菌等多种病原真菌均有较强的抑菌活性。本研究筛选出的B16属于甲基营养型芽孢杆菌,对7种人参病原菌均有较强抗性,可能是产生了脂肽类化合物,因而抗性较好而且广谱,为该菌种及其代谢产物在农业上的应用奠定一定的基础。
解淀粉芽孢杆菌是一种广泛存在与土壤和植物中的芽孢杆菌,在其自身的生长过程中可以产生一系列的代谢产物,这些代谢产物使得解淀粉芽孢杆菌能够具有广泛地抑制真菌和细菌的活性[12],Wu等[13]发现解淀粉芽孢杆菌能够有效地降低英科作物种子和叶片的病害。孙力军[14]从解淀粉芽孢杆菌中发现一系列抗菌脂肽包括表面活性素(surfcatin)、伊枯草菌素(iturin)和芬荠素(fengycin)等几大类具有抗细菌、真菌、病毒和支原体的功能以及良好的表面活性作用,同时他还发现对苹果青霉病有较好地抑制作用。本研究筛选出的B25属于解淀粉芽孢杆菌,对除人参菌核病菌和人参疫病菌外的5中供试病原菌都有抑菌活性,对人参黑斑病菌的抑制效果最显著。这可能是由于在生长过程中分泌的一些次生代谢产物具有广泛的抑菌活性,其中某一种针对人参黑斑病菌的抑菌脂肽大量产生,从而对人参黑斑病菌的抑制作用最显著,但还需要进一步验证。
死谷芽孢杆菌于1996年第1次被报道,是枯草芽孢杆菌的近亲[15],张慧等[16]从棉花根际分离了一株能有效拮抗棉花黄萎病病原菌的菌株。林英等[17]从醋糟中分离得到一株对立枯丝核菌具有明显拮抗作用的死谷芽孢杆菌,且具有广谱的抑菌效果,对西瓜枯萎病小麦赤霉病等病原菌都有明显的拮抗效果。还有研究者指出,死谷芽孢杆菌胞外分泌物属于脂肽类,能有效抑制木霉孢子萌发和菌丝生长[18]。本研究筛选出的B69属于死谷芽孢杆菌,对除疫病菌外其他6种供试病原菌都有明显拮抗作用,对人参灰霉病菌和立枯病菌的拮抗效果最为显著,这可能是由于死谷芽孢杆菌分泌的脂肽类物质抑制人参灰霉病菌和立枯病菌孢子萌发和菌丝生长,但还需要进一步验证。
病菌受到抑制后有明显的抑菌区域,可能是由于内生菌的生长速度快,占据营养空间,对病原真菌形成营养上的竞争,使病原真菌因缺乏营养而萎缩[19];也可能是在培养的过程中内生菌产生的水解酶类(细胞壁水解酶、几丁质酶、蛋白酶等)降解了病原真菌细胞壁,或产生了其他致病因子如毒素等,发挥作用的结果[20]。本研究筛选出的F32属于齿孢青霉,对病原真菌将初筛和复筛结果进行比较后发现,内生菌F32发酵液相对于菌体来说,对锈腐病菌、黑斑病菌、疫病菌和立枯病菌的抑制作用消失,但其对原本具有抑制作用的菌核病菌、疫病病菌和根腐病菌的抑菌活性显著增强,这可能是因为F32菌体对前4种病菌的抑制作用主要是对营养成分、空间等的竞争造成的,而对后3种病菌的抑制作用主要是其次生代谢产物对病原菌的毒性造成的,在对F32发酵后,无菌发酵液中相关次生代谢产物的量增加了,进而对菌核病菌、疫病病菌和根腐病菌的抑菌活性显著增强。
本研究表明人参内含有大量的内生菌,并有拮抗病原菌活性高的菌株存在,因此人参内生菌可以成为人参病害生防菌的新来源。对于筛选出的拮抗菌,今后将进一步测定其在人参内的定植情况以及对人参生长的影响、田间的防病效果,为人参病害生防内生菌资源的开发提供科学依据。
| [1] | 田义新. 药用植物栽培学 [M]. 第3版. 北京: 中国农业出版社, 2011. |
| [2] | 姜 云, 尹 望, 陈长卿, 等. 人参内生菌的分离及拮抗菌株的筛选 [J]. 吉林农业大学学报, 2012, 34(5): 517-521. |
| [3] | 刘学周, 李绍宾, 赵智灵, 等. 西洋参内生菌株的分离及拮抗活性菌株的筛选和鉴定 [J]. 中草药, 2014, 45(22): 3332-3336. |
| [4] | 刘 伟, 宋 双, 沈小英, 等. 番茄灰霉病拮抗芽孢杆菌LW-6-1的筛选鉴定及抑菌活性研究 [J]. 西北农林科技大学学报: 自然科学版, 2013, 41(11): 73-79. |
| [5] | 金 岩, 孙晶波, 高 洁. 五味子中内生拮抗活性细菌的分离与筛选 [J]. 中草药, 2014, 45(7): 996-1001. |
| [6] | 石晶盈, 陈维信, 刘爱媛, 等. 植物内生菌及其防治植物病害的研究进展 [J]. 生态学报, 2006, 26(7): 2395-2401. |
| [7] | Lim H S, Kim Y S, Kim S D. Pseudomonas stutzeri YPL-1 genetic transformation and antifungal mechanism against Fusarium solani an agent of plant root rot [J]. Appl Environ Micro, 1991, 57(2): 510-516. |
| [8] | Madhaiyan M, Poonguzhali S, Kwon S W, et al. Bacillus methylotrophicus sp. nov, a methanol-utilizing, plant-growth-promoting bacterium isolated from rice rhizosphere soil [J]. Int J Syst Evol Microbiol, 2010, 60(10): 2490-2495. |
| [9] | 向 军, 张金虎, 柴海云, 等. 甲基营养型芽孢杆菌产氨肽酶的发酵优化 [J]. 中国酿造, 2012, 31(5): 45-50. |
| [10] | 吴燕燕, 张 岩, 李来好, 等. 甲基营养型芽孢杆菌抗菌肽对罗非鱼片保鲜效果的研究 [J]. 食品工业科技, 2013, 34(2): 315-318. |
| [11] | 向 军. 产氨肽酶甲基营养型芽孢杆菌的鉴定、发酵优化及酶学性质研究 [D]. 广州: 华南理工大学, 2012. |
| [12] | 车晓曦, 李校堃. 解淀粉芽孢杆菌 (Bacillus amyloliquefaciens) 的研究进展 [J]. 北京农业, 2012 (5): 7-10. |
| [13] | Wu W, Wu H C, Li Y L. Potential of Bacillus amyloliquefaciens for control of Alternaria cosmosa and A. patula of Cosmos sulfurous (Yellow Cosmos) and Tagetes patula (French Marigold) [J]. J Phytopathol, 2007(12): 670-675. |
| [14] | 孙力军. 植物内生菌Bacillus amyloliquefaciens ES-2的分离筛选及其抗菌物质的研究 [D]. 南京: 南京农业大学, 2006. |
| [15] | Roberts M S, Nakamura L K, Cohan F M. Bacillus vallismortissp. nov, a close relative of Bacillus subtilis, isolated from soil in Death Valley, California [J]. Int J Syst Bacteriol, 1996, 46: 470-475. |
| [16] | 张 慧, 杨兴明, 冉 炜, 等. 土传棉花黄萎病拮抗菌的筛选及其生物效应 [J]. 土壤学报, 2008, 45(6): 1095-1100. |
| [17] | 林 英, 司春灿, 赵青松, 等. 一株死谷芽孢杆菌的分离#鉴定及抗病促生效果初探 [J]. 北方园艺, 2014(13): 88-92. |
| [18] | 郝 捷, 李 杨, 陈 飞, 等. 死谷芽孢杆菌对香菇栽培料中木霉菌的抑制研究 [J]. 微生物学通报, 2013, 40(2): 228-235. |
| [19] | Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects [J]. Appl Environ Microbiol, 2005, 71(9): 4951-4959. |
| [20] | Velazhahan R, Samiyappan R. Relationship between antagonistic activities of Pseudomonas fluorescens isolates against Rhizoctonia solani and their production of lyric enzymes [J]. J Plant Dis Prot, 1999, 106(3): 244-250. |
 2015, Vol. 46
2015, Vol. 46


