2. 北京师范大学生命科学学院, 北京 100875
2. College of Life Science, Beijing Normal University, Beijing 100875, China
鸢尾科(Iridaceae)鸢尾属Iris L. 约有300个种,分布遍及整个北温带地区,我国约有60个种,主要分布于西南、西北和东北[1]。鸢尾属植物在世界上许多国家被用作传统民间药材,治疗癌症、炎症、细菌和病毒感染等多种疾病[2]。从鸢尾属植物中分离得到的天然产物可分为4类:黄酮类、三萜类、苯醌类和二苯乙烯类化合物[3],其中以黄酮类最为重要。近年来,关于该属植物中的黄酮类成分的化学结构和生物活性的研究取得了重要进展,本课题组也做了一些研究工作[3, 4, 5, 6]。
2009—2013年,有118种黄酮类化合物,包括18种全新的天然产物从鸢尾属的19种植物中分离得到,其中部分化合物显示出抗癌、抗突变、抗炎抗过敏、抗神经变性以及对肝脏和心血管损伤的保护等良好的活性,具有一定的开发潜能。现对其化学结构和生物活性进行综述。
1 鸢尾属植物中黄酮类成分的结构和类型2009—2013年,从鸢尾属植物中分离得到的常规黄酮类化合物根据其结构特点,可以分为5类:异黄酮及其糖苷、黄酮及其糖苷、黄酮醇及其糖苷、二氢黄酮、二氢黄酮醇及其糖苷。它们有各自的结构母核(图 1),均连有O-取代(O-substitution)官能团,如羟基、甲氧基和亚甲二氧基;且连接位置有一定规律,A环上主要的取代位置是C-5, 7位或C-5, 6, 7位。值得注意的是,亚甲二氧基仅连接在A环的C-6, 7位上,这种结构在鸢尾科其他属的植物中较为少见[3]。B环上最常见的取代位置是C-4′位或C-3′, 4′,此外,取代基还出现在C-2′和C-2′, 3′位或C-3′, 4′, 5′位。另外,5年内分离得到的黄酮类化合物形成的糖苷中,多为7-O-、4′-O-、6-C-糖苷,而3-O-、5-O-及8-C-糖苷相对少见。
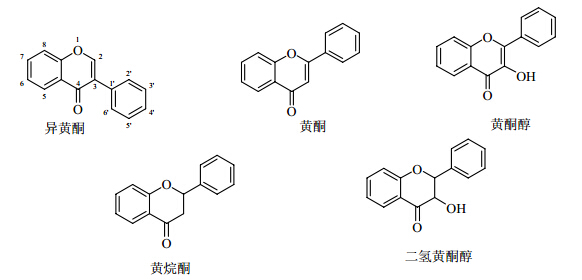 | 图 1 鸢尾属植物中常规黄酮类的母核结构 Fig.1 Nucleus of regular flavonoids in plants of Iris L. |
5年来文献报道修饰鸢尾属植物中的黄酮有3类:香豆酮并色酮类(coumaronochromones)、盾木素类似物(peltogynoids)和环状黄烷(cycloflavan)。它们分别是通过C-2、C-3、C-4位的取代基将B环和C环通过一个有氧环连接起来(图 2)。
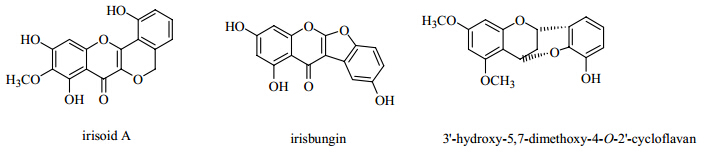 | 图 2 鸢尾属植物中有代表性的3种修饰性黄酮的母核结构 Fig.2 Nucleus of three modified flavonoids in plants of Iris L. |
黄酮糖苷是鸢尾属植物主要的黄酮类成分。黄酮、黄酮醇及其糖苷、二氢黄酮、二氢黄酮醇及其糖苷的数量较少,而修饰黄酮是其中的微量成分。
1.1 异黄酮及其糖苷2009—2013年,有36种异黄酮和21种异黄酮糖苷从鸢尾属植物中分离得到。其中包括3种新的异黄酮和3种新的异黄酮糖苷。
以上化合物中,A环C-8位被取代的结构仅在游离的异黄酮中存在但比较少见,糖苷中则不存在。从克什米尔鸢尾I. kashmiriana Baker分离得到的isonigricin(24)是一个新的化合物[7],也是唯一具有8-OCH3结构的异黄酮。其余几种均为8-OH取代,包括2个新的天然产物6,8,4′-trihydroxy-7-methoxy- isoflavone(25)、irigenin(34),以及2个已知化合物5,8,4′-trihydroxy-7-methoxyisoflavone(20)、5,7,8, 4′-tetrahydroxy-6-methoxyisoflavone(26)[8]。值得注意的是,它们均是从野鸢尾I. dichotoma Pall. 根状茎中分离得到。
从鸢尾属植物中分离得到的异黄酮糖苷,包括13个单糖苷和7个双糖苷。其苷元与糖基均通过氧苷键相连接,且连接位置大都是在C-7位或者C-4′位,仅有从野鸢尾中分离得到的5,4′,5′-trihydroxy- 7,3′-dimethoxyisoflavone-5′-O-β-D-Glcp(56)的糖基连在C-5′位[9]。上述糖苷中,iriflogenin-4′-O-β-D- Glcp (1→6)-β-D-Glcp(50)[10]、iristectorigenin B-4′-O-β-D-Glcp(53)[6]、iridin S(55)[10]是3个全新的化合物,分别从德国鸢尾I. germanica L.、蓝花喜盐鸢尾I. halophila Pall. var. sogdiana (Bunge) Grubov.及鸢尾I. tectorum Maxim. 中分离得到。
1.2 黄酮及其糖苷在鸢尾属植物中,黄酮的数量远小于其糖苷。2009—2013年,仅有7种已知的黄酮被报道,而糖苷的数量为26个(9个单糖苷、15个双糖苷和2个三糖苷),其中碳苷占大多数,糖基多连在C-6位,而氧苷的糖基多连在C-4′位。
黄酮糖苷中5个全新化合物都是碳苷的O-乙酰基衍生物,包括3个双糖苷和2个三糖苷;双糖苷中糖基为C-3位或C-4位乙酰化的鼠李糖和葡萄糖形成的糖链,通过C-苷键连在A环C-6位;分别为从荷兰鸢尾I. hollandica Hort. 花中分离得到的5,4′-dihydroxy-7-methoxyflavone-6-C-(4-O-acetyl-α-L-Rhap)-(1→ 2)-β-D-Glcp(66)和apigenin-6-C-(4-O- acetyl-α-L-Rhap)- (1→2)-β-D-Glcp(73)[11]以及从鸢尾叶中分离得到的5-hydroxy-4′,7-dimethoxyflavone- 6-C-(3-O-acetyl-α-L-Rhap)-(1→2)-β-D-Glcp(79)[12]。三糖苷与双糖苷相比,多出一个由O-苷键连接在B环C-4′位的葡萄糖基,分别为从荷兰鸢尾花中分离得到的apigenin-4′-O-β-D-Glcp-6-C-(4-O-acetyl-α-L- Rhap)-(1→2)-β-D-Glcp(74)和5,4′-dihydroxy-7-methoxy- flavone-4′-O-β-D-Glcp-6-C-(4-O-acetyl-α-L-Rhap)-(1→2)-β-D-Glcp(67)[11]。
1.3 黄酮醇及其糖苷2009—2013年,鸢尾属中报道了4种黄酮醇和3种黄酮醇糖苷,其中仅有从野鸢尾I. dichotoma Pall. 根状茎中分离得到的1种黄酮醇糖苷irisdichotin A(96)为新化合物,其糖基通过5-O-苷键连接,这在鸢尾属的黄酮类成分中是较为少见的。
1.4 二氢黄酮、二氢黄酮醇及其苷2009—2013年,共有10种二氢黄酮和6种二氢黄酮醇类化合物(4个二氢黄酮醇和2个二氢黄酮醇糖苷)被从鸢尾属中分离得到。其中,仅有2个二氢黄酮5,7,4′-trihydroxy-8,3′-dimethoxy- flavanone(106)、8-methoxyeriodictyol(107)的A环C-8位被取代,且它们均是从相爪鸢尾I. unguicularis Foir. 根状茎中分离得到[13]。另外,2个全新的二氢黄酮醇糖苷irisdichotin B(112)和irisdichotin C(113)从野鸢尾根状茎中被分离得到,它们分别为5-O-和7-O-单糖苷,通过CD光谱和1H-NMR得到的耦合常数确定2个苷元C-2和C-3的绝对构型均为R型[8]。
1.5 修饰黄酮鸢尾属中的修饰黄酮类数量很少,且多为全新的化合物。2009—2013年,分离得到的此类化合物包括2个香豆酮并色酮类化合物(1个新化合物,irisbungin,117[14]),1个盾木素类似物和2个环状黄烷(2个新化合物)。
香豆酮并色酮类化合物与异黄酮类的区别是C-2和C-2′通过“氧桥”(C-O-C)相连,形成一个新的五元环结构(D环)。大多数此类化合物是从豆科中分离得到,鸢尾属中报道的极少,且仅存在于附属物亚属-无附属物组的几个种内,提示香豆酮并色酮类可能是该属的化学分类学标记。
本课题组报道了从细叶鸢尾I. tenuifoliaPall. 根状茎中分离到的2个全新的环状黄烷3′-hydroxy- 5,7-dimethoxy-4-O-2′-cycloflavan(114)和3′- hydroxy- 5-methoxy-6,7-methylenedioxy-4-O-2′-cycloflavan(115)[4]。它们结构中C-4与C-2′间C-O-C的连接是通过HMBC相关和X-单晶衍射共同证实的。这种新颖的母核结构丰富了鸢尾属中修饰黄酮的类型。
以上所述的各类全新化合物的结构见图 3~6。近5年鸢尾属植物中分离得到的黄酮类成分见表 1。
 | 图 3 鸢尾属植物中分离得到的新的异黄酮及其糖苷的结构Fig.3 Structures of new isoflavones and their glycosides isolated from plants of Iris L. |
 | 图 4 鸢尾属植物中分离得到的新的黄酮糖苷的结构Fig.4 Structures of new flavone glycosides isolated from plants of Iris L. |
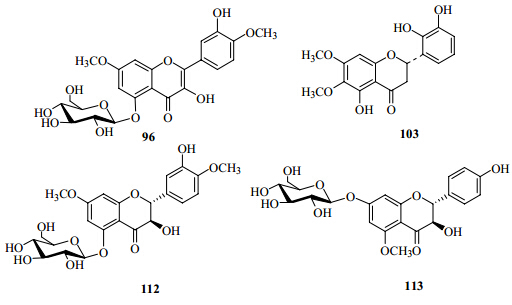 | 图 5 鸢尾属植物中分离得到的新的黄酮醇糖苷、二氢黄酮以及二氢黄酮醇糖苷的结构 Fig.5 Structures of new flavonol glycoside, flavonone, and flavanonol glycosides isolated from plants of Iris L. |
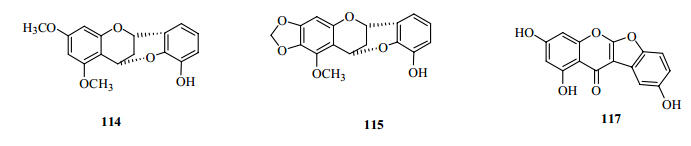 | 图 6 鸢尾属植物中分离得到的新的修饰黄酮类成分的结构Fig.6 Structures of new modified flavonoids isolated from plants of Iris L. |
| 表 1 2009—2013年鸢尾属植物中报道的黄酮类成分 Table 1 Flavonoids from plants of Iris L. reported during 2009—2013 |
克什米尔鸢尾甲醇提取物中富含irigenin(34)和tectorigenin(13),提取物能够抑制2种上皮细胞人肺腺癌细胞系A549和人克隆结肠癌细胞系Caco-2的生长,IC50值分别为128.7 μg/mL和237.76 μg/mL,在50~400 μg/mL的质量浓度内呈现剂量依赖效应。但对于大鼠非赘生纤维原细胞系NIH-3T3的抑制作用不明显。对于3种细胞系抑制活性的差别可能是由于这种抑制作用是上皮性肿瘤特异的[28]。
Tectorigenin(13)和tectoridin(45)对人胃癌细胞株SGC7901有一定程度的抑制作用,IC50值分别为79.8 μg/mL和176.2 μg/mL[29]。此外,在1.0~8.0 μg/mL质量浓度内,tectorigenin对人肝癌细胞SMMC-7721的生长抑制作用量效关系明显,加药培养24、48 h后的IC50值分别为3.71、8.62 μg/mL[30]。
5-hydroxy-4′,7-dimethoxyflavone-6-C-(3-O-acetyl-α-L-Rhap)-(1→2)-β-D-Glcp(79)和swertisin(65)对人肺腺癌细胞A549表现出中等活性的细胞毒性,IC50值分别为63.9、47.3 μmol/L。其余化合物的细胞毒活性较弱,IC50值大于100 μmol/L[12]。
Hispidulin(59)对人肺腺癌细胞A549的IC50值为15.51 μmol/L,对人乳腺癌细胞MCF-7的IC50值为7.65 μmol/L,对人宫颈癌细胞HeLa的IC50值为10.38 μmol/L。而iristectorigenin A(29)对人乳腺癌细胞MCF-7的IC50值为36.04 μmol/L[31]。
富含异黄酮类化合物tectorigenin(13)、irigenin(34)、tectoridin(45)和iridin(57)的植物提取物,能够抑制鼠伤寒沙门氏菌Salmonella typhimurium TA98和TA100通过化学方法诱发的突变。该实验使用了2种诱变剂,直接诱变剂硝基喹啉(NQNO)和需通过代谢激活的间接诱变剂2-氨基芴(2-AF)。结果表明,该植物提取物对于间接诱变的抑制作用十分明显,TA98菌株的突变几乎完全被抑制,对TA100菌株的突变抑制率在80%~100%。而对于直接诱变的抑制活性较低,对TA98和TA100菌株突变的抑制率均接近50%,且仅对TA100菌株表现出剂量依赖效应。抑制率相差较大最可能的原因是植物提取物干扰了2-AF的活化过程,通过抑制细胞色素酶CYP1A抑制了2-AF被激活,从而最大限度地抑制了突变的发生[32]。
2.2 抗炎、抗过敏和抗神经变性作用从假佳美鸢尾中分离得到的一些黄酮类化合物具有抗炎活性,能够抑制小鼠巨噬细胞系RAW264.7中NO的产生。其中irisolidone(10)和5,4′-dihydroxy-6,7-dimethoxyisoflavone-4′-O-β-D-Glcp (1→6)-β-D-Glcp(39)的活性最强,IC50值分别为23.6、29.4 μmol/L[19]。
Tectorigenin(13)和genistein(1)能够抑制人肥大细胞中IgE受体(FcεRI)的产生,进而阻断过敏反应的发生。进一步的机制研究表明,tectorigenin的抑制活性是通过抑制IgE受体四聚体或三聚体中γ链的表达实现的,这一作用机制是全新且具有启迪性的[33]。
此外,isoorientin(83)和isovitexin(69)对乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)的抑制活性均较强,对AChE的IC50值分别为26.8、36.4 μmol/L;对BChE的IC50值分别为31.5、54.8 μmol/L[19]。变白鸢尾I. albicans Lange的开花地上部分的氯仿提取物富含黄酮类成分,具有显著的抑制BChE活性,抑制率为(78.44±0.51)%[34]。
3′-hydroxy-5,7-dimethoxy-4-O-2′-cycloflavan(114)和5,2′,3′-trihydroxy-6,7-methylenedioxyflavanone(104)具有阻止Aβ蛋白凝集且促进神经细胞增殖的活性。Crytotanshinone作为阳性对照,完全聚集的Aβ作为阴性对照,30 min孵育后,Aβ蛋白的凝集率分别下降为19.8%和61.7%,相同浓度下,阳性对照的浓度下降为43.7%。此外,通过ATP监测系统研究了2个化合物的促神经细胞增殖活性。促生长因子B27(2%)作为阳性对照,结果提示化合物104具有比其更显著的促神经干细胞增殖活性,而化合物114的这一活性不明显。以上结果提示了化合物104和114具有治疗老年痴呆症的潜在价值[4]。
2.3 对肝脏及心血管损伤的保护作用Tectorigenin(13)的干预能有效改善大鼠肝脏部分缺血再灌注损伤引起的肝功能和肝脏病理损害。相关的机制研究发现:其能减少大鼠肝脏缺血再灌注后氧自由基的产生,减轻脂质过氧化引发的组织损伤和促进内源性抗氧化酶活性增强。同时减少活性氮的产生。另外,tectorigenin具有减轻中性粒细胞和炎症因子的活化、增强抗炎因子水平的作用,能够减轻肝脏组织炎症反应[35]。王金凤等[36]研究发现tectorigenin还对急性心肌梗死小鼠心肌有明显的保护作用,其作用机制与其抗氧化及上调内皮血管生长因子A(VEGFa)和内皮型NO合成酶(eNOS)mRNA的表达,扩张血管和促进血管再生相关。而且,鸢尾苷元能够降低β-肾上腺素受体激酶(β-ARK1)的表达,对急性心肌梗死小鼠的心功能有改善作用。
此外,tectorigenin对氧化低密度脂蛋白(ox-LDL)所致的血管内皮细胞(VEC)损伤也具有明显的保护作用,并显著抑制ox-LDL诱导血管内皮细胞单核细胞趋化蛋白-1(MCP-1)和细胞间黏附分子-1(ICAM-1)mRNA的过度表达,从而起到抗动脉粥样硬化的作用[37]。
2.4 糖尿病治疗和免疫调节作用一些黄酮类化合物对糖尿病的治疗有一定意义。Moshihuzzman等[13]对22个从天山鸢尾和香爪鸢尾中分离到的化合物的抗葡萄糖苷酶活性与抗糖基化活性进行了筛选。以阿卡波糖为阳性对照,综合考虑抑制率与IC50值,发现从香爪鸢尾中分离得到的kaempferol(93)和8-methoxyeriodictyol(107)是其中最好的α-葡糖苷酶抑制剂,其抑制率分别为80.9%和100%,IC50值分别为(0.047±0.003)mmol/L和(0.097±0.003)mmol/L。这种抑制作用能够降低葡萄糖吸收进入血液的速度,可用于糖尿病的治疗。另外,天山鸢尾中的化学成分5,2′-dihydroxy-6,7-methylene dioxy-flavanone(99)和irisoid A(116)以及香爪鸢尾中的化学成分tectorigenin(13)和hispidulin(59),被证明具有潜在的抑制蛋白糖基化活性,抑制率分别为70.41%、67.35%、64.11%和60.23%,略低于阳性对照芦丁的抑制率82.25%。以上化合物对蛋白质糖基化的抑制将减少晚期糖基化终末产物(AGEs)的形成,有可能被应用于糖尿病晚期并发症的治疗。
此外,Nighat等[7]报道了黄酮类化合物的免疫调节活性及其与化学结构的关系。每次ig 0.025~0.8 mg/kg的剂量,isonigricin(24)和isoirisolidone(14)对Balb/c小鼠体内T淋巴细胞及其细胞因子 [白细胞介素-2(IL-2)、IL-4、γ干扰素(IFN-γ)] 的免疫调节作用呈现剂量依赖效应。其中isonigricin对T细胞及其细胞因子具有免疫抑制作用,而isoirisolidone具有免疫激活作用。二者甲基化后,对IL-2、IL-4具有激活作用,对T细胞和IFN-γ具有抑制作用。这些活性与异黄酮母核上取代基的位置和性质有关。实验结果显示:isonigricin的免疫抑制活性与B环上的羟基有关,isoirisolidone的免疫激活活性与A环上的羟基有关。二者的甲基化产物对IL-2、IL-4的激活作用与B环上羟基的甲基化相关,对T细胞和IFN-γ的抑制作用与A环上羟基的甲基化相关。
2.5 抗氧化和抗细胞凋亡作用克什米尔鸢尾甲醇提取物中富含irigenin(34)和tectorigenin(13),提取物具有显著的自由基清除活性,DPPH实验中,在50~400 μg/mL内呈现剂量依赖效应,在400 μg/mL时的清除率达到约70%[28]。此外,富含异黄酮类化合物tectorigenin(13)、irigenin(34)、tectoridin(45)和iridin(57)的植物提取物,被证实具有抗氧化活性,能够清除自由基,还原过渡金属离子和保护多不饱和脂肪酸不被过氧化[32]。
Chien等[38]以神经生长因子(NGF)诱导后的大鼠肾上腺嗜铬细胞瘤细胞PC12作为模型,结果提示,genistein(1)会影响6-羟多巴胺6-OHDA处理过的细胞中活性氧的产生。另外,它能够抑制caspase-8的活性且部分抑制caspase-3的活性。caspase-8作用于仅含BH3结构域的BID,使其裂解并移位至线粒体,从而直接或间接地(诱导Bax或者Bak形成寡聚体)促进细胞凋亡。caspase-3是介导DNA片段化和执行凋亡过程的关键酶。Genistein(1)对二者活性的抑制,使其具有阻抑细胞凋亡的作用。
2.6 抑制肝、肺纤维化的作用作为阻止肝纤维化进程的途径之一,tectorigenin(13)能够抑制大鼠肝星形细胞(HSC-T6)的增殖并诱导其凋亡,呈现剂量依赖效应和时间依赖效应。当质量浓度为100 μg/mL时,tectorigenin能够显著抑制HSC-T6细胞的活性,诱发染色质浓缩和核仁解体。处理48 h后,细胞生长和凋亡的比例分别为(46.30±2.37)%(P=0.004)和(50.67±3.24)%(P=0.003)。凋亡分子机制研究表明,tectorigenin提高了活性氧和Ca2+在细胞质中的浓度,二者浓度的增加会诱发线粒体膜电位的变化,从而导致细胞色素C从线粒体流入细胞质,进而激活caspase-9的前体,随后caspase-9激活通路下游的caspase-3,最终触发了HSC-T6细胞的凋亡[39]。
相类似的,tectorigenin还能够抑制特异性肺纤维化模型小鼠肺纤维母细胞的扩增并增强其中miR-338表达的活性。当其浓度为500 μmol/L时,在体外,源自模型小鼠的肺纤维母细胞的扩增被显著抑制;源自对照小鼠的肺纤维母细胞未观察到明显的受抑制现象。然而,tectorigenin对模型和对照小鼠的肺纤维母细胞的凋亡与细胞周期均没有影响。此外,miR-338表达的增强可能通过下调溶血磷脂酸受体1(LPA1)抑制小鼠特发性肺纤维化[40]。
3 结语和展望鸢尾属植物种类多、分布广、资源丰富,其化学成分主要包括黄酮类、三萜类、苯醌类和二苯乙烯类,其中以黄酮类最为重要。近年来,对该属植物的黄酮类成分及其生物活性的研究方兴未艾,全新的化合物和引人注目的生物活性不断被发现。本文总结和评述了它们的化学结构特征和抗癌、抗神经变性、保护肝脏和心血管损伤以及治疗糖尿病等重要活性及其作用机制。对这些活性成分的深入研究,可为开发结构新颖、活性显著、毒副作用小的药物提供依据,同时也为鸢尾属植物的进一步研究和开发提供参考。
| [1] | 中国植物志编委会. 中国植物志 [M]. 北京: 科学出版社, 1985. |
| [2] | Hanawa F, Tahara S, Mizutani J. Isoflavonoids produced by Iris pseudacorus leaves treated with cupric chloride [J]. Phytochemistry, 1991, 30(1): 157-163. |
| [3] | Wang H, Cui Y M, Zhao C Q. Flavonoids of the genus Iris (Iridaceae) [J]. Mini Rev Med Chem, 2010, 10(7): 643-661. |
| [4] | Cui Y M, Wang H, Zhao C Q. Flavans from Iris tenuifolia and their effects on beta-amyloid aggregation and neural stem cells proliferation in vitro [J]. Bioorgan Med Chem Lett, 2011, 21(15): 4400-4403. |
| [5] | 崔艳梅, 王辉, 赵长琦. 细叶鸢尾根脂溶性成分的GC-MS分析 [J]. 北京师范大学学报: 自然科学版, 2010, 46(4): 500-502. |
| [6] | 杨阳, 陈洁君, 赵长琦, 等. 鸢尾属两种植物-膜苞鸢尾和蓝花喜盐鸢尾的化学成分研究 [J]. 中草药, 2013, 44(11): 1371-1375. |
| [7] | Nighat N. Immunomodulatory activity of isoflavones isolated from Iris kashmiriana: Effect on T-lymphocyte proliferation and cytokine production in Balb/c mice [J]. Biomed Prev Nutr, 2013, 3(2): 151-157. |
| [8] | 黄龙. 白射干化学成分研究及我国鸢尾属药用亲缘学初探 [D]. 北京: 北京协和医学院. |
| [9] | Gamal A M, Sabrin R M I, Samir A R. New ceramides and isoflavone from the Egyptian Iris germanica L. rhizomes [J]. Phytochem Lett, 2013, 6(3): 340-344. |
| [10] | Schütz C, Quitschau M, Hamburger M. Profiling of isoflavonoids in Iris germanica rhizome extracts by microprobe NMR and HPLC-PDA-MS analysis [J]. Fitoterapia, 2011, 82(7): 1021-1026. |
| [11] | Mizuno T, Yabuya T, Kitajima J. Identification of novel C-glycosylflavones and their contribution to flower colour of the Dutch Iris cultivars [J]. Plant Physiol Biochem, 2013, 72: 116-124. |
| [12] | Ma Y H, Li H, Lin B B. C-glycosylflavones from the leaves of Iris tectorum Maxim [J]. Acta Pharm Sin B, 2012, 2(6): 598-601. |
| [13] | Mosihuzzman M, Naheed S, Hareem S. Studies on α-glucosidase inhibition and anti-glycation potential of Iris loczyi and Iris unguicularis [J]. Life Sci, 2013, 92(3): 187-192. |
| [14] | Shu P, Qin M J, Shen W J. A new coumaronochromone and phenolic constituents from the leaves of Iris bungei Maxim. [J]. Biochem Syst Ecol, 2009, 37(1): 20-23. |
| [15] | Shu P, Hong J L, Wu G. Analysis of flavonoids and phenolic acids in Iris tectorum by HPLC-DAD-ESI-MSn [J]. Chin J Nat Med, 2010, 8(3): 202-207. |
| [16] | Salwa F F, Yoshiaki T, Masatake N. Stilbene glucosides from the bulbs of Iris tingitana [J]. Phytochem Lett, 2009, 2(4): 148-151. |
| [17] | 马雨涵, 林彬彬, 刘慧. 鸢尾叶的化学成分 [J]. 植物资源与环境学报, 2011, 20(4): 88-89. |
| [18] | 须春君, 吴刚, 秦民坚. 六棱鸢尾地下部分的化学成分研究 [J]. 中国新药杂志, 2011, 20(22): 2273-2274. |
| [19] | Conforti F, Rigano D, Menichini F. Protection against neurodegenerative diseases of Iris pseudopumila extracts and their constituents [J]. Fitoterapia, 2009, 80(1): 62-67. |
| [20] | 尉玉玲, 林彬彬, 王国凯. 野鸢尾地下部分的化学成分研究 [J]. 药学与临床研究, 2011, 19(3): 238-240. |
| [21] | Sun Y S, Liu Z B, Wang J H. Ultrasound-assisted extraction of five isoflavones from Iris tectorum Maxim. [J]. Separ Purif Technol, 2011, 78(1): 49-54. |
| [22] | 邱庆浩. 川射干化学成分研究 [D]. 泰安: 山东农业大学, 2009. |
| [23] | 李小飞, 李冠, 杨博. 喜盐鸢尾根中化学成分的分离与结构鉴定 [J]. 化学研究与应用, 2013, 25(4): 550-553. |
| [24] | Sun Y S, Li W, Wang J H. Ionic liquid based ultrasonic assisted extraction of isoflavones from Iris tectorum Maxim. and subsequently separation and purification by high-speed counter-current chromatography [J]. J Chromatogr B, 2011, 879(13/14): 975-980. |
| [25] | 沈文娟, 秦民坚, 邓雪阳. 马蔺叶的化学成分 [J]. 中国药学杂志, 2009, 44(4): 249-251. |
| [26] | 徐鑫鑫, 秦民坚. 马蔺根的化学成分研究 [J]. 药学与临床研究, 2010, 18(3): 260-264. |
| [27] | Mizuno T, Okuyama Y, Iwashina T. Phenolic compounds from Iris rossii, and their chemotaxonomic and systematic significance [J]. Biochem Syst Ecol, 2012, 44: 57-160. |
| [28] | Amin A, Wani S H, Mokhdomi T A. Investigating the pharmacological potential of Iris kashmiriana in limiting growth of epithelial tumors [J]. Pharm J, 2013, 5(4): 170-175. |
| [29] | 潘静. 川射干化学成分及体外抗肿瘤活性的研究 [D]. 武汉: 湖北中医学院, 2009. |
| [30] | 汪新亮, 吴基良, 郑敏, 等. 葛花鸢尾异黄酮对SMMC-7721肝癌细胞增殖的抑制作用 [J]. 中国新药杂志, 2010, 19(2): 168-171. |
| [31] | Xu Q L, Xie H H, Wu P. Flavonoids from the capitula of Eriocaulon austral [J]. Food Chem, 2013, 139(1/4): 149-154. |
| [32] | Wozniak D, Janda B, Kapusta I. Antimutagenic and anti-oxidant activities of isoflavonoids from Belamcanda chinensis (L.) DC. [J]. Mutat Res, 2010, 696(2): 148-153. |
| [33] | Tamura S, Yoshihira K, Tokumaru M. Inhibitors for expression of IgE receptor on human mast cell from Puerariae Flos [J]. Bioorg Med Chem Lett, 2010, 20(13): 3872-3875. |
| [34] | Hacıbekiroğlu I, Kolak U. Screening antioxidant and anticholinesterase potential of Iris albicans extracts [J]. Arab J Chem, 2015, 8(2): 264-268. |
| [35] | 林金德. 鸢尾苷元对大鼠肝脏缺血再灌注损伤的保护作用 [D]. 杭州: 浙江大学, 2013. |
| [36] | 王金凤, 薄华本, 孟祥颖. 鸢尾苷元对急性心肌梗死小鼠心肌的保护作用 [J]. 中国新药与临床杂志, 2010, 29(2): 99-103. |
| [37] | 王金凤, 张艳萍, 杨翠燕. 鸢尾苷元对氧化损伤血管内皮细胞MCP-1和ICAM-1表达的影响 [J]. 中国中药杂志, 2010, 35(15): 2001-2003. |
| [38] | Chien M L, Rong D L, Shui T C. Neurocytoprotective effects of the bioactive constituents of Pueraria thomsonii in 6-hydroxydopamine (6-OHDA)-treated nerve growth factor (NGF)-differentiated PC12 cells [J]. Phytochemistry, 2010, 71(17/18): 2147-2156. |
| [39] | Jun H W, Yu R W, Wu Y H. Anti-proliferative and pro-apoptotic effects of tectorigenin on hepatic stellate cells [J]. World J Gastroenterol, 2010, 16(31): 3911-3918. |
| [40] | Zhang H, Liu X F, Chen S. Tectorigenin inhibits the in vitro proliferation and enhances miR-338* expression of pulmonary fibroblasts in rats with idiopathic pulmonary fibrosis [J]. J Ethnopharmacol, 2010, 131(1): 165-173. |
 2015, Vol. 46
2015, Vol. 46



