黄独Dioscorea bulbifera L. 为薯蓣科(Dioscoreaceae)薯蓣属Dioscorea L. 植物,其地下块茎(黄药子)可入药,主治甲状腺肿大、咽喉肿痛、咯血、百日咳等病[1]。另外,现代医学表明,黄独块茎中的主要成分不仅能显著地抑制小鼠肿瘤生长,对培养的人类肿瘤细胞也有直接的抑制作用[2, 3]。微型块茎是指在薯蓣属植物试管苗腋芽处形成的变态块茎。它作为营养繁殖器官与试管苗相比具有易保存、运输方便、移栽成活率高等优点[4]。因此,对微型块茎的研究已成为一个研究热点。
目前对微型块茎的研究主要集中在外源物质对其诱导形成的影响[5, 6]等方面,而对其诱导形成过程中的关键酶基因表达研究较少。但植物次生代谢途径中关键酶基因的克隆与功能研究对于代谢产物的合成途径阐述与调控机制的了解却至关重要[7]。在植物体内,三萜皂苷类化合物需通过类异戊二烯代谢途径合成[8]。鲨烯是三萜类、甾醇类、胆固醇类等烯萜类的共同前体,鲨烯合酶(squalene synthase,SQS,EC2.5.1.21)是生物体中催化类异戊烯代谢途径向甾醇和三萜生物合成转化的第一个关键酶,定位于内质网膜上,它能催化2分子的法尼基焦磷酸(FPP)缩合生成甾醇胆固醇和三萜等萜烯类化合物的第1个前体——鲨烯(SQ)[9]。此外,FPP还可作为其他酶的底物,生成赤霉素、类胡萝卜素等活性物质。因此处于分支位点的SQS基因的表达水平和活性对于提高其下游产物,尤其是甾醇类皂苷的量至关重要[10]。研究表明,SQS基因也在薯蓣类植物薯蓣皂苷元合成中起重要作用[11, 12]。
目前,有关三七[13]、铁皮石斛[14]、滇重楼[10]、枇杷[9]、刺五加[8, 15]、巴西橡胶树[16]、盾叶薯蓣[11]等植物上的SQS基因表达已有相关报道。而有关黄独SQS基因的表达特别是黄独微型块茎诱导形成过程中的SQS基因表达尚未见报道。实时荧光定量 PCR(quantitative real-time PCR,qRT-PCR)是在传统PCR技术基础上发展而来的一种新的核酸定量技术,具有灵敏度高、重复性好、特异性强和高通量等特点,已被广泛地应用于基因的表达和转录组分析等研究中[17]。本研究以黄独微型块茎为试材,利用qRT-PCR分析技术,对SQS基因在黄独微型块茎诱导形成过程中的表达进行研究,以期为深入了解该基因的表达与薯蓣皂苷合成的关系提供依据,同时也为该技术在黄独研究中的使用构建相应的技术平台。
1 材料和方法 1.1 材料黄独Dioscorea bulbifera L. 脱毒苗由上饶师范学院生命科学学院植物组织培养室提供,由上饶师范学院生命科学学院王艾平教授鉴定。
1.2 方法1.2.1 黄独微型块茎的诱导形成
在无菌条件下切取黄独脱毒苗生理状态均一(成熟度基本一致)约1.0~1.5 cm的带芽茎段。然后将带芽茎段接入微型块茎诱导培养基上。培养基为MS+KT 2 mg/L+NAA 0.5 mg/L+60 g/L蔗糖+5 g/L琼脂粉。接种完后,将黄独带芽茎段置于光照培养内培养。培养条件设置为温度(25±1)℃,湿度70%~80%,光照时间14 h/d,光照强度1 500~2 000 lx。当微型块茎开始在叶腋内长出后,每隔18 d取微型块茎进行SQS基因表达的qRT-PCR分析。18、36、54、72、90 d共取5个时期的微型块茎分别编号1~5。不同发育时期的微型块茎从试管苗取下后,经液氮速冻置于−80 ℃超低温冰箱保存备用。
1.2.2 黄独微型块茎RNA提取液氮研磨黄独微型块茎成粉末状后使用RNA提取试剂盒EASYspin Plus Plant RNA Extraction Kit进行提取。
1.2.3 RNA检测和电泳使用Nanodrop 2000检测RNA的浓度,把1.5 μL RNA和1.5 μL核酸染料混匀,结合3~5 min后使用1%的琼脂糖凝胶进行分离,180 V电泳10 min后取胶拍照。
1.2.4 反转录将RNA模板、Primer Mix、dNTP Mix、RT Buffer、SuperRT和RNase-Free water溶解并置于冰上备用。反转录反应体系总体积为20 μL,其中dNTP Mix 4 μL,终浓度为500 μmol/L;Primer Mix 2 μL;RNA Template 0.05~5 μg/μL;5×RT 缓冲液4 μL;SuperRT(200 U/μL)1 μL;RNase-Free water 至20 μL。涡旋震荡混匀,短暂离心,使管壁上的溶液收集到管底。42 ℃孵育30~50 min,85 ℃孵育5 min。反应结束后,短暂离心,置于冰上冷却。逆转录产物可直接用于PCR反应和荧光定量PCR反应,或置于−20 ℃长期保存。1号样品加入RNA 2 μL,3号样品加入RNA 4 μL,2、4和5号样品加入RNA 6 μL。
1.2.5 引物设计与扩增检测选择actin作为内参基因,并设计相应的扩增引物。根据盾叶薯蓣块茎中已获得的SQS基因序列(NCBI GenBank accession No:KC960673,保守区域为243~640 bp),使用primer premier 6.0软件设计5对引物。引物1序列TTGAT,R:AGAGAATCTGAAGCAAGGT;引物2序列(5’-3’)F:CGATATTACTAGGCGAATGG,R:AGAGAATCTGAAGCAAGGT;引物3序列(5’-3’)F:TCTTGACACTGTTGAGGAT,R:TCCAGCCACATAATGACA;引物4序列(5’-3’)F:GACACTGTTGAGGATGATAC ,R:ACTAA-TCCAGCCACATAATG;引物5序列 (5’-3’)F:TGACACTGTTGAGGATGAT,R:AGAGAATCT-GAAGCAAGGT;actin引物序列 (5’-3’)HD-actin-F:CCGGTGTCATGGTTGGTAT,HD-actin-R:GCAG-GCACATTGAAGGTCT。引物由北京三博远志生物技术有限责任公司合成。通过普通PCR扩增,体系为20 μL,退火温度为53 ℃,扩增结束后进行琼脂糖电泳。使用Boer LifeEco(96孔)PCR仪进行基因扩增。PCR反应体系总体积为20 μL,其中2×Es Taq Master Mix 10 μL,终浓度为1 μmol/L;Forward Primer(10 μmol/L)1 μL,终浓度为0.5 μmol/L;Reverse Primer(10 μmol/L)1 μL,终浓度为0.5 μmol/L;Template cDNA(cDNA),1 μL;RNase-Free water,7 μL。把Mix和引物混合,然后加入cDNA,用水补齐至20 μL。设置程序为94 ℃、 2 min预变性,然后94 ℃、30 s,53 ℃、30 s,72 ℃、30 s,35个循环。最后72 ℃延伸2 min后结束程序。大约95 min完成所有程序。
1.2.6 qRT-PCR使用LineGene 9600(96孔)实时荧光定量PCR仪进行基因表达的检测。qRT-PCR反应体系总体积为20 μL,其中2×UltraSYBR Mixture 10 μL,终浓度为1 μmol/L;Forward Primer(10 μmol/L) 1 μL,终浓度为0.5 μmol/L;Reverse Primer(10 μmol/L)1 μL,终浓度为0.5 μmol/L;Template cDNA(cDNA)1 μL;RNase-Free water 7 μL。把SYBR Mix和引物混合,然后加入cDNA,用水补齐至20 μL。设置程序为95 ℃、10 min预变性,然后95 ℃、15 s,60 ℃、1 min,40个循环。最后进行熔解曲线的分析,熔解曲线设置程序为95 ℃、15 s,60 ℃、1 min,95 ℃、15 s,60 ℃、15 s。40个循环,大约100 min完成所有程序。通过软件获取Ct值、荧光扩增图、熔解曲线。
2 结果与分析 2.1 引物PCR检测用于定量PCR的引物扩增出的片段有明显的条带,且没有出现明显的引物二聚体。普通PCR电泳检测结果(图 1)表明,1和2号引物有条带,但是相对分子质量较小且特异性较差,3号没有出现,4号条带浅,5号引物效果最好,因此本实验最终选择第5号引物进行SQS基因的qRT-PCR定量。
 | 图 1 1~5号引物和内参基因引物的PCR电泳结果Fig.1 PCR electrophoresis results of Primers 1— 5 and reference gene primer |
以第5号引物为引物,以黄独诱导形成时间为18、36、54、72、90 d的微型块茎的cDNA为模板,每组设3个重复,经qRT-PCR后,扩增曲线的走势正常,拐点清楚,整体平行性好,基线平而无上扬现象,表明各样品均检测出内参基因actin和目的基因SQS基因的表达。内参基因actin和目的基因SQS基因熔解曲线均表现为熔解峰单一,且都没有引物二聚体的生成,表明各样品均特异性扩增到内参基因actin和目的基因SQS基因的目的产物,也说明引物特异性好,证明扩增所得条带均为特异性条带。通过软件获取Ct</ sub>值,重复4次,选择了3个更好的重复作为数据,运用2−ΔΔCt法[18]进行数据处理:大于1.5的表示表达量增加,小于0.5的表示表达量下降,1.0附近的表示表达量没有显著变化。结果见图 2。从图 2可以看出,诱导形成36 d的微型块茎SQS基因表达增加,54 d和72 d的SQS基因表达没有变化,90 d的SQS基因表达量下降。这个结果说明,SQS基因在黄独微型块茎诱导形成的初期(第18~36天),表达量显著增加。在黄独微型块茎诱导形成的中期(第36~72天)SQS基因的表达量显著下降,并趋于稳定。在黄独微型块茎诱导形成的后期(第72~90天)SQS基因的表达量再次显著下降。
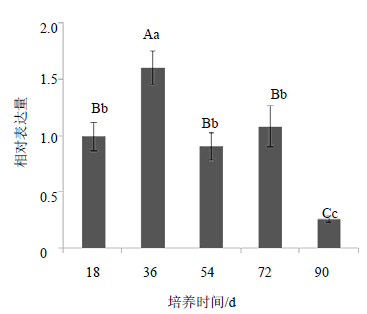 |
不同字母表示差异显著 P<0.05 Different letters means P<0.05 图 2 SQS基因在黄独微型块茎诱导形成过程中的相对定量检测结果Fig.2 Relative quantification of SQS gene expression in formation of D. bulbifera microtuber |
目前在植物三萜生物合成途径研究中,由于SQS是竞争利用FPP来合成三萜,会影响倍半萜类、二萜类等物质合成的关键酶,因此SQS的量和活性决定了相关物质的产量[19]。因此,对SQS基因表达的研究备受重视。实时荧光定量PCR(qRT-PCR)因具特异性强、灵敏度高和检测范围广等优点,已被广泛应用于植物SQS基因表达研究中[20]。
在大戟[21]、吊兰[22]等植物中,SQS基因只有1种;而在甘草[23]、睡茄[24]等植物中,SQS基因有2种;人参[25]等植物的SQS基因则多达3种。在薯蓣类植物——盾叶薯蓣的块茎中,SQS基因也只有一种[11]。许多研究表明,幼嫩的器官中SQS基因的表达量较为丰富。在盾叶薯蓣中,幼嫩块茎中SQS基因的表达量高于成熟块茎,但在叶片中恰恰相反,成熟叶片中SQS基因的表达量高于幼嫩叶片[11]。但在铁皮石斛中SQS基因表达量大小依次为根>茎>叶[14],这与三七中SQS基因表达很相似,在三七中,根SQS基因转录表达量最高,高于茎和芦头的表达[13]。邢朝斌等[15]发现,在刺五加的整个生长期中,SQS基因的表达量呈现出“低-高-低-高-低”的变化趋势。而本实验结果表明,在黄独微型块茎诱导形成的整个过程中,SQS基因的表达量呈现出“低-高-低-不变-低”的变化趋势。究其原因,可能是早期的微型块茎细胞分裂较快,细胞生长活跃,需要更多的甾醇类物质。目前最常用的实时定量PCR方法有染料(SYBR Green I)法和TaqMan探针法2种[26]。本研究选择SYBR Green染料法。SYBR Green I与DNA双链小沟结合,当它与DNA双链结合时发出荧光。PCR过程中,复性和延伸时形成双链DNA,SYBR Green I发出荧光。因此,在一个体系内,其信号强度代表了双链DNA分子的数量,用该方法分析基因的表达模式,简便易行,具有高灵敏度和高重现性等优点[27]。但SYBR Green I染料法特异性不如探针法,需要熔解曲线判断PCR扩增反应是否特异[26]。本实验所得的目的基因和内参基因的熔解曲线也呈单一峰,扩增曲线的扩增期和平台期均十分明显,线性范围也合理,并且均进行3次重复,保证定量结果的准确。在盾叶薯蓣SQS基因[11]的表达中,采用SYBR Green I染料法,也取得了比较满意的实验结果。利用qRT-PCR方法计算基因相对表达量时,通常需引入一个表达较为稳定的管家基因作为内参基因。在薯蓣属植物的基因表达研究中,常用的稳定表达的管家基因有甘油醛-3-磷酸-脱氢酶基因(GAPDH)、肌动蛋白基因(actin)、微管蛋白基因(tubulin)、和18S rRNA等[28, 29]。在盾叶薯蓣环阿屯醇合酶基因[30]和SQS基因[11]的表达中,分别使用18S rRNA和GAPDH< span style='font-family: 宋体;letter-spacing:.1pt'>作为内参基因,效果较好。在田薯花青素合成酶(ANS)基因[31]、大薯蔗糖合成酶(SuSy)基因[32]和紫山药黄烷酮-3-羟化酶(DaF3H)基因[33]的表达分析,较好的内参基因均为actin。这些研究结果与本实验结果一致。目前,qRT-PCR技术用于薯蓣属植物基因相对表达量的研究仍较少。本实验首次运用该技术对黄独微型块茎诱导形成过程中SQS基因在转录水平上的相对表达量进行分析,明确了该基因在黄独微型块茎诱导初期的表达量最高,为进一步探讨SQS基因的功能提供了相关依据。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志 (第6卷) [M]. 北京: 科学出版社, 1985. |
| [2] | 龙雯虹, 肖关丽, 王琼, 等. 黄独珠芽浸提液对大白菜种子发芽的影响及休眠期内源激素含量的变化 [J]. 西南师范大学学报: 自然科学版, 2012, 37(8): 51-54. |
| [3] | 龙雯虹, 王琼, 肖关丽, 等. 黄独珠芽生长期内源激素及糖类物质含量的变化 [J]. 云南农业大学学报, 2013, 28(2): 283-286. |
| [4] | 李书杰, 张晓丽, 李俊华, 等. 植物生长物质对山药微型块茎诱导形成的影响 [J]. 北方园艺, 2014(14): 200-203. |
| [5] | 李明军, 刘欣英, 李萍, 等. 山药微型块茎诱导形成的影响因子研究 [J]. 中草药, 2008, 39(6): 905-910. |
| [6] | 彭晓英, 周朴华, 张良波, 等. 盾叶薯蓣试管株芽的诱导 [J]. 热带亚热带植物学报, 2005, 13(4): 319-323. |
| [7] | 朱振洪, 沈静炎, 周利萍, 等. 浙贝母鲨烯合酶核心功能区基因克隆与序列分析 [J]. 生物技术, 2014, 24(3): 1-5. |
| [8] | 邢朝斌, 龙月红, 李非非, 等. 刺五加鲨烯合酶基因家族两成员的表达及其与皂苷含量的关系 [J]. 西南农业学报, 2014, 27(3): 1252-1255. |
| [9] | 李惠华, 刘小英, 王伟, 等. 枇杷鲨烯合酶 (squalene synthase) 基因的克隆及序列分析 [J]. 热带作物学报, 2014, 35(6): 1090-1094. |
| [10] | 高飞, 雒晓鹏, 陶亮, 等. 滇重楼鲨烯合酶基因PpSQS的克隆及在大肠杆菌中的表达 [J]. 中国中药杂志, 2013, 38(13): 2086-2091. |
| [11] | Ye Y, Wang R F, Jin L, et al. Molecular cloning and differential expression analysis of a squalene synthase gene from Dioscorea zingiberensis, an important pharmaceutical plant [J]. Mol Biol Rep, 2014, 41(9): 6097-6104. |
| [12] | Ding C H, Du X W, Xu Y, et al. Screening for differentially expressed genes in endophytic fungus strain 39 during co-culture with herbal extract of its host Dioscorea nipponica Makino [J]. Curr Microbiol, 2014, 69(4): 517-524. |
| [13] | 吴耀生, 朱华, 李珅, 等. 三七鲨烯合酶基因在三七根、茎、芦头中的转录表达与三萜皂苷合成 [J]. 中国生物化学与分子生物学报, 2007, 23(12): 1000-1005. |
| [14] | 张岗, 唐志书, 周莉英, 等. 铁皮石斛鲨烯合酶基因的克隆及其组织表达模式分析 [J]. 西北农林科技大学学报: 自然科学版, 2013, 41(9): 151-158. |
| [15] | 邢朝斌, 龙月红, 劳凤云, 等. 刺五加鲨烯合酶基因的表达及其对皂苷含量的影响 [J]. 经济林研究, 2013, 31(1): 25-29. |
| [16] | 张志平, 仇键, 杨文凤, 等. 巴西橡胶树鲨烯合酶基因的克隆与序列分析 [J]. 广西植物, 2014, 34(2): 235-241. |
| [17] | 周晓慧, 刘军, 庄勇. 喀西茄内参基因实时荧光定量PCR表达稳定性评价 [J]. 园艺学报, 2014, 41(8): 1731-1738. |
| [18] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt Method [J]. Methods, 2001, 25(4): 402-408. |
| [19] | 戴住波, 钱子刚, 胡运乾, 等. 金铁锁鲨烯合酶cDNA的克隆和功能鉴定 [J]. 药学学报, 2008, 43(12): 1245-1250. |
| [20] | 齐飞艳, 胡陶, 彭镇华, 等. 毛竹实时荧光定PCR内参基因的筛选及成花基因PheTFL1表达分析 [J]. 西北植物学报, 2013, 33(1): 48-52. |
| [21] | Zheng Z, Cao X, Li C, et al. Molecular cloning and expression analysis of a squalene synthase gene from a medicinal plant, Euphorbia pekinensis Rupr. [J]. Acta Physiol Plant, 2013, 35(10): 3007-3014. |
| [22] | Kalra S, Kumar S, Lakhanpal N, et al. Characterization of squalene synthase gene from Chlorophytum borivilianum (Sant. and Fernand.) [J]. Mol Biotechnol, 2013, 54(3): 944-953. |
| [23] | Hayashi H, Hirota A, Hiraoka N, et al. Molecular cloning and characterization of two cDNAs for Glycyrrhiza glabra squalene synthase [J]. Biol Pharm Bull, 1999, 22(9): 947-950. |
| [24] | Gupta N, Sharma P, Kumar R J S, et al. Functional characterization and differential expression studies of squalene synthase from Withania somnifera [J]. Mol Biol Rep, 2012, 39(9): 8803-8812. |
| [25] | Kim T D, Han J Y , Huh G H, et al. Expression and functional characterization of three squalene synthase genes associated with saponin biosynthesis in Panax ginseng [J]. Plant Cell Physiol, 2011, 52(1): 125-137. |
| [26] | 杨帆, 丁菲, 杜天真. 盐胁迫下构树DREB转录因子基因表达的实时荧光定量PCR分析 [J]. 林业科学, 2010, 46(4): 146-150. |
| [27] | 张中保, 李会勇, 石云素, 等. 应用实时荧光定量PCR技术分析玉米水分胁迫诱导基因的表达模式 [J]. 植物遗传资源学报, 2007, 8(4): 421-425. |
| [28] | 邢朝斌, 吴鹏, 陈龙, 等. 刺五加GAPDH基因的克隆及序列分析 [J]. 中草药, 2012, 43(1): 155-158. |
| [29] | 孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量PCR分析中内参基因的选择 [J]. 植物学报, 2010, 45(5): 579-587. |
| [30] | 陈迪, 陈永勤, 杨之帆, 等. 盾叶薯蓣环阿屯醇合酶基因克隆与表达 [J]. 西北植物学报, 2009, 29(2): 221-228. |
| [31] | 周生茂, 王玲平, 向珣, 等. 山药ANS基因的克隆和分子特性及其与花青素积累的关系 [J]. 园艺学报, 2009, 36(9): 1317-1326. |
| [32] | 周生茂, 曹家树, 王玲平, 等. 山药SuSy基因全长cDNA序列的结构、进化和表达 [J]. 中国农业科学, 2009, 42(7): 2458-2468. |
| [33] | 闫瑞霞, 殷剑美, 韩晓勇, 等. 紫山药花青素调控基因DaF3H的克隆及表达分析 [J]. 园艺学报, 2014, 41(4): 701-712. |
 2015, Vol. 46
2015, Vol. 46

 ,
,