2. 第二军医大学附属长征医院 药学部, 上海 200003
2. Department of Pharmacy, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
菘蓝Isatis indigotica Fort.为十字花科(Cruciferae)菘蓝属Isatis L. 二年生草本植物。其根入药为板蓝根,其叶入药为大青叶,有清热解毒、凉血消斑、利咽止痛的功效[1,2],临床应用广泛。本课题组前期研究表明,木脂素类成分落叶松脂素和落叶松脂素苷正是我国传统中药板蓝根发挥抗病毒功效的重要活性物质基础[3],且抗病毒活性与木脂素生物合成途径中基因的高表达密切相关[4]。然而菘 蓝中落叶松脂素和落叶松脂素苷量相对较低,有必要进行相应地次生代谢调控。本研究采用cDNA末端快速扩增(rapid amplification of cDNA ends,RACE)技术,首次从菘蓝中分离得到木脂素生物合成中关键酶肉桂酸-4-羟基化酶(cinnamic acid 4-hydroxylase,C4H)基因,为后续开展菘蓝中木脂素类成分代谢调控研究奠定基础。 1 材料与试剂 1.1 材料
菘蓝种子采集自第二军医大学药学院植物园。菘蓝种子采用常规消毒法进行消毒处理,接种到MS培养基上获得无菌苗。幼苗生长在25 ℃光照16 h、18 ℃暗环境8 h的控温室中。收集生长2个月的菘蓝幼苗的根、茎和叶,用于菘蓝RNA、DNA的抽提。 1.2 试剂
大肠杆菌菌株Trans5α、克隆载体pEASY-T1 Cloning Vector、反转录试剂盒TransScript First-Strand cDNA Synthesis SuperMix、小量胶回收试剂盒EasyPure Quick Gel Extraction Kit购自北京全式金生物技术有限公司;RNA提取试剂盒、小量质粒抽提试剂盒购自上海华舜生物技术有限公司;SMARTerTM RACE cDNA Amplification Kit试剂盒购自Clontech(美国)公司;Real-time PCR 试剂盒PrimeScriptTMRT reagent Kit、TaKaRa LA Taq酶购自TaKaRa(日本)公司;限制性内切酶购自纽英伦生物技术(北京)有限公司。 2 方法 2.1 菘蓝核酸的提取和RACE
cDNA文库的构建按照CTAB法和RNA提取试剂盒操作说明分别提取菘蓝DNA和RNA,并进行相应的浓度和纯度检测。按反转录试剂盒TransScript First-Strand cDNA Synthesis SuperMix操作说明将RNA逆转录为cDNA。按SMARTerTM RACE cDNA Amplification Kit(Clontech,美国)的操作程序构建菘蓝RACE cDNA文库,构建好的3’-ready和5’-ready RACE cDNA文库被分装成小份保存于-20 ℃冰箱。 2.2 菘蓝C4H基因全长cDNA及对应的基因组序列的获得
首先根据GenBank上登录C4H的cDNA序列保守区设计一对简并引物dC4HFP和dC4HRP用于扩增C4H基因的保守片段。进而根据C4H基因保守区序列,分别设计3’-RACE引物C4HF579和5’-RACE引物C4HR471,下游引物为试剂盒提供的UPM(Universal Primer A Mix,Clontech,美国),分别以3’-ready 和5’-ready RACE cDNA文库为模板扩增获得C4H基因末端序列。将3’-RACE和5’-RACE的测序结果进行比对拼接后,设计菘蓝C4H基因全长引物C4HQCF和C4HQCR,分别以菘蓝cDNA和DNA为模板利用高保真酶LA Taq DNA聚合酶进行PCR扩增获得菘蓝C4H基因全长cDNA及对应的基因组序列。
PCR扩增反应体系为50 μL,反应结束后电泳,目的片段回收纯化后与克隆载体pEASY-T1 Cloning Vector连接,后转入大肠杆菌菌株Trans5α,经过PCR扩增筛选,挑选含有目的片段的菌液送至上海生工生物工程有限公司进行测序。PCR扩增实验中所用的引物序列及退火条件见表 1。
| 表 1 菘蓝C4H基因克隆和表达分析所用引物序列 Table 1 Primer sequences used in gene cloning and expression analyses of C4H |
本实验中的序列比对均使用Vector NTI Advance 11软件和BLAST(http://blast.ncbi.nlm.nih. gov/Blast. cgi)进行分析,开放阅读框(ORF)的查找和核苷酸的翻译在NCBI的ORF Finder(http://www.ncbi. nlm.nih.gov/ gorf/gorf.html)上完成。蛋白质基本性质的分析用http://www.expasy.org 网站提供的相关生物信息学分析软件进行C4H蛋白系统进化分析,使用CLUSTAL X(1.80)软件对序列进行多重比对,并用MEGA 2.0软件,采用相邻节点(NJ)算法构建进化树[5,6,7]。进化树的可靠性采用自展分析法(bootstrap analysis)进行1 000次重复。C4H蛋白的相对分子质量、等电点和结构使用Vector NTI Advance 11软件进行预测分析。C4H蛋白二级结构使用GOR IV[8](http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?
page=npsa_gor4.html)预测分析。根据Swiss-Model[9,10,11](http://swissmodel.expasy.org/)进行同源模建(homology modeling),用Web Lab View Lite 4.0软件绘制蛋白的三维结构。多重比对和系统发生树构建中使用到的C4H蛋白的相关信息见表 2。
| 表 2 C4H蛋白相关信息 Table 2 Information of C4Hproteins |
采用RNA提取试剂盒提取菘蓝根、茎、叶,以及各种胁迫刺激,即紫外(UV-B)照射、茉莉酸甲酯(MeJA)、脱落酸(ABA)、赤霉素(GA3)处理后的菘蓝叶片的总RNA,按照TaKaRa 公司Dnase I 的操作程序,在37 ℃下温浴30 min以去除RNA样品中的DNA。根据TransGen操作手册指导用TransScript First-Strand cDNA Synthesis SuperMix合成第一链cDNA。Real Time PCR反应采用试剂盒SYBR Premix ex TaqTM(TaKaRa),具体操作按试剂盒说明书。所用的特异引物是C4HF579和C4HR862;菘蓝18 S rRNA 基因作为对照,所用的特异引物是18SF和18SR;反应程序见表 1。 2.5 菘蓝C4H的Southern
blotting分析 以菘蓝cDNA为模板,C4HF579和C4HR1154为引物,扩增Southern blotting杂交探针。每份20 μg的菘蓝基因组DNA样品分别用EcoRI和XbaI在37 ℃、BstEII在60 ℃酶切过夜,EcoRI、XbaI和BstEII在C4H全长区域均没有识别位点。过夜酶切之后样品用1%的凝胶80 V电泳,凝胶电泳中的DNA经脱嘌呤、变性和中和之后用10×SSC转移到带正电荷的尼龙膜上,80 ℃固定2 h之后用于杂交。探针标记、杂交、洗膜和杂交信号检测均按Amersham Pharmacia公司的随机引物标记试剂盒和CDP-Star检测试剂盒的标准操作进行,杂交膜用X光片检测,在室温显影2 h后显影、定影。 3 结果与分析 3.1 菘蓝基因全长cDNA的克隆及其特征分析
利用简并引物dC4HFP 和dC4HRP扩增得到C4H基因的783 bp大小的保守片段。依据此保守片段设计特异引物,采用RACE技术,分别获得C4H基因的1 066 bp的3’末端和493 bp的5’末端,通过BLAST序列比对初步确定为目标基因片断,在Vector NTI Advance 11软件中将3个片断连接成基因全长,根据该全长序列,设计全长特异引物,以菘蓝cDNA反转录库为模板得到基因的全长序列。C4H全长cDNA为1 674 bp(GenBank登录号:GU014562),包含一个1 530 bp的ORF,编码509个氨基酸残基。经过BLAST进行基因比对,发现得到的cDNA序列与芫菁Brassica rapa L. ssp. rapifera Matzg中的C4H基因具有91%的相似性,与拟南芥Ammi thaliana (L.) Heynh中C4H基因具有88%的相似性。C4H对应的基因组序列1 946 bp进行分析,C4H基因含有2个内含子,3个外显子。相关的电泳图见图 1。
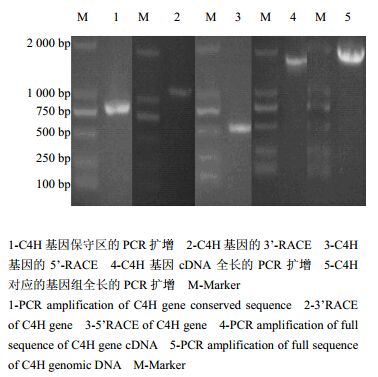 | 图 1 菘蓝C4H基因的克隆 Fig. 1 Clone of C4H gene from I. indigotica |
使用Vector NTI Advance 11软件进行预测和分析,C4H预测计算的等电点(pI)为9.07,相对分子质量约为58 220。
使用protein-protein BLAST分析表明,C4H与其他植物C4H蛋白具有极高的相似性。如与芫菁中C4H(蛋白登录号:BAI77480.1)具有98%的相似性;与拟南芥中C4H(蛋白登陆号:CAP08828.1)具有98%的相似性。通过Clustal X软件,全长序列比对的结果显示,都具有P450蛋白特有的保守位点[12],如位于第439~449位氨基酸残基(PFGVGRRSCPG)组成血红素结合位点(heme binding region),位于第363~366位氨基酸残基(ETLR)组成K螺旋(K helix),位于第306~311位氨基酸残基(AAIETT)组成I螺旋(I helix),位于N端从34到43位置的10个氨基酸残基(PPGPMPIPIF)组成脯氨酸铰链(proline hinge)。
利用程序GOR IV预测了C4H蛋白的二级结构(图 2),结果显示具有39.29% α螺旋、17.68%延伸主链和43.03%无规卷曲,α螺旋主要位于N端和蛋白中间位置,延伸主链主要位于N端和C端,无规卷曲分布于蛋白整个区域。
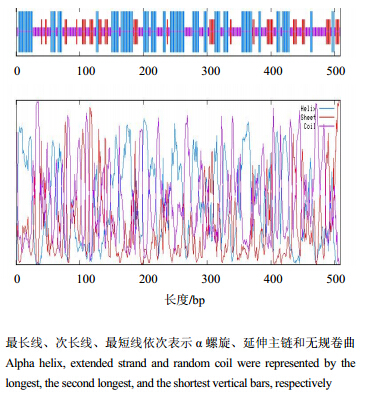 | 图 2 C4H蛋白的二级结构 Fig. 2 Secondary structure of deduced C4H protein |
通过SWISS-MODEL,以CYP P450超家族蛋白(PDB id:2nnjA)为参比模板,构建了C4H蛋白的三维结构模型(图 3),更好地阐述C4H蛋白的特征,蛋白三维结构分析软件采用三维分子Weblab viewerlite呈现。
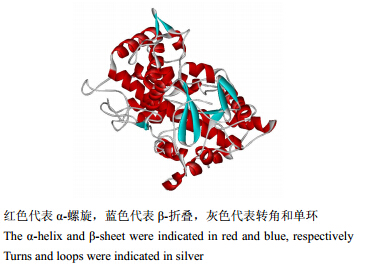 | 图 3 C4H蛋白三维结构模型 Fig. 3 Three-dimensional structure of deduced of C4H protein |
为了考察C4H蛋白与其他物种C4H蛋白之间 的进化关系,根据研究推导的C4H蛋白和表 2中所示的其他物种C4H蛋白构建了一个系统进化树(图 4)。构建系统进化树包括16个物种C4H蛋白,包括单子叶植物和双子叶植物。C4H与同科十字花科的中国大白菜Brassica rapa subsp. pekinensis var. laxa (M. Tsen et S. H. Lee) Hanelt具有最大的相似性,同属一簇。与此同时,特定来源的C4H蛋白形成特定的簇,例如所有的单子叶植物类C4H聚成一簇,双子叶植物聚成一簇。
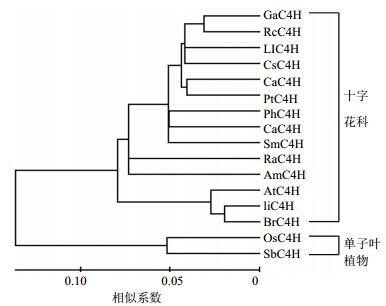 | 图 4 构建的C4H和其他C4H蛋白的系统进化树 Fig. 4 Phylogenetic relationships of C4H proteins from different species |
为了研究C4H基因在菘蓝不同组织部位的表达情况,取6份菘蓝幼苗,分别从菘蓝根、茎、叶中提取总RNA。用引物C4HF579和C4HR862进行
了实时定量PCR,并使用菘蓝18 S rRNA基因作为内对照。采用随机区组方差分析方法处理实验数据,及采用SNK检验两两比较根、茎、叶中表达差异,结果显示C4H在所有的组织里都有表达,3个器官基因表达量有差别(P<0.05),最高的是根,其次是茎,叶中表达量最少(图 5)。
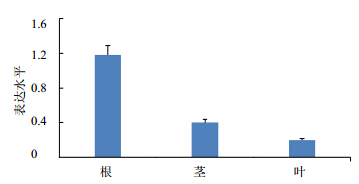 | 图 5 C4H在不同器官中的表达 Fig. 5 PhylogeneticExpression of C4H in different tissues of I. indigotica |
植物的次生代谢产物很多都是植物为了对抗昆虫、食草动物和病原菌的侵袭或是对抗其他生物或非生物的外界刺激而产生的,苯丙素类化合物的代谢可以在环境因素的刺激下上调[13]。本实验考察在各种处理因素的影响下C4H的表达情况。如图 6所示,UV-B、MeJA、ABA和GA3在一定程度上能诱导C4H的表达上调。其中UV-B照射30 min,能在24 h内持续上调C4H的表达,24 h后C4H表达达到高峰;MeJA处理后C4H轻微上调,16 h表达达到高峰;与UV-B处理相似,ABA处理后能够在 24 h内持续上调C4H的表达;GA3处理后,能够迅速上调C4H的表达。
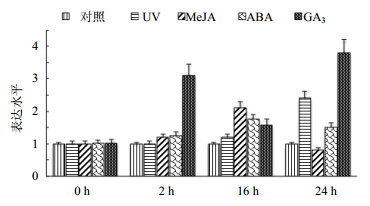 | 图 6 C4H在各种刺激下的表达 Fig. 6 Expression of C4H under various treatments |
为了分析C4H基因的拷贝情况,菘蓝基因组DNA样品分别用EcoRI、XbaI和BstEII酶切过夜,EcoRI、XbaI和BstEII在C4H全长区域均没有识别位点。然后在高度严谨的条件下进行基因组杂交实验。用于标记生物素探针的模板是来自C4H基因cDNA一段575 bp序列。实验结果(图 7)显示,在EcoRI泳道有2条清晰的条带和1条微淡的条带,在XbaI泳道有6条清晰的条带,在BstEII泳道有7条清晰的条带,表明C4H在基因组中属于多拷贝基因。
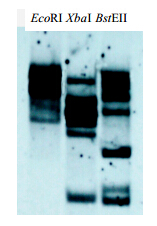 | 图 7 菘蓝C4H基因的Southern blotting杂交分析 Fig. 7 Southern blotting analysis of C4H in I. indigotica genome |
C4H是木脂素生物合成途径上关键酶基因[14],对木脂素类成分次生代谢物的量积累有重要作用。器官特异性表达分析显示C4H在根中表达量最高,佐证了以菘蓝的根作为中药板蓝根入药。
植物的次生代谢产物很多都是植物为了对抗昆虫、食草动物和病原菌的侵袭或是对抗其他生物或非生物的外界刺激而产生的[15]。利用植物的这种特性对植物施加适当的刺激来产生大量的目标次生代谢产物,很多实验证明通过各种各样的信号诱导和刺激可以有效地促进植物次生代谢产物的产生[16,17]。本研究证实,胁迫因素UV-B、MeJA、ABA、GA3在一定程度上能够诱导C4H表达的上调。由于C4H处于苯丙素代谢的上游位置[16],诱导其表达上调,对于下游的木脂素类成分的生物合成具有促进作用,提示可以利用基因调控技术来提高菘蓝中具有抗病毒活性木脂素类化合物的量。
总之,对菘蓝中木脂素生物合成途径开展研究,克隆该途径上关键酶基因[18,19],尝试采用植物次生代谢工程的方法提高其具有抗病毒活性的木脂素类化合物的量,对提高菘蓝药材品质,具有重要的研究意义和现实价值。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 杨 飞, 徐延浩. 四倍体菘蓝基因组DNA甲基化的甲基化敏感扩增多态性分析 [J]. 中草药, 2013, 44(3): 344-348. |
| [3] | 李 彬. 板蓝根活性成分及品质评价 [D]. 上海: 第二军医大学, 2003. |
| [4] | Lu B, Pan X, Zhang L, et al. A genome-wide comparison of genes responsive to autopolyploidy in Isatis indigotica using Arabidopsis thaliana affymetrix genechips [J]. Plant Mol Biol Rep, 2006, 24(2): 197-204. |
| [5] | Thompson J D, Higgins D G, Gibson T J. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice [J]. Nucl Acids Res, 1994, 22(22): 4673-4680. |
| [6] | Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees [J]. Mol Biol Evol, 1987, 4(4): 406-425. |
| [7] | Kumar S, Tamura K, Jakobsen I B, et al. MEGA2: molecular evolutionary genetics analysis software [J]. Bioinformatics, 2001, 17(12): 1244-1245. |
| [8] | Combet C, Blanchet C, Geourjon C, et al. NPS@: network protein sequence analysis [J]. Trends Biochem Sci, 2000, 25(3): 147-150. |
| [9] | Schwede T, Kopp J, Guex N, et al. SWISS-MODEL: An automated protein homology-modeling server [J]. Nucl Acids Res, 2003, 31(13): 3381-3385. |
| [10] | Guex N, Peitsch M. SWISS-MODEL and the Swiss-PdbViewer: an environment for comparative protein modeling [J]. Electrophoresis, 1997, 18(15): 2714-2723. |
| [11] | Arnold K, Bordoli L, Kopp J, et al. The SWISS-MODEL workspace: a web-based environment for protein structure homology modelling [J]. Bioinformatics, 2006, 22(2): 195-201. |
| [12] | Gravot A, Larbat R, Hehn A, et al. Cinnamic acid 4-hydroxylase mechanism-based inactivation by psoralen derivatives: cloning and characterization of a C4H from a psoralen producing plant-Ruta graveolens-exhibiting low sensitivity to psoralen inactivation [J]. Arch Biochem Biophys, 2004, 422(1): 71-80. |
| [13] | Dixon R A, Paiva N L. Stress-induced phenylpropanoid metabolism [J]. Plant Cell, 1995, 7(7): 1085-1097. |
| [14] | 胡永胜, 肖 莹, 邸 鹏, 等. 木质素次生代谢工程的研究概况和进展 [J]. 药学实践杂志, 2011, 29(4): 256-259. |
| [15] | Baucher M, Monties B, Montagu M, et al. Biosynthesis and genetic engineering of lignin [J]. Crit Rev Plant Sci, 1998, 17(2): 125-197. |
| [16] | Yukimune Y, Tabata H, Higashi Y, et al. Methyl jasmonate-induced overproduction of paclitaxel and baccatin III in Taxus cell suspension cultures [J]. Nat Biotechnol, 1996, 14(9): 1129-1132. |
| [17] | Zhang C, Yan Q, Cheuk W K, et al. Enhancement of tanshinone production in Salvia miltiorrhiza hairy root culture by Ag+ elicitation and nutrient feeding [J]. Planta Med, 2004, 70(2): 147-151. |
| [18] | Hu Y, Di P, Chen J, et al. Isolation and characterization of a gene encoding cinnamoyl-CoA reductase from Isatis indigotica Fort. [J]. Mol Biol Rep, 2011, 38(3): 2075-2083. |
| [19] | Di P, Hu Y, Xuan H, et al. Characterization and the expression profile of 4-coumarate: CoA ligase (Ii4CL) from hairy roots of Isatis indigotica [J]. Afr J Pharm Pharm, 2012, 28(6): 2166-2175. |
 2015, Vol. 46
2015, Vol. 46


