2. 扬州市药品检验所, 江苏 扬州 225000;
3. 贵州昌昊中药发展有限公司, 贵州 凯里 556000
2. Yangzhou Institute for Drug Control, Yangzhou 225000, China;
3. Guizhou Chang Hao Chinese Medicine Co., Ltd., Kaili 556000, China
太子参为大宗常用中药材,系石竹科假繁缕属植物孩儿参Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm. 的干燥块根,具益气健脾、润肺生津之传统功效[1]。现代研究表明,太子参水提液具有保护心肌功能、促进免疫、抗应激、治疗糖尿病、止咳等药理作用[2]。本课题组曾采用UPLC-Triple TOF-MS/MS技术分析了不同加工方法对太子参化学成分的影响[3]。
核苷类成分是生物细胞维持生命活动的基本组成元素,具有抗肿瘤、抗病毒、免疫调节、改善脑细胞代谢、镇静中枢神经、抗血小板凝集、抗心律失常和抗惊厥等多种生物活性[4,5,6],与太子参药效具有一定关联性,可作为太子参药材的质量评价指标之一。
古代本草中早有关于加工方法对药物性味影响的论述:“夫药采取不知时节,不以阴干、暴干,虽有药名,终无药实”。可见,药材产地加工方法是影响药材品质的关键因素之一。目前太子参产地传统加工以生晒法与烘干法为主,有关太子参加工方法及其对药材质量影响的研究还尚未见报道。本实验以国内主要产区贵州施秉GAP基地种植太子参为研究对象,用Q-TRAP-LC-MS/MS技术同时测定不同加工方法太子参中13种核苷类成分的量,探讨加工方法对太子参中核苷类成分的影响,为优选太子参适宜产地加工方法提供基础资料,同时为太子参药材质量的综合评价提供新的方法参考。 1 仪器与材料
岛津液相UPLC-20ADXR系列,配有溶剂脱气装置、自动进样器,日本Shimadzu公司;API 4000四级杆-线性离子阱质谱仪,配有离子喷雾接口,美国AB SCIEX公司;CentriVap离心浓缩仪,美国Labconco公司;KQ-500B超声波清洗机,昆山超声仪器有限公司,超声功率500 W。
对照品尿嘧啶(批号100469-200401)、鸟嘌呤(批号140631-200904)、次黄嘌呤(批号140661-200301)、尿苷(批号887-200202)、腺嘌呤(批号110886-200001)、肌苷(批号40669-201104)、腺苷(批号110879-200202)购自中国食品药品检定研究院,质量分数均>98%;胞苷(批号100982718)、鸟苷(批号1001103046)、胸苷(批号1001182663)、2′-脱氧肌苷(批号1000852992)、2′-脱氧鸟苷(批号1000943454)购于美国Sigma公司,质量分数均>98%;2′-脱氧胞苷(批号YSJ-04024)购于上海远慕生物科技有限公司,质量分数>98%。水为超纯水,由Millipore纯水器制备;甲醇为色谱纯,德国默克公司;其余试剂均为分析纯。
太子参样品于2013年7月下旬(当地传统采收期)实地采集于贵州施秉太子参规范化种植基地,块根采挖、洗净后,按不同产地加工方法进行处理:S1——直接晒干(置日光晾晒至干足),S2——边晒边搓(置日光下晾晒至半干后搓去须根,再晒至干足),S3~S5——烘干(置烘箱内分别以40、50、60 ℃烘干),均经南京中医药大学刘训红教授鉴定为石竹科植物孩儿参Pseudostellaria heterophylla (Miq.) Pax ex Pax et Hoffm. 的干燥块根,留样凭证存放于南京中医药大学中药鉴定实验室。 2 方法与结果 2.1 色谱条件
色谱柱为Waters Atlantis T3柱(150 mm×2.1 mm,3 μm);流动相为甲醇-5 mmol/L醋酸铵水溶液;梯度洗脱:0~4.5 min,3%~4%甲醇;4.5~8 min,4%~18%甲醇;8~10 min,18%甲醇;柱温35 ℃;体积流量0.4 mL/min;检测波长254 nm;进样量5 μL。 2.2 质谱条件
离子源:Turbo V,电离模式:(ESI+);采集方式多反应监测(MRM);离子化温度(TEM):650 ℃;喷雾电压:5 500 V;雾化气(GS1):448.24 kPa;辅助气(GS2):448.24 kPa;气帘气(CUR):206.88 kPa。各成分具体质谱分析参数见表 1。
| 表 1 优化的质谱条件参数 Table 1 Optimized MS/MS parameters |
精密称取尿嘧啶、胞苷、次黄嘌呤、鸟嘌呤、尿苷、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、2′-脱氧胞苷、2′-脱氧鸟苷、2′-脱氧肌苷对照品适量,加水配制成质量浓度分别为1 076、751、500、206、1 048、964、1 037、972、874、1 094、911、1 016、947 μg/mL的对照品储备液。取各对照品储备液适量,加水定容至10 mL制成混合对照品溶液,各核苷质量浓度分别为2.152、75.100、7.500、1.030、262.000、1.92 8、155.550、97.200、131.100、4.376、18.220、40.640、94.700 μg/mL。并逐级稀释,得到一系列不同质量浓度的13种核苷混合对照品溶液,以0.22 μm微孔滤膜滤过,供分析用。 2.4 供试品溶液制备
取样品1 g(过40目),精密称定,置于25 mL具塞锥形瓶中,加入15 mL超纯水,室温下超声提取45 min后,滤过,超纯水洗涤2次,每次5 mL,滤液10 000 r/min离心取上清,上清液用离心浓缩仪浓缩至约1 mL,浓缩液定容至2 mL,过0.22 μm滤膜,供UPLC-Q-TRAP分析。 2.5 标准曲线、检测限和定量限
精密吸取“2.3”项下的不同质量浓度的系列对照品溶液及混合对照品储备液各5 μL,在“2.1”项和“2.2”项条件下测定,以对照品的峰面积(Y)对相应的质量浓度(X)进行线性回归,得回归方程、相关系数和线性范围;逐步稀释各对照品溶液,按信噪比(S/N)约为3计算检测限(LOD),以S/N约为10计算定量限(LOQ),见表 2,13种核苷提取离子的MRM图见图 1。
| 表 2 13种核苷标准曲线、检测限和定量限 Table 2 Calibration curves,LODs,and LOQs of 13 nucleosides |
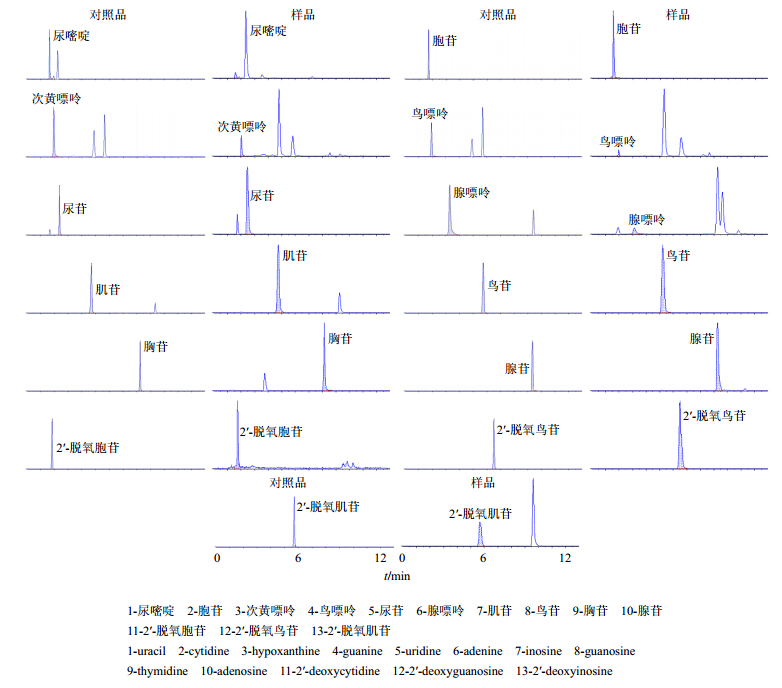 | 图 1 太子参中13种核苷提取离子的MRM图 Fig. 1 MRM of 13 nucleosides in Pseudostellariae Radix |
取一定浓度的混合对照品溶液,平行6次进样,分别计算各核苷峰面积的RSD值;取太子参样品6份,依“2.4”项方法制备供试品溶液,进样测定各核苷质量分数的RSD值;取太子参样品供试液,分别在0、2、4、8、12、24 h进样6次,测定13个核苷峰面积的RSD值,结果见表 3。
| 表 3 精密度、重复性、稳定性和加样回收率试验结果 (n = 6) Table 3 Precision,repeatability,stability,and recovery of 13 ingredients (n = 6) |
取已测定的太子参样品0.5 g 6份,精密称定,分别加入一定量的对照品溶液,按“2.4”项下方法制备加样回收率供试品溶液,在上述分析条件下进样,计算各核苷的加样回收率和RSD,结果见表 3。 2.7 样品测定
将供试品溶液注入液相色谱/质谱联用仪,依法测定。根据相应线性关系计算供试样品中13种核苷的量。不同加工方法处理太子参核苷的量测定结果见表 4。不同加工太子参样品核苷总量大小顺序为S4>S5>S3>S1>S2;除2′-脱氧胞苷的量晒干样品(S1、S2)高于烘干样品(S3、S4、S5)外,其 余核苷的量均以烘干样品为高。
| 表 4 样品中13种核苷的质量分数 (n = 3) Table 4 Contents of 13 nucleosides in different samples(n = 3) |
晒干法:晒干(S1)样品中次黄嘌呤、鸟嘌呤、腺嘌呤、肌苷、2′-脱氧肌苷的量是晒-搓(S2)样品的2~6倍;而晒-搓样品2′-脱氧胞苷的量是晒干样品的8倍;其余核苷的量差异不显著。
烘干法:不同烘干温度下尿嘧啶、胞苷、次黄 嘌呤、鸟嘌呤、尿苷、鸟苷、腺苷的量以60 ℃(S5)较高,腺嘌呤、2′-脱氧鸟苷的量以40 ℃(S3)较高,肌苷、胸苷、2′-脱氧胞苷、2′-脱氧肌苷的量以50 ℃(S4)较高。不同温度间2′-脱氧胞苷、2′-脱氧肌苷的量差异明显,50 ℃下烘干样品的量约为40、60 ℃下样品的2倍,其余核苷的量差异不明显。 3 讨论
从实验结果可以看出,以核苷为评价指标,不同加工方法对太子参中13种核苷的量均有不同程度的影响,13种核苷的量烘干样品普遍高于晒干样品。晒干温度相当于烘干温度35 ℃左右,药材本身含有的分解代谢物的相关酶不易失活,植物仍能进行一些生理活动,不利于有效成分的保留。晒干法是否搓去须根对核苷的量也有一定影响,小部分核苷在除去须根后其量有所差异,其余核苷的量差异不大;不同烘干温度样品核苷总量40 ℃时最低,较高温度可以将酶迅速灭活,减弱了药材的一些生理活动[7];50、60 ℃烘干的样品仅2′-脱氧肌苷的量差异较大。
综上,就核苷而言,烘干法优于晒干法,且以50 ℃烘干为宜,但烘干法需要花费成本,目前太子参产地加工仍以《中国药典》记载的除去须根后直接晒干为主。太子参中核苷类成分与药效的相关性以及加工对其他多指标成分的综合影响,还有待于进一步研究。
本实验建立了Q-TRAP-LC-MS/MS技术同时测定不同产地加工方法太子参中13种核苷类成分的方法,探讨加工方法对太子参中核苷的影响,为优选太子参适宜产地加工方法提供基础资料,同时为太子参药材质量的综合评价提供新的方法参考。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 傅兴圣, 刘训红, 许 虎, 等. 太子参研究现状与研发趋势 [J]. 中国新药杂志, 2012, 21(7): 757-760. |
| [3] | 侯 娅, 马 阳, 邹立思, 等. 基于UPLC-Triple TOF- MS/MS技术分析不同加工方法对太子参化学成分的影响 [J]. 中草药, 2014, 45(19): 2850-2854. |
| [4] | Kinahan J J, Kowal E P, Grindey G B. Biochemical and antitumor effects of the combination of thymidine and 1-β-D-arabinofuranosylcytosine against leukemia L1210 [J]. Cancer Res, 1981, 41(2): 445-451. |
| [5] | Lee J, Chuang T H, Redecke V, et al. Molecular basis for the immunostimulatory activity of guanine nucleoside analogs: activation of Toll-like receptor 7 [J]. Proc Natl Acad Sci USA, 2003, 100(11): 6646-6651. |
| [6] | 王 锐. 嘧啶核苷的研究进展 [J]. 生物技术通讯, 2007, 18(3): 539-542. |
| [7] | 吕洁丽, 陈红丽, 段金廒, 等. 不同加工方法对当归多糖的影响 [J]. 中国中药杂志, 2011, 36(7): 846-849. |
 2015, Vol. 46
2015, Vol. 46


